2020年山东省高考化学试卷(新高考I)
试卷更新日期:2020-07-14 类型:高考真卷
一、选择题
-
1. 实验室中下列做法错误的是( )A、用冷水贮存白磷 B、用浓硫酸干燥二氧化硫 C、用酒精灯直接加热蒸发皿 D、用二氧化碳灭火器扑灭金属钾的燃烧2. 下列叙述不涉及氧化还原反应的是( )A、谷物发酵酿造食醋 B、小苏打用作食品膨松剂 C、含氯消毒剂用于环境消毒 D、大气中NO2参与酸雨形成3. 短周期主族元素X、Y、Z、W的原子序数依次增大,基态X原子的电子总数是其最高能级电子数的2倍,Z可与X形成淡黄色化合物Z2X2 , Y、W最外层电子数相同。下列说法正确的是( )A、第一电离能:W>X>Y>Z B、简单离子的还原性:Y>X>W C、简单离子的半径:W>X>Y>Z D、氢化物水溶液的酸性:Y>W4. 下列关于C、Si及其化合物结构与性质的论述错误的是( )A、键能 、 ,因此C2H6稳定性大于Si2H6 B、立方型SiC是与金刚石成键、结构均相似的共价晶体,因此具有很高的硬度 C、SiH4中Si的化合价为+4,CH4中C的化合价为-4,因此SiH4还原性小于CH4 D、Si原子间难形成双键而C原子间可以,是因为Si的原子半径大于C,难形成 键5. 利用下列装置(夹持装置略)进行实验,能达到实验目的的是( )
 A、用甲装置制备并收集CO2 B、用乙装置制备溴苯并验证有HBr产生 C、用丙装置制备无水MgCl2 D、用丁装置在铁上镀铜6. 从中草药中提取的 calebin A(结构简式如下)可用于治疗阿尔茨海默症。下列关于 calebin A的说法错误的是( )
A、用甲装置制备并收集CO2 B、用乙装置制备溴苯并验证有HBr产生 C、用丙装置制备无水MgCl2 D、用丁装置在铁上镀铜6. 从中草药中提取的 calebin A(结构简式如下)可用于治疗阿尔茨海默症。下列关于 calebin A的说法错误的是( ) A、可与FeCl3溶液发生显色反应 B、其酸性水解的产物均可与Na2CO3溶液反应 C、苯环上氢原子发生氯代时,一氯代物有6种 D、1mol该分子最多与8molH2发生加成反应7. B3N3H6(无机苯)的结构与苯类似,也有大π键。下列关于B3N3H6的说法错误的是( )A、其熔点主要取决于所含化学键的键能 B、形成大π键的电子全部由N提供 C、分子中B和N的杂化方式相同 D、分子中所有原子共平面8. 实验室分离Fe3+和Al3+的流程如下:
A、可与FeCl3溶液发生显色反应 B、其酸性水解的产物均可与Na2CO3溶液反应 C、苯环上氢原子发生氯代时,一氯代物有6种 D、1mol该分子最多与8molH2发生加成反应7. B3N3H6(无机苯)的结构与苯类似,也有大π键。下列关于B3N3H6的说法错误的是( )A、其熔点主要取决于所含化学键的键能 B、形成大π键的电子全部由N提供 C、分子中B和N的杂化方式相同 D、分子中所有原子共平面8. 实验室分离Fe3+和Al3+的流程如下:
知Fe3+在浓盐酸中生成黄色配离子(FeCl4),该配离子在乙醚(Et2O,沸点34.6℃)中生成缔合物 。下列说法错误的是( )
A、萃取振荡时,分液漏斗下口应倾斜向下 B、分液时,应先将下层液体由分液漏斗下口放出 C、分液后水相为无色,说明已达到分离目的 D、蒸馏时选用直形冷凝管9. 以菱镁矿(主要成分为MgCO3 , 含少量SiO2 , Fe2O3和Al2O3)为原料制备高纯镁砂的工艺流程如下:
已知浸出时产生的废渣中有SO2 , Fe(OH)3和Al(OH)3。下列说法错误的是( )
A、浸出镁的反应为 B、浸出和沉镁的操作均应在较高温度下进行 C、流程中可循环使用的物质有NH3、NH4Cl D、分离Mg2+与Al3+、Fe3+是利用了它们氢氧化物Ksp的不同10. 微生物脱盐电池是一种高效、经济的能源装置,利用微生物处理有机废水获得电能,同时可实现海水淡化。现以NaCl溶液模拟海水,采用惰性电极,用下图装置处理有机废水(以含 CH3COO-的溶液为例)。下列说法错误的是( ) A、负极反应为 B、隔膜1为阳离子交换膜,隔膜2为阴离子交换膜 C、当电路中转移1mol电子时,模拟海水理论上除盐58.5g D、电池工作一段时间后,正、负极产生气体的物质的量之比为2:1
A、负极反应为 B、隔膜1为阳离子交换膜,隔膜2为阴离子交换膜 C、当电路中转移1mol电子时,模拟海水理论上除盐58.5g D、电池工作一段时间后,正、负极产生气体的物质的量之比为2:1二、不定项选择题(每小题有一个或两个选项符合要求)
-
11. 下列操作不能达到实验目的的是( )
目的
操作
A
除去苯中少量的苯酚
加入适量NaOH溶液,振荡、静置、分液
B
证明酸性:碳酸>苯酚
将盐酸与NaHCO3混合产生的气体直接通入苯酚钠溶液
C
除去碱式滴定管胶管内的气泡
将尖嘴垂直向下,挤压胶管内玻璃球将气泡排出
D
配制用于检验醛基的氢氧化铜悬浊液
向试管中加入2mL10%NaOH溶液,再滴加数滴2%CuSO4溶液,振荡
A、A B、B C、C D、D12. α-氰基丙烯酸异丁酯可用作医用胶,其结构简式如下。下列关于α-氰基丙烯酸异丁酯的说法错误的是( ) A、其分子式为 C8H11NO2 B、分子中的碳原子有3种杂化方式 C、分子中可能共平面的碳原子最多为6个 D、其任一含苯环的同分异构体中至少有4种不同化学环境的氢原子13. 采用惰性电极,以去离子水和氧气为原料通过电解法制备双氧水的装置如下图所示。忽略温度变化的影响,下列说法错误的是( )
A、其分子式为 C8H11NO2 B、分子中的碳原子有3种杂化方式 C、分子中可能共平面的碳原子最多为6个 D、其任一含苯环的同分异构体中至少有4种不同化学环境的氢原子13. 采用惰性电极,以去离子水和氧气为原料通过电解法制备双氧水的装置如下图所示。忽略温度变化的影响,下列说法错误的是( )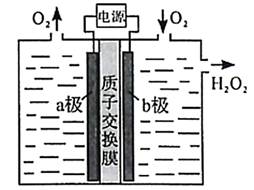 A、阳极反应为 B、电解一段时间后,阳极室的pH未变 C、电解过程中,H+由a极区向b极区迁移 D、电解一段时间后,a极生成的O2与b极反应的O2等量14. 1,3-丁二烯与HBr发生加成反应分两步:第一步H+进攻1,3-丁二烯生成碳正离子(
A、阳极反应为 B、电解一段时间后,阳极室的pH未变 C、电解过程中,H+由a极区向b极区迁移 D、电解一段时间后,a极生成的O2与b极反应的O2等量14. 1,3-丁二烯与HBr发生加成反应分两步:第一步H+进攻1,3-丁二烯生成碳正离子( );第二步Br -进攻碳正离子完成1,2-加成或1,4-加成。反应进程中的能量变化如下图所示。已知在0℃和40℃时,1,2-加成产物与1,4-加成产物的比例分别为70:30和15:85。下列说法正确的是( )
);第二步Br -进攻碳正离子完成1,2-加成或1,4-加成。反应进程中的能量变化如下图所示。已知在0℃和40℃时,1,2-加成产物与1,4-加成产物的比例分别为70:30和15:85。下列说法正确的是( )  A、1,4-加成产物比1,2-加成产物稳定 B、与0℃相比,40℃时1,3-丁二烯的转化率增大 C、从0℃升至40℃,1,2-加成正反应速率增大,1,4-加成正反应速率减小 D、从0℃升至40℃,1,2-加成正反应速率的增大程度小于其逆反应速率的增大程度15. 25℃时,某混合溶液中 ,1gc( CH3COOH)、1gc(CH3COO-)、lgc(H+)和1gc(OH-)随pH变化的关系如下图所示。Ka为CH3COOH的电离常数,下列说法正确的是( )
A、1,4-加成产物比1,2-加成产物稳定 B、与0℃相比,40℃时1,3-丁二烯的转化率增大 C、从0℃升至40℃,1,2-加成正反应速率增大,1,4-加成正反应速率减小 D、从0℃升至40℃,1,2-加成正反应速率的增大程度小于其逆反应速率的增大程度15. 25℃时,某混合溶液中 ,1gc( CH3COOH)、1gc(CH3COO-)、lgc(H+)和1gc(OH-)随pH变化的关系如下图所示。Ka为CH3COOH的电离常数,下列说法正确的是( ) A、O点时, B、N点时, C、该体系中, D、pH由7到14的变化过程中, CH3COO-的水解程度始终增大
A、O点时, B、N点时, C、该体系中, D、pH由7到14的变化过程中, CH3COO-的水解程度始终增大三、非选择题
-
16. 用软锰矿(主要成分为MnO2 , 含少量Fe3O4、Al2O3)和BaS制备高纯MnCO3的工艺流程如下:
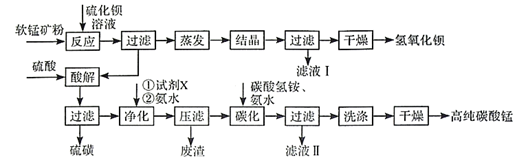
已知:MnO2是一种两性氧化物;25℃时相关物质的Ksp见下表。
物质
Fe(OH)2
Fe(OH)3
Al(OH)3
Mn(OH)2
Ksp
回答下列问题
(1)、软锰矿预先粉碎的目的是 , MnO2与BaS溶液反应转化为MnO的化学方程式为。(2)、保持BaS投料量不变,随MnO2与BaS投料比增大,S的量达到最大值后无明显变化,而Ba(OH)2的量达到最大值后会减小,减小的原因是。(3)、滤液I可循环使用,应当将其导入到操作中(填操作单元的名称)。(4)、净化时需先加入的试剂X为(填化学式)。再使用氨水调溶液的pH,则pH的理论最小值为(当溶液中某离子浓度 时,可认为该离子沉淀完全)。(5)、碳化过程中发生反应的离子方程式为。17. CdSnAs2是一种高迁移率的新型热电材料,回答下列问题:(1)、Sn为ⅣA族元素,单质Sn与干燥Cl2反应生成SnCl4。常温常压下SnCl4为无色液体,SnCl4空间构型为 , 其固体的晶体类型为。(2)、NH3、PH3、AsH3的沸点由高到低的顺序为(填化学式,下同),还原性由强到弱的顺序为 , 键角由大到小的顺序为。(3)、含有多个配位原子的配体与同一中心离子(或原子)通过螯合配位成环而形成的配合物为螯合物。一种Cd2+配合物的结构如图所示,1mol该配合物中通过螯合作用形成的配位键有mol,该螯合物中N的杂化方式有种。 (4)、以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,称作原子的分数坐标。四方晶系CdSnAs2的晶胞结构如图所示,晶胞棱边夹角均为90°,晶胞中部分原子的分数坐标如下表所示。
(4)、以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,称作原子的分数坐标。四方晶系CdSnAs2的晶胞结构如图所示,晶胞棱边夹角均为90°,晶胞中部分原子的分数坐标如下表所示。坐标
原子
x
y
z
Cd
0
0
0
Sn
0
0
0.5
As
0.25
0.25
0.125

一个晶胞中有个Sn,找出距离Cd(0,0,0)最近的Sn(用分数坐标表示)。CdSnAs2
晶体中与单个Sn键合的As有个。
18. 探究CH3OH合成反应化学平衡的影响因素,有利于提高CH3OH的产率。以CO2、H2为原料合成CH3OH涉及的主要反应如下:Ⅰ.
Ⅱ.
Ⅲ.
回答下列问题:
(1)、 。(2)、一定条件下,向体积为VL的恒容密闭容器中通入1 mol CO2和3 mol H2发生上述反应,达到平衡时,容器中CH3OH(g)为ɑ mol,CO为b mol,此时H2O(g)的浓度为mol﹒L-1(用含a、b、V的代数式表示,下同),反应Ⅲ的平衡常数为。(3)、不同压强下,按照n(CO2):n(H2)=1:3投料,实验测定CO2的平衡转化率和CH3OH的平衡产率随温度的变化关系如下图所示。
已知:CO2的平衡转化率=
CH3OH的平衡产率=
其中纵坐标表示CO2平衡转化率的是图(填“甲”或“乙”);压强p1、p2、p3由大到小的顺序为;图乙中T1温度时,三条曲线几乎交于一点的原因是。
(4)、为同时提高CO2的平衡转化率和CH3OH的平衡产率,应选择的反应条件为_________(填标号)。A、低温、高压 B、高温、低压 C、低温、低压 D、高温、高压19. 化合物F是合成吲哚-2-酮类药物的一种中间体,其合成路线如下:(
 )
) 
知:Ⅰ.


Ⅱ.



Ⅲ.


Ar为芳基;X=Cl,Br;Z或Z′=COR, CONHR,COOR等。
回答下列问题:
(1)、实验室制备A的化学方程式为 , 提高A产率的方法是;A的某同分异构体只有一种化学环境的碳原子,其结构简式为。(2)、C→D的反应类型为;E中含氧官能团的名称为。(3)、C的结构简式为 , F的结构简式为。(4)、Br2和 的反应与Br2和苯酚的反应类似,以
的反应与Br2和苯酚的反应类似,以  和
和  为原料合成
为原料合成  ,写出能获得更多目标产物的较优合成路线(其它试剂任选)。 20. 某同学利用Cl2氧化K2MnO4制备KMnO4的装置如下图所示(夹持装置略):
,写出能获得更多目标产物的较优合成路线(其它试剂任选)。 20. 某同学利用Cl2氧化K2MnO4制备KMnO4的装置如下图所示(夹持装置略):
已知:锰酸钾(K2MnO4)在浓强碱溶液中可稳定存在,碱性减弱时易发生反应:
回答下列问题:
(1)、装置A中a的作用是;装置C中的试剂为;装置A中制备Cl2的化学方程为。(2)、上述装置存在一处缺陷,会导致KMnO4产率降低,改进的方法是。(3)、KMnO4常作氧化还原滴定的氧化剂,滴定时应将KMnO4溶液加入(填“酸式”或“碱式”)滴定管中;在规格为50.00mL的滴定管中,若KMnO4溶液起始读数为15.00mL,此时滴定管中KMnO4溶液的实际体积为(填标号)。A.15.00 mL B.35.00mL C.大于35.00mL D.小于15.00m1
(4)、某FeC2O4﹒2H2O样品中可能含有的杂质为Fe2(C2O4)3、H2C2O4﹒2H2O,采用KMnO4滴定法测定该样品的组成,实验步骤如下:Ⅰ.取mg样品于锥形瓶中,加入稀H2SO4溶解,水浴加热至75℃。用 c mol﹒L-1的KMnO4溶液趁热滴定至溶液出现粉红色且30s内不褪色,消耗KMnO4溶液V1mL。
Ⅱ.向上述溶液中加入适量还原剂将Fe3+完全还原为Fe2+ , 加入稀H2SO4酸化后,在75℃继续用KMnO4溶液滴定至溶液出现粉红色且30s内不褪色,又消耗KMnO4溶液V2mL。
样品中所含 的质量分数表达式为。
下列关于样品组成分析的说法,正确的是(填标号)。
A. 时,样品中一定不含杂质
B. 越大,样品中 含量一定越高
C.若步骤I中滴入KMnO4溶液不足,则测得样品中Fe元素含量偏低
D.若所用KMnO4溶液实际浓度偏低,则测得样品中Fe元素含量偏高