浙教版科学2020年八升九暑假衔接训练:第8讲 质量守恒
试卷更新日期:2020-07-14 类型:复习试卷
一、单选题
-
1. 如图,四位同学正在讨论某一个化学方程式表示的意义。下列四个化学方程式中,同时符合这四位同学所描述的是( )
 A、S+O2 SO2 B、CH4+2O2 CO2+2H2O C、2H2+O2 2H2O D、2KMnO4 K2MnO4+MnO2+O2↑2. 科学研究表明,氨气在常压下就可液化为液氨,液氨可用作汽车的清洁燃料,其燃烧时的主要反应为4NH3+3O2 2X+6H2O,则X的化学式为( )A、NO B、N2 C、NO2 D、O23. 在化学反应A2+BC=B+A2C中,反应物BC与生成物B的质量关系如图所示。将2gA2与80gBC恰好完全反应,则生成A2C的质量为( )
A、S+O2 SO2 B、CH4+2O2 CO2+2H2O C、2H2+O2 2H2O D、2KMnO4 K2MnO4+MnO2+O2↑2. 科学研究表明,氨气在常压下就可液化为液氨,液氨可用作汽车的清洁燃料,其燃烧时的主要反应为4NH3+3O2 2X+6H2O,则X的化学式为( )A、NO B、N2 C、NO2 D、O23. 在化学反应A2+BC=B+A2C中,反应物BC与生成物B的质量关系如图所示。将2gA2与80gBC恰好完全反应,则生成A2C的质量为( ) A、64g B、80g C、18g D、9g4. 如图是小明整理的与氧气化学性质有关的部分笔记,他归纳了以下四点,其中不合理的是( )
A、64g B、80g C、18g D、9g4. 如图是小明整理的与氧气化学性质有关的部分笔记,他归纳了以下四点,其中不合理的是( )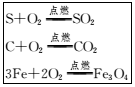 A、都是单质与单质反应 B、都是氧化反应 C、都生成了化合物 D、都生成了气体5. 质X在4.8g氧气中恰好完全燃烧,反应方程式为X+3O2点燃RO2+2SO2 , 测得RO2和SO2的质量分别为2.2g和6.4g,下列判断中正确的是( )A、参加反应的X的质量为4.3g B、X的相对分子质量为76 C、X中含有R元素、S元素和O元素 D、产物为气态时都是空气污染物6. 在一密闭容器内有氧气、二氧化碳、水蒸气和一种未知物W,在一定条件下充分反应,测得反应前后各物质的质量如表所示,则下列说法中错误的是( )。
A、都是单质与单质反应 B、都是氧化反应 C、都生成了化合物 D、都生成了气体5. 质X在4.8g氧气中恰好完全燃烧,反应方程式为X+3O2点燃RO2+2SO2 , 测得RO2和SO2的质量分别为2.2g和6.4g,下列判断中正确的是( )A、参加反应的X的质量为4.3g B、X的相对分子质量为76 C、X中含有R元素、S元素和O元素 D、产物为气态时都是空气污染物6. 在一密闭容器内有氧气、二氧化碳、水蒸气和一种未知物W,在一定条件下充分反应,测得反应前后各物质的质量如表所示,则下列说法中错误的是( )。 A、根据质量守恒定律,X的值应为0 B、反应后的生成物是二氧化碳和水 C、氧元素的化合价在反应前后发生改变 D、物质W只含碳、氢两种元素7. 把一定质量的甲、乙、丙、丁四种物质放入一密闭容器中,在一定条件下反应一段时间,测得反应后各物质的质量如下,则下列说法中错误的是( )
A、根据质量守恒定律,X的值应为0 B、反应后的生成物是二氧化碳和水 C、氧元素的化合价在反应前后发生改变 D、物质W只含碳、氢两种元素7. 把一定质量的甲、乙、丙、丁四种物质放入一密闭容器中,在一定条件下反应一段时间,测得反应后各物质的质量如下,则下列说法中错误的是( )物质
甲
乙
丙
丁
反应前的质量(g)
7.6
2.0
0.2
0
反应后的质量(g)
3.2
X
5.8
0.4
A、X=0.4 B、上述反应为分解反应 C、甲和乙是反应物 D、反应中的甲、丙发生改变的质量比是11:148. 某同学从定量角度研究双氧水制取氧气的过程,对原实验进行部分改进,增加了称量操作。具体做法是:取 10%的双氧水和少量的二氧化锰放入气体发生装置,并对反应前后混合物的质量进行称量,记录如下:(不计水分的蒸发)反应过程
反应前
反应后
质量变化(不含容器质量)
34.3g
32.7g
若反应后,双氧水分解完全且氧气全部逸出,该同学得出的结论中,不合理的是( )
A、整个反应过程中反应速率逐渐加快 B、反应得到氧气的质量为 1.6g C、催化剂二氧化锰的质量为 0.3g D、反应所得的水和氧气质量比为 9∶89. 用“ ”和“
”和“  ”代表两种不同的单质分子,它们在一定条件下能发生化学反应,反应前后的模拟模型如下图所示,下列说法正确的是( )
”代表两种不同的单质分子,它们在一定条件下能发生化学反应,反应前后的模拟模型如下图所示,下列说法正确的是( )
 A、该反应有2种生成物 B、参加反应的“
A、该反应有2种生成物 B、参加反应的“ ”和“
”和“  ”分子的个数比是 1︰2
C、该反应是化合反应
D、该反应不遵循质量守恒定律
10. 在一密闭容器中,有甲、乙、丙、丁四种物质,在一定的条件下,充分反应,测得反应前后各物质质量如下表关于此反应,下列认识正确的是( )
”分子的个数比是 1︰2
C、该反应是化合反应
D、该反应不遵循质量守恒定律
10. 在一密闭容器中,有甲、乙、丙、丁四种物质,在一定的条件下,充分反应,测得反应前后各物质质量如下表关于此反应,下列认识正确的是( )物质
甲
乙
丙
丁
反应前质量(g)
4
1
42
10
反应后质量(g)
待测
20
6
31
A、该变化的基本反应类型一定是置换反应 B、参加反应的甲、丙的质量比为 1:9 C、乙、丁的相对分子质量比一定为 10:9 D、甲完全反应后的质量为 8 克11. 如图是“尾气催化转换器”将汽车尾气中有毒气体转变为无毒气体的微观示意图,其中不同的圆圈代表不同的原子.下列说法正确的是( ) A、此反应有单质生成 B、原子在化学变化中是可分的 C、此反应有三种新物质生成 D、参加反应的两种分子的个数比为 2:112. 在一密闭容器中发生某反应,其中甲、乙、丙、丁四种物质的质量变化如表所示,下列判断正确的是( )
A、此反应有单质生成 B、原子在化学变化中是可分的 C、此反应有三种新物质生成 D、参加反应的两种分子的个数比为 2:112. 在一密闭容器中发生某反应,其中甲、乙、丙、丁四种物质的质量变化如表所示,下列判断正确的是( )物质
甲
乙
丙
丁
反应前质量(g)
10
16
0
0
反应中质量(g)
8.6
m2
m3
1.6
反应后质量(g)
m4
m1
15.2
6.4
A、m1的值一定是 0,反应后甲一定有剩余 B、m2的值是 4 C、该反应不可能是氧化反应 D、m4+m1﹥m2+m3二、填空题
-
13. 在 2A+6B=2C+3D 反应中,54克A在400克B中完全反应,生成264克C和6克D,则有 克B参加反应,反应中A 和D 的相对分子质量比为。14. 益阳市桃江县硫铁矿厂开采的黄铁矿(主要成分是FeS2),是生产H2SO4的重要原料。利用黄铁矿生产H2SO4的第一步反应为:4FeS2+11O2═2Fe2O3+8X。所得产物Fe2O3是冶炼铁的重要原料。回答下列问题:(1)、已知FeS2中Fe的化合价为+2,则S的化合价为。(2)、X的化学式是。15. 取氯酸钾和二氧化锰的混合物15.50克,放入一个大试管中加热,完全反应后冷却到反应前的温度,称得残余固体物质的质量为10.70克。求:(1)、生成氧气的质量克?(2)、原混合物中二氧化锰克?16. 在一个密闭容器中有A、B、C、D四种物质,在一定条件下充分反应,测得数据如表:
物质
A
B
C
D
反应前的质量/g
6.4
3.2
4.0
2.8
反应后的质量/g
5.2
待测
7.2
2.0
反应后待测的B的质量是克,该反应所属的基本反应类型是。
17. 定量研究对于化学科学发展有重要意义,因此我们应该掌握有关质量守恒的相关知识。(1)、在化学变化前后一定不变的是 (选填序号)。①原子数目
②原子的种类
③分子数目
④分子的种类
⑤元素的种类
⑥物质的总质量
⑦物质的种类
(2)、验证质量守恒定律时,下列A,B,C三个实验设计中能达到实验目的是(选填序号)。 (3)、“
(3)、“ “、“
“、“  ”、“
”、“  ”分别表示A、B、C三种物质的分子。如图形象地表示了某化学反应前后反应物与生成物分子及其数目的变化。则该反应的化学方程式中A、B、C前面的化学计量数之比为 。
”分别表示A、B、C三种物质的分子。如图形象地表示了某化学反应前后反应物与生成物分子及其数目的变化。则该反应的化学方程式中A、B、C前面的化学计量数之比为 。
 (4)、氧烛是一种用于缺氧环境中自救的化学氧源,广泛用于航空、航海等领域。其主要成分为NaClO3 , 还含有适量的催化剂、成型剂等。氧烛通过撞击火帽引发反应后,能持续放出高纯氧气,主要反应原理为2NaClO3=2X+3O2↑,则X的化学式为。
(4)、氧烛是一种用于缺氧环境中自救的化学氧源,广泛用于航空、航海等领域。其主要成分为NaClO3 , 还含有适量的催化剂、成型剂等。氧烛通过撞击火帽引发反应后,能持续放出高纯氧气,主要反应原理为2NaClO3=2X+3O2↑,则X的化学式为。三、解答题
-
18. 某学习小组在实验室中用加热KClO3和MnO2混合物的方法制取O2 , 反应过程中固体质量变化如图所示,请计算。
 (1)、制取O2的质量是g。(2)、原混合物中KClO3的质量分数。(写出计算过程,计算结果精确到0.1%)19. 有A、B两种物质组成的混合物四份,总质量均为12克。A和B在一定条件下可发生化合反应生成物质C。四份混合物内含A和B的质量,及它们充分反应后生成C的质量见表。
(1)、制取O2的质量是g。(2)、原混合物中KClO3的质量分数。(写出计算过程,计算结果精确到0.1%)19. 有A、B两种物质组成的混合物四份,总质量均为12克。A和B在一定条件下可发生化合反应生成物质C。四份混合物内含A和B的质量,及它们充分反应后生成C的质量见表。物质
第一份
第二份
第三份
第四份
反应前A的质量(克)
11
8
a
反应前B的质量(克)
1
4
b
反应后生成C的质量(克)
5
10
7.5
(1)、第一份混合物中参加反应的A和B的质量比为。(2)、第二份混合物在反应结束后,反应物中的有剩余。(3)、若第三份混合物恰好能完全反应,则a的值是。(4)、第四份混合物反应前,A和B的质量比为。20. 将9.5克KClO3和MnO2的混合物装入大试管中,加热至质量不再发生变化,冷却试管后称量,剩有6.62克固体物质。计算:(1)、写出上述涉及到的化学方程式。(2)、6.62克固体中含有哪些物质?各多少克?21. 把 4g 硫粉放在给定质量的氧气中燃烧,有关实验数据如下表所示,请回答下列问题。第一次
第二次
第三次
O2 的质量(g)
3
4
6
SO2 的质量(g)
6
8
8
(1)、上述实验中,第次实验恰好完全反应;(2)、上述实验中,第三次实验中参加反应的氧气为克;在这三次实验中,符合质量守恒定律的是。22. 人体注射葡萄糖溶液可以补充能量,葡萄糖(C6H12O6)在体内经缓慢氧化生成二氧化碳和水,释放出能量。若1 000克5%葡萄糖注射液中的葡萄糖完全氧化,计算:(1)、理论上至少消耗O2多少克?(2)、多少升空气中含有这些质量的氧气?(氧气密度为1.43克/升)23. 对“24.5g氯酸钾受热完全分解产生多少克氧气”一题,小莉和小华两位同学分别采用了两种不同的计算方法。小莉同学的解法及计算过程
小华同学的解法及计算过程
解:设可产生氧气的质量为x
2KClO3
KCl+
3O2↑
245
96
24.5g
x
x= =9.6g
答:可产生氧气9.6g。
解:24.5aKClO3中氧元素的质量为:
24.5g× ×100%
=24.5g× ×100%
=9.6g
则氧气的质量为9.6g
答:可产生氧气9.6g。
试回答下列问题:
(1)、你认为他们的解题思路和方法都正确吗?答:;(2)、若要计算7.9g高锰酸钾受热完全分解产生氧气的质量,你认为也能用上述两种方法解答吗?请你把能用的解法和计算过程写下来。