浙教版科学2020年八升九暑假衔接训练:第4讲 原子、离子
试卷更新日期:2020-07-14 类型:复习试卷
一、单选题
-
1. 俄国科学家门捷列夫对元素周期表的编制作出巨大献,人们将101号元素命名为“钔”来纪念他。钔原子的核电荷数为101,相对原子质量为258,则钔原子的核外电子数为( )A、101 B、157 C、258 D、3592. 卢瑟福在分析α粒子轰击原子实验结果的基础上,提出如图所示的原子核式结构这一研究过程是一个( )
 A、验证证据的过程 B、得出结论的过程 C、提出问题的过程 D、建立模型的过程3. 简单原子的原子结构可用下图形象地表示,其中“
A、验证证据的过程 B、得出结论的过程 C、提出问题的过程 D、建立模型的过程3. 简单原子的原子结构可用下图形象地表示,其中“ ”表示质子或电子,“
”表示质子或电子,“  ”表示中子,则下列有关①②③的叙述正确的是( )
”表示中子,则下列有关①②③的叙述正确的是( )  A、①②③分别为氢、氦、锂的原子 B、①②③互为同位素 C、①②③是三种化学性质不同的离子 D、①②③具有相同的相对原子质量4. 用“
A、①②③分别为氢、氦、锂的原子 B、①②③互为同位素 C、①②③是三种化学性质不同的离子 D、①②③具有相同的相对原子质量4. 用“ ”“
”“  ”和“●”分别表示质子、中子和电子,如图表示四种原子结构模型,下列有关说法正确的是( )
”和“●”分别表示质子、中子和电子,如图表示四种原子结构模型,下列有关说法正确的是( )  A、甲、乙互为同位素 B、甲、丙为同一种原子 C、甲、丙的核电荷数不同 D、乙、丁为同一种元素5. 核电站使用铀作燃料发电,铀的相对原子质量为238,质子数为92,则铀原子的核外电子数为( )A、238 B、146 C、136 D、926. 已知氚原子中含有1个质子和2个中子,下列能正确表示氚原子结构的是( )
A、甲、乙互为同位素 B、甲、丙为同一种原子 C、甲、丙的核电荷数不同 D、乙、丁为同一种元素5. 核电站使用铀作燃料发电,铀的相对原子质量为238,质子数为92,则铀原子的核外电子数为( )A、238 B、146 C、136 D、926. 已知氚原子中含有1个质子和2个中子,下列能正确表示氚原子结构的是( )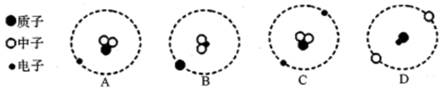 A、A B、B C、C D、D7. 某原子A的质子数为a,若B3+和A2-具有相同的核外电子数,则B元素的质子数为( )A、a+1 B、a-1 C、a+5 D、a-58. 随着世界经济的快速增长,对能源的需求也越来越大,核能作为清洁的能源,对于缓解能源紧张局面,减轻环境污染具有积极作用。已知某核电站的核原料为铀235,其原子核内含有92个质子和143个中子,那么( )A、该原子核外有143个电子 B、该元素是非金属元素 C、该原子的相对质量为235克 D、该原子核带92个单位的正电荷9. 国产大型客机C919部分机身采用了新型的铝锂合金,这种材料具有较高的强度和适宜的延展性。铝锂合金中的铝(Al)元素与锂(Li)元素的本质区别是( )A、元素符号不同 B、原子的质子数不同 C、原子质量不同 D、原子的电子数不同10. 根据下列表格信息可知,互为同位素原子的是( )
A、A B、B C、C D、D7. 某原子A的质子数为a,若B3+和A2-具有相同的核外电子数,则B元素的质子数为( )A、a+1 B、a-1 C、a+5 D、a-58. 随着世界经济的快速增长,对能源的需求也越来越大,核能作为清洁的能源,对于缓解能源紧张局面,减轻环境污染具有积极作用。已知某核电站的核原料为铀235,其原子核内含有92个质子和143个中子,那么( )A、该原子核外有143个电子 B、该元素是非金属元素 C、该原子的相对质量为235克 D、该原子核带92个单位的正电荷9. 国产大型客机C919部分机身采用了新型的铝锂合金,这种材料具有较高的强度和适宜的延展性。铝锂合金中的铝(Al)元素与锂(Li)元素的本质区别是( )A、元素符号不同 B、原子的质子数不同 C、原子质量不同 D、原子的电子数不同10. 根据下列表格信息可知,互为同位素原子的是( )质子数 中子数 电子数 M 12 12 10 N 10 10 10 O 11 11 11 P 11 12 10 Q 11 12 11
A、M、N、P B、O、Q C、O、P D、O、P、Q11. 我国研制新型环保磁制冷冰箱,钆(Gd)是所需的重要材料。钆元素相对原子质量为157,核电荷数为64,则该原子核外电子数为( )A、64 B、57 C、93 D、12812. 科学家已研制成以锶原子做钟摆的“光格钟”,成为世界上最精确的钟。已知一种锶原子的相对原子质量为88,其质子数是38,则这种锶原子的核外电子数为( )A、126 B、88 C、50 D、3813. 联合国把2019年定为“元素周期表年”。俄国科学家门捷列夫对元素周期表的编制做出巨大贡献,人们将101号元素命名为“钔来纪念他。钔原子的核电荷数为101,相对原子质量为258,则钔原子的质子数为( )A、101 B、157 C、258 D、35914. 著名科学家居里夫人首先发现某些原子具有放射性,即原子能自动放射出一些粒子。若一种元素的原子经过放射变成了另一种元素的原子,则此原子放射出的粒子中一定有 ( )A、电子 B、中子 C、质子 D、原子核15. 关于原子及原子结构发现史的说法不正确的是( )A、汤姆森、卢瑟福两位科学家都是在实验的基础上,通过推理和想象建构原子模型 B、汤姆森发现了电子,证实原子是可分的 C、原子的最外层电子数发生变化时,元素的种类也发生了变化 D、原子在化学变化中的表现主要取决于原子的最外层电子二、填空题
-
16. 如图表示氯化钠微观形成过程,该过程说明原子通过电子形成离子,并可知氯化钠是由构成。
 17. 下表是小明收集的一些微粒的资料,请根据表格数据,回答下列问题。
17. 下表是小明收集的一些微粒的资料,请根据表格数据,回答下列问题。粒子名称
质子数
中子数
电子数
A
14
14
14
B
26
30
24
C
14
14
18
D
14
18
14
(1)、B微粒所带的电性为。(填“不带电”、“带正电”或“带负电”)(2)、与A互为同位素原子的是。18. 在科学中,寻找相同点和不同点是很好的学习方法。(1)、对Fe、Fe2+、Fe3+三种粒子,小科同学找到了以下相同点的判断,正确的是 。①核电荷数相同②核外电子数相等③每个粒子所带电荷数相同④质量几乎相等⑤所含的质子数相等
(2)、C-12和C-14是碳元素的两种不同的原子,二者的不同点有。①原子中的电子数;②原子核内的中子数;③原子核内的质子数;④原子的质量。
19. 下表为几种常见元素原子的结构信息,请认真阅读分析后并回答:符号、质子数、中子数、核外电子数、相对原子质量;符号
质子数
中子数
核外电子数
相对原子质量
C
6
6
6
12
H
1
0
1
1
O
8
8
8
16
Na
11
12
11
23
Fe
26
30
26
56
(1)、构成原子的微粒有种,原子中一定含有的微粒是 ,(2)、你还能获得有关原子结构的其他信息吗?(写出两条即可)。①。
②。
三、实验探究题
-
20. 探究原子结构的奥秘:1803年英国科学家道尔顿提出了近代原子学说,他认为一切物质是由原子构成的,这些原子是微小的不可分割的实心球。1911年,英国科学家卢瑟福用一束平行高速运动的α粒子(α粒子是带两个单位正电荷的氦原子)轰击金箔时(金原子的核电荷数为79,相对原子质量为197),发现大多数α粒子能穿透金箔,而且不改变原来的运动方向,但是也有一小部分α粒子改变了原来的运动路径,甚至有极少数的α粒子好像碰到了坚硬不可穿透的质点而被弹了回来(如图)。
 (1)、若原子质量、正电荷在原子内均匀分布,则极少数α粒子就(选填“会”或“不会”)发生大角度散射。(2)、绝大多数α粒子穿过后方向不变,说明 (填序号)。A、原子内部绝大部分空间是空的 B、原子的质量是均匀分布的(3)、从原子结构模型建立的过程中,我们发现 (填序号)。A、科学模型的建立是一个不断完善、不断修正的过程 B、模型在科学研究中起着很重要的作用 C、波尔的原子模型建立,使人们对原子结构的认识达到了完美的境界 D、人类借助模型的建立,对原子的认识逐渐接近本质21. 伟大的科学家费曼说:“假如只允许把人类的科学史压缩成一句话,它就会是——一切东西都是由原子构成的”。人类在探索物质是由什么构成的历史长河中,充满了智慧。(1)、1803年,近代化学之父,英国科学家道尔顿在前人研究的基础上,提出“道尔顿原子论”:一切物质都由原子构成,原子很小、呈圆球状、不可再分……但由于受当时实验条件限制,道尔顿无法用事实证明自己的观点。1811年,意大利化学家阿伏加德罗提出:有些物质也是由分子构成,原子的基本工作形式是分子。1897年,汤姆生通过实验发现了电子,进一步发展了原子一分子论。汤姆生主要是纠正了“道尔顿原子论”中的观点。1911年,卢瑟福又通过实验,推测原子由构成,并提出了沿用至今的现代原子结构理论。(2)、道尔顿的原子论,不是事实的归纳,而是思维的产物,体现了直觉和想象在科学创造中的作用。在科学研究中,像汤姆生和卢瑟福这样,对实验现象进行解释的过程叫作。(3)、原子是一种看不见、摸不着的微粒,为了帮助人们理解原子的结构,这三位科学家都运用了来表达他们的理论成果。
(1)、若原子质量、正电荷在原子内均匀分布,则极少数α粒子就(选填“会”或“不会”)发生大角度散射。(2)、绝大多数α粒子穿过后方向不变,说明 (填序号)。A、原子内部绝大部分空间是空的 B、原子的质量是均匀分布的(3)、从原子结构模型建立的过程中,我们发现 (填序号)。A、科学模型的建立是一个不断完善、不断修正的过程 B、模型在科学研究中起着很重要的作用 C、波尔的原子模型建立,使人们对原子结构的认识达到了完美的境界 D、人类借助模型的建立,对原子的认识逐渐接近本质21. 伟大的科学家费曼说:“假如只允许把人类的科学史压缩成一句话,它就会是——一切东西都是由原子构成的”。人类在探索物质是由什么构成的历史长河中,充满了智慧。(1)、1803年,近代化学之父,英国科学家道尔顿在前人研究的基础上,提出“道尔顿原子论”:一切物质都由原子构成,原子很小、呈圆球状、不可再分……但由于受当时实验条件限制,道尔顿无法用事实证明自己的观点。1811年,意大利化学家阿伏加德罗提出:有些物质也是由分子构成,原子的基本工作形式是分子。1897年,汤姆生通过实验发现了电子,进一步发展了原子一分子论。汤姆生主要是纠正了“道尔顿原子论”中的观点。1911年,卢瑟福又通过实验,推测原子由构成,并提出了沿用至今的现代原子结构理论。(2)、道尔顿的原子论,不是事实的归纳,而是思维的产物,体现了直觉和想象在科学创造中的作用。在科学研究中,像汤姆生和卢瑟福这样,对实验现象进行解释的过程叫作。(3)、原子是一种看不见、摸不着的微粒,为了帮助人们理解原子的结构,这三位科学家都运用了来表达他们的理论成果。