陕西省榆林市2020年高考理综-化学3月线上模拟试卷
试卷更新日期:2020-07-09 类型:高考模拟
一、单选题
-
1. 新型冠状病毒是一种致病性很强的 RNA 病毒,下列说法错误的是( )A、新型冠状病毒组成元素中含有 C、H、O B、用“84 消毒液”进行消毒时,消毒液越浓越好 C、3M 防颗粒物口罩均使用 3M 专有高效过滤材料——聚丙烯材质,聚丙烯属于高分子 D、不去人群聚集处、勤洗手可预防新型冠状病毒2. 下列关于古籍中的记载说法正确的是( )A、《本草经集注》中关于鉴别硝石(KNO3)和朴硝(Na2SO4)的记载:“以火烧之,紫青烟 起,乃真硝石也”,该方法应用了显色反应 B、氢化钙的电子式是:Ca2+[∶H]2– C、目前,元素周期表已经排满,第七周期最后一种元素的原子序数是 118 D、直径为 20nm 的纳米碳酸钙属于胶体3. 设 NA 为阿伏加德罗常数的数值,下列说法正确的是( )A、22.4 L 乙烷中所含的极性共价键数目为 7NA B、某温度下,将 1molCl2 通入足量水中转移电子数为 NA C、常温常压下,3.0 g 含葡萄糖的冰醋酸中含有的原子总数为 0.4NA D、室温下,1LpH 为 13 的 NaOH 溶液和 Ba(OH)2 混合溶液中含 OH-个数为 0.01NA4. 下列说法正确的是( )A、Fe3+、SCN-、NO3-、Cl-可以大量共存 B、某碱溶液中通入少量 CO2 产生白色沉淀,该碱一定是 Ca(OH)2 C、Na[Al(OH)4]溶液和 NaHCO3 溶液混合可以产生白色沉淀和无色气体 D、少量的 Mg(HCO3)2 溶液加过量的 Ba(OH)2 溶液的离子方程式为:Mg2++2HCO3-+2Ba2++4OH-=2BaCO3↓+Mg(OH)2↓+2H2O5. 短周期主族元素 X、Y、Z、W、Q 的原子序数依次增大,其中 X 原子的质子总数与电子 层数相等,X、Z 同主族,Y、W 同主族,且 Y、W 形成的一种化合物甲是常见的大气污 染物。下列说法正确的是( )A、简单离子半径:Z<Y<W<Q B、Y 能分别与 X、Z、W 形成具有漂白性的化合物 C、非金属性:W<Q,故 W、Q 的氢化物的水溶液的酸性:W<Q D、电解 Z 与 Q 形成的化合物的水溶液可制得 Z 的单质6. 洛匹那韦是一种 HIV-1 和 HIV-2 的蛋白酶的抑制剂, 下图是洛匹那韦的结构简式,下列 有关洛匹那韦说法错误的是( )
 A、在一定条件下能发生水解反应 B、分子中有四种含氧官能团 C、分子式是 C37H48N4O4 D、分子间可形成氢键7. 利用电解质溶液的浓度对电极电势的影响,可设计浓差电池。下图为一套浓差电池和电解质溶液再生的配套装置示意图,闭合开关K之前,两个Cu电极的质量相等。下列有关这套装置的说法中错误的是( )
A、在一定条件下能发生水解反应 B、分子中有四种含氧官能团 C、分子式是 C37H48N4O4 D、分子间可形成氢键7. 利用电解质溶液的浓度对电极电势的影响,可设计浓差电池。下图为一套浓差电池和电解质溶液再生的配套装置示意图,闭合开关K之前,两个Cu电极的质量相等。下列有关这套装置的说法中错误的是( ) A、循环物质E为水 B、乙池中Cu电极为阴极,发生还原反应 C、甲池中的电极反应式为Cu2++2e-=Cu D、若外电路中通过1mol电子,两电极的质量差为64g8. 下列实验中,依据实验操作及现象得出的结论正确的是( )
A、循环物质E为水 B、乙池中Cu电极为阴极,发生还原反应 C、甲池中的电极反应式为Cu2++2e-=Cu D、若外电路中通过1mol电子,两电极的质量差为64g8. 下列实验中,依据实验操作及现象得出的结论正确的是( )选项
操 作
现 象
结 论
A
向 3mL0.1mol/L 的 AgNO3 溶液中先加 入 4—5 滴 0.1mol/L 的 NaCl 溶液,再滴加 4—5 滴 0.1mol/L 的 NaI 溶液
先出现白色沉 淀后出现黄色 沉淀
Ksp(AgCl)>Ksp(AgI)
B
将某气体通入品红溶液
品红溶液褪色
该气体是 SO2
C
用 pH 计测定等浓度的 Na2CO3 和NaClO 溶液的 pH
后者 pH比前者 的小
非金属性:Cl>C
D
将铜粉加入 1.0 mol/L Fe2(SO4)3 溶液中
溶液变蓝
氧化性Fe3+>Cu2+
A、A B、B C、C D、D9. 氮及其化合物的转化过程如图所示。下列分析不合理的是( ) A、催化剂 a 表面发生了非极性共价键的断裂和极性共价键的形成 B、催化剂不能改变反应焓变但可降低反应活化能 C、在催化剂 b 表面形成氮氧键时,涉及电子转移 D、催化剂 a、b 能提高反应的平衡转化率10. 将一定量纯净的氨基甲酸铵置于特制的密闭真空容器中 假设容器体积不变,固体试样体积忽略不计 ,使其达到分解平衡: 。实验测得不同温度下的平衡数据列于下表:
A、催化剂 a 表面发生了非极性共价键的断裂和极性共价键的形成 B、催化剂不能改变反应焓变但可降低反应活化能 C、在催化剂 b 表面形成氮氧键时,涉及电子转移 D、催化剂 a、b 能提高反应的平衡转化率10. 将一定量纯净的氨基甲酸铵置于特制的密闭真空容器中 假设容器体积不变,固体试样体积忽略不计 ,使其达到分解平衡: 。实验测得不同温度下的平衡数据列于下表:温度
平衡气体总浓度
下列有关叙述正确的是( )
A、该可逆反应达到平衡的标志之一是混合气体平均相对分子质量不变 B、因该反应 、 ,所以在低温下自发进行 C、达到平衡后,若在恒温下压缩容器体积,体系中气体的浓度增大 D、根据表中数据,计算 时的分解平衡常数约为11. 扁桃酸衍生物是重要的医药中间体,以物质a为原料合成扁桃酸衍生物b的过程如下:下列说法正确的是( ) A、物质X是Br2 , 物质a转化为b属于取代反应 B、1mol物质a能与3molH2反应,且能在浓硫酸中发生消去反应 C、物质b具有多种能与NaHCO3反应的同分异构体 D、物质b的核磁共振氢谱有四组峰12. 常温下,用0.1 mol·L−1盐酸滴定10.0 mL浓度为0.1 mol·L−1Na2A溶液,所得滴定曲线如图所示。下列说法错误的是( )
A、物质X是Br2 , 物质a转化为b属于取代反应 B、1mol物质a能与3molH2反应,且能在浓硫酸中发生消去反应 C、物质b具有多种能与NaHCO3反应的同分异构体 D、物质b的核磁共振氢谱有四组峰12. 常温下,用0.1 mol·L−1盐酸滴定10.0 mL浓度为0.1 mol·L−1Na2A溶液,所得滴定曲线如图所示。下列说法错误的是( ) A、Ka2(H2A)的数量级为10−9 B、当V=5时:c(A2−)+c(HA−)+c(H2A)=2c(Cl−) C、NaHA溶液中:c(Na+)>c(HA−)>c(A2−)>c(H2A) D、c点溶液中:c(Na+)>c(Cl−)>c(H+)=c(OH−)13. 利用电解法制取 Na2FeO4 的装置图如图所示,下列说法正确的是(电解过程中温度保 持不变,溶液体积变化忽略不计)( )
A、Ka2(H2A)的数量级为10−9 B、当V=5时:c(A2−)+c(HA−)+c(H2A)=2c(Cl−) C、NaHA溶液中:c(Na+)>c(HA−)>c(A2−)>c(H2A) D、c点溶液中:c(Na+)>c(Cl−)>c(H+)=c(OH−)13. 利用电解法制取 Na2FeO4 的装置图如图所示,下列说法正确的是(电解过程中温度保 持不变,溶液体积变化忽略不计)( ) A、Y 是外接电源的正极,Fe 电极上发生还原反应 B、Ni 电极上发生的电极反应为:2H2O - 4e-= O2↑+4H+ C、若隔膜为阴离子交换膜,则电解过程中 OH-由 B 室进入 A 室 D、电解后,撤去隔膜,充分混合,电解液的 pH 比原来小14. 亚硝酸钠(NaNO2)是一种常用的发色剂和防腐剂,某学习小组利用如图装置(夹持装置略去)制取亚硝酸钠,已知:2NO+Na2O2=2NaNO2 , 2NO2+Na2O2=2NaNO3;NO能被酸性高锰酸钾氧化为NO3-。下列说法正确的是( )
A、Y 是外接电源的正极,Fe 电极上发生还原反应 B、Ni 电极上发生的电极反应为:2H2O - 4e-= O2↑+4H+ C、若隔膜为阴离子交换膜,则电解过程中 OH-由 B 室进入 A 室 D、电解后,撤去隔膜,充分混合,电解液的 pH 比原来小14. 亚硝酸钠(NaNO2)是一种常用的发色剂和防腐剂,某学习小组利用如图装置(夹持装置略去)制取亚硝酸钠,已知:2NO+Na2O2=2NaNO2 , 2NO2+Na2O2=2NaNO3;NO能被酸性高锰酸钾氧化为NO3-。下列说法正确的是( )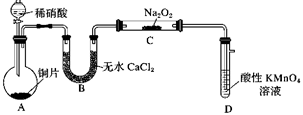 A、可将B中的药品换为浓硫酸 B、实验开始前通一段时间CO2 , 可制得比较纯净的NaNO2 C、开始滴加稀硝酸时,A中会有少量红棕色气体 D、装置D中溶液完全褪色后再停止滴加稀硝酸
A、可将B中的药品换为浓硫酸 B、实验开始前通一段时间CO2 , 可制得比较纯净的NaNO2 C、开始滴加稀硝酸时,A中会有少量红棕色气体 D、装置D中溶液完全褪色后再停止滴加稀硝酸二、实验题
-
15. 二氧化硫(SO2)是一种在空间地理、环境科学、地质勘探等领域受到广泛研究的一种气体。

 (1)、Ⅰ.某研究小组设计了一套制备及检验 SO2 部分性质的装置,如图 1 所示。
(1)、Ⅰ.某研究小组设计了一套制备及检验 SO2 部分性质的装置,如图 1 所示。仪器 A 的名称 , 导管 b 的作用。
(2)、装置乙的作用是为了观察生成 SO2的速率,则装置乙中加入的试剂是。(3)、①实验前有同学提出质疑:该装置没有排空气,而空气中的 O2 氧化性强于 SO2 , 因此 装置丁中即使有浑浊现象也不能说明是 SO2 导致的。请你写出 O2 与 Na2S 溶液反应的化学 反应方程式。②为进一步检验装置丁产生浑浊现象的原因,进行新的实验探究。实验操作及现象见表。
序号
实验操作
实验现象
1
向 10mL 1mol·L-1 的 Na2S 溶液中通 O2
15min 后,溶液才出现浑浊
2
向 10mL 1mol·L-1 的 Na2S 溶液中通 SO2
溶液立即出现黄色浑浊
由实验现象可知:该实验条件下 Na2S 溶液出现浑浊现象是 SO2 导致的。你认为上表实验 1 反应较慢的原因可能是。
(4)、Ⅱ.铁矿石中硫元素的测定可以使用燃烧碘量法,其原理是在高温下将样品中的硫元素转化 为 SO2 , 以 淀 粉 和 碘 化 钾 的 酸 性 混 合 溶 液 为 SO2 吸 收 液 , 在 SO2 吸 收 的 同 时 用 0.0010mol·L-1KIO3 标准溶液进行滴定,检测装置如图 2 所示:[查阅资料] ①实验进行 5min,样品中的 S 元素都可转化为 SO2
②2IO3-+5SO2+4H2O=8H++5SO42-+I2
③I2+SO2+2H2=2I-+SO42-+4H+
④IO3-+5I-+6H+=3I2+3H2O
工业设定的滴定终点现象是。
(5)、实验一:空白试验,不放样品进行实验,5min 后测得消耗标准液体积为 V1mL实验二:加入 1g 样品再进行实验,5min 后测得消耗标准液体积为 V2mL
比较数据发现 V1 远远小于 V2 , 可忽略不计 V1。 测得 V2 的体积如表
序号
1
2
3
KIO3 标准溶液体积/mL
10.02
9.98
10.00
该份铁矿石样品中硫元素的质量百分含量为。
三、综合题
-
16. NOx的排放主要来自于汽车尾气,包含 NO2 和 NO I.(1)、用 CH4 催化还原 NOx 可以消除氮氧化物的污染。例如:
a.CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g) ∆H1= -574kJ/mol
b.CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g) ∆H2= -1160kJ/mol
①这两个反应在热力学上趋势均很大,其原因是:。
②有利于提高 NOx 的平衡转化率的反应条件是:(至少答一条)。
③在相同条件下,CH4(g)+2NO2(g)=N2(g)+2H2O(g)+CO2(g) ∆H2=kJ/mol
(2)、为了提高 CH4 和 NO 转化为 N2 的产率,种学家寻找了一种新型的催化剂。将 CH4 和 NO 按一定比例、一定流速通过装有上述新型催化剂的反应器中,测得 N2 的产率与温度的关系如图1所示,OA 段 N2 产率增大的原因是。 AB 段 N2 产率降低的可能原因是(填标号)A.催化剂活性降低 B.平衡常数变大 C.副反应增多
 (3)、N2 的产率与 ,由图可知 最佳约为
(3)、N2 的产率与 ,由图可知 最佳约为
II.有人利用反应 2C(s)+2NO2(g) N2(g)+2CO2(g) ΔH=-64.2kJ/mol 对 NO2 进行吸附。在 T℃下,向密闭容器中加入足量的 C 和一定量的 NO2 气体,图为不同压强下上述反应经过 相同时间,NO2的转化率随着压强变化的示意图。

用某物质的平衡分压代替其物质的量浓度也可以表示化学平衡常数(记作 Kp);在 T℃、 1100KPa 时,该反应的化学平衡常数 Kp= (计算表达式表示); 已知:气体分压(P 分)=气体总压(P 总)×体积分数。
17. X、Y、Z、W、Q、R 是周期表中前 36 号元素,核电荷数依次增大,其中 X、Y、Z、 W 都是元素周期表中短周期元素。X 为非金属元素,且 X 原子的核外成对电子数是未成对电子数的 2 倍,Z 的次外层电子数是最外层电子数的 ,W 原子的 s 电子与 p 电子数相等,Q 是前四周期中电负性最小的元素,R 的原子序数为 29。 回答下列问题:(1)、X的最高价氧化物对应的水化物分子中,中心原子采取杂化。(2)、化合物 XZ 与 Y 的单质分子互为 , 1mol XZ 中含有π键的数目为。(3)、W 的稳定离子核外有种运动状态的电子。W元素的第一电离能比其同周期 相邻元素的第一电离能高,其原因是:。(4)、Q 的晶体结构如图所示,则在单位晶胞中 Q 原子的个数为 , 晶体的配位数是。 (5)、R元素的基态原子的核外电子排布式为;Y 与 R 形成某 种化合物的晶胞结构如图所示,已知该晶体的密度为ρg·cm-3 , 阿伏加德罗常数的数值为 NA , 则该晶体中 R 原子和 Y 原子之间的最短距离为cm。(只写计算式)
(5)、R元素的基态原子的核外电子排布式为;Y 与 R 形成某 种化合物的晶胞结构如图所示,已知该晶体的密度为ρg·cm-3 , 阿伏加德罗常数的数值为 NA , 则该晶体中 R 原子和 Y 原子之间的最短距离为cm。(只写计算式)
四、工业流程
-
18. 氧化铝陶瓷常用于厚膜集成电路,制备氧化铝陶瓷的工艺流程如图所示,回答下列问题。
 (1)、“氧化”步骤发生的离子方程式为: , 使用双氧水作氧化剂优点为:。(2)、“热分解”得到的产物除了氧化铝外,还有 NH3、N2、SO2、SO3、H2O 生成,则氧化 产物和还原产物的物质的量之比为。(3)、铵明矾晶体的化学式为NH4Al(SO4)2·12H2O,“热分解”步骤中,其各温度段内受热“失重计算值( 失重计算值(%)= )如表所示:
(1)、“氧化”步骤发生的离子方程式为: , 使用双氧水作氧化剂优点为:。(2)、“热分解”得到的产物除了氧化铝外,还有 NH3、N2、SO2、SO3、H2O 生成,则氧化 产物和还原产物的物质的量之比为。(3)、铵明矾晶体的化学式为NH4Al(SO4)2·12H2O,“热分解”步骤中,其各温度段内受热“失重计算值( 失重计算值(%)= )如表所示:温度区间(℃)
18→190
190→430
430→505
505→900
失重计算值(%)
39.20
7.80
13.00
26.00
通过上述数据经粗略计算可判断,在温度区间铵明矾基本上失去了全部结晶水。
(4)、“结晶”步骤中常采用的操作是(5)、该流程中常使用过量的工业硫酸铵,利用硫酸铵水解使溶液显酸性抑制硫酸铝水解, 这样做的目的是:。(6)、通常认为金属离子浓度等于 1×10-5mol/L 即可认为沉淀完全,试计算常温下“中和”步 骤中需要调节溶液 pH=(保留一位小数,已知:Ksp[Fe(OH)3 ]=8.0×10-38 , lg5=0.7)。五、推断题
-
19. 盐酸阿比朵尔,适合治疗由 A、B 型流感病毒引起的上呼吸道感染,2020 年入选新冠肺炎试用药物,其合成路线:

回答下列问题:
(1)、有机物 A 中的官能团名称是和。(2)、反应③的化学方程式。(3)、反应④所需的试剂是。(4)、反应⑤和⑥的反应类型分别是、。(5)、I 是 B 的同分异构体,具有两性并能与碳酸氢钠溶液反应放出气体,写出具有六元 环结构的有机物 H 的结构简式。 (不考虑立体异构,只需写出 3 个)(6)、已知:两分子酯在碱的作用下失去一分子醇生成β—羟基酯的反应称为酯缩合反应,也称为 Claisen (克莱森)缩合反应,如: ,设计由乙醇和
,设计由乙醇和  制备
制备  的合成线路。(无机试剂任选)
的合成线路。(无机试剂任选)
-
-