广东省梅州市2020年高考理综-化学6月二模试卷
试卷更新日期:2020-07-09 类型:高考模拟
一、单选题
-
1. 中华传统文化蕴含着很多科学知识。下列说法错误的是( )。A、“水声冰下咽,沙路雪中平”未涉及化学变化 B、《吕氏春秋·别类编》中“金(即铜)柔锡柔合两柔则刚”体现了合金硬度方面的特性 C、“司南之(勺),投之于地,其柢(柄)指南”。司南中“杓”所用材质为 D、《本草纲目》中“冬月灶中所烧薪柴之灰,令人以灰淋汁,取碱浣衣”里的“碱”是2. 设 为阿伏加德罗常数的值。下列说法正确的是( )。A、 与 的混合物,含离子总数为 B、已知 中铬元素的化合价为 价,则 分子中存在的过氧键数目为 C、 溶液完全反应,转移电子数目一定为 D、常温时, 的盐酸中水电离的 数目为3. 有机化合物F结构简式如图所示,下列说法正确的是( )。
 A、F中的三个苯环可能在同一平面 B、F可与氧气在一定条件下反应生成醛 C、F可发生加成聚合反应和取代反应 D、苯环上的一氯代物有6种4. 下列操作或装置,不能达到实验目的的是( )。
A、F中的三个苯环可能在同一平面 B、F可与氧气在一定条件下反应生成醛 C、F可发生加成聚合反应和取代反应 D、苯环上的一氯代物有6种4. 下列操作或装置,不能达到实验目的的是( )。 A、图Ⅰ用于实验室制氨气并收集干燥的氨气 B、图Ⅱ用于检验浓硫酸与铜反应后的产物中是否含有铜离子 C、图Ⅲ用于验证牺牲阳极的阴极保护法 D、图Ⅳ用于制取 晶体5. 下图是磷酸、亚磷酸、次磷酸的结构式,其中磷酸为三元中强酸,亚磷酸为二元弱酸,则下列说法正确的是( )。
A、图Ⅰ用于实验室制氨气并收集干燥的氨气 B、图Ⅱ用于检验浓硫酸与铜反应后的产物中是否含有铜离子 C、图Ⅲ用于验证牺牲阳极的阴极保护法 D、图Ⅳ用于制取 晶体5. 下图是磷酸、亚磷酸、次磷酸的结构式,其中磷酸为三元中强酸,亚磷酸为二元弱酸,则下列说法正确的是( )。 A、磷酸( )的电离方程式为: B、亚磷酸( )与足量NaOH溶液反应生成 C、 溶液呈酸性,是因为 的水解程度比电离程度大 D、 溶液呈碱性6. 已知电解质溶液电导率越大导电能力越强。常温下用 溶液分别滴定10.00mL浓度均为 的盐酸和醋酸溶液,测得滴定过程中溶液的电导率如图所示。下列说法错误的是( )。
A、磷酸( )的电离方程式为: B、亚磷酸( )与足量NaOH溶液反应生成 C、 溶液呈酸性,是因为 的水解程度比电离程度大 D、 溶液呈碱性6. 已知电解质溶液电导率越大导电能力越强。常温下用 溶液分别滴定10.00mL浓度均为 的盐酸和醋酸溶液,测得滴定过程中溶液的电导率如图所示。下列说法错误的是( )。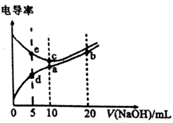 A、c点的混合液pH=7 B、e、d两点溶液混合后的溶液中: C、b点溶液中: D、a、b、c三点溶液中水的电离程度:7. X、Y、Z、M、R为五种短周期元素,其原子半径和最外层电子数之间的关系如图所示,其中M单质为淡黄色固体。下列说法错误的是( )。
A、c点的混合液pH=7 B、e、d两点溶液混合后的溶液中: C、b点溶液中: D、a、b、c三点溶液中水的电离程度:7. X、Y、Z、M、R为五种短周期元素,其原子半径和最外层电子数之间的关系如图所示,其中M单质为淡黄色固体。下列说法错误的是( )。 A、简单离子半径:Z>R B、元素非金属性的顺序:Z>X>Y C、M的氧化物对应的水化物均为强酸 D、Y的单质在加热条件下能与Z的最高价氧化物对应的水化物的浓溶液反应
A、简单离子半径:Z>R B、元素非金属性的顺序:Z>X>Y C、M的氧化物对应的水化物均为强酸 D、Y的单质在加热条件下能与Z的最高价氧化物对应的水化物的浓溶液反应二、工业流程
-
8. 是接触法生产硫酸的催化剂,属于两性氧化物,可从富钒炉渣(主要含有 、 和少量 、 )中提取,其工艺流程如下:

已知:①
②一些金属阳离子沉淀的pH范围:
开始沉淀pH
完全沉淀pH
6.5
9.0
2.2
3.5
4.1
5.4
(1)、“酸浸还原”时 转化为 ,写出有关 反应的离子方程式;经“氧化”后钒以 存在,写出生成 反应的离子方程式。(2)、调节溶液 至2.0~3.5,宜选用的试剂是________(填标号)。A、 B、 C、 D、(3)、“滤渣1”的主要成分是; 粗品中的杂质为。(4)、“沉钒”时需加入稀 ,其目的是。(5)、焙烧产生的气体用吸收后,其产物可以在该工艺中循环利用。(6)、 在一定条件下可转化为不同价态的钒离子( 、 、 、 ),可作为全钒液充电流电池的电极液,电池总反应为 。下图是钒电池基本工作原理示意图:
充电时阳极的反应式为;能够通过钒电池基本工作原理示意图中“隔膜”的离子是。
三、综合题
-
9. 硫酸锰晶体( )是重要的微量元素肥料之一。某兴趣小组在实验室中探究用软锰矿(主要成分为 ,含有少量 、 、 等杂质制取硫酸锰晶体,其具体流程如下:

已知:①反应原理为: ;
② 难溶于水。
(1)、滤渣2主要成分是 ,步骤②中的稀硫酸的作用是。(2)、步骤③中采用 硫酸和草酸晶体溶解 ,草酸晶体的作用是;配制 硫酸时,需要的仪器除量筒、烧杯、玻璃棒外,还需要。将滤渣2置于烧杯中,先加入稀硫酸,将溶液稍加热后,在搅拌下缓慢分批加入草酸晶体,直至烧杯中的固体全部溶解。在搅拌下缓慢分批加入草酸晶体的理由是。(3)、步骤④的具体实验操作有 , 经洗涤后干燥得到 晶体。(4)、兴趣小组同学拟继续研究硫酸锰的高温分解的固体产物,经查资料可知:硫酸锰晶体高温下分解产物为 、 、 ,及水蒸气。为了确定 的化学式,采用下面装置进行测定(已知: 的熔点为16.8℃,沸点为44.8℃)。
① 装置中吸收的气体为。
②实验自始至终均需通入 ,其目的是。
③若起始时,在装置A中加入 ,充分反应后,测得装置C增重6.4g,则 的化学式为。
10. 碳、氮、硫及其化合物对生产、生活有重要的意义。(1)、以 与 为原料可合成尿素。已知:①
②
③
写出NH3和CO2合成尿素和液态水的热化学方程式。
(2)、高温下,CO2与足量的碳在密闭容器中实现反应: 。向容积为1L的恒容容器中加入0.2molCO2 , 在不同温度下达到平衡时CO2的物质的量浓度随温度的变化如图所示。则该反应为(填“放热”或“吸热”)反应;某温度下若向该平衡体系中再通入0.2molCO2 , 达到新平衡后,体系中CO的百分含量(填“变大”、“变小”或“不变”)。 (3)、一定量的 与足量的碳在体积可变的恒压密闭容器中反应: ,平衡时体系中气体体积分数与温度的关系如图所示:
(3)、一定量的 与足量的碳在体积可变的恒压密闭容器中反应: ,平衡时体系中气体体积分数与温度的关系如图所示:
①650℃时,反应达平衡后 的转化率为。
② ℃时,平衡常数 (用平衡分压代替平衡浓度计算,分压 总压 体积分数)。
(4)、 与 能发生反应:在固定体积的密闭容器中,使用某种催化剂,改变原料气配比进行多次实验(各次实验的温度可能相同,也可能不同),测定 的平衡转化率。部分实验结果如图所示:

①当容器内(填标号)不再随时间的变化而改变时,反应达到平衡状态。
A.气体的压强 B.气体的平均摩尔质量 C.气体的密度 D. 的体积分数
②如果要将图中C点的平衡状态改变为B点的平衡状态,应采取的措施是。
③若A点对应实验中, 的起始浓度为 ,经过 达到平衡状态,该时段化学反应速率 。
④图中C、D两点对应的温度分别为 ℃和 ℃,通过计算判断 (填“ ”、“ ”或“ ”)。
11. 2019年诺贝尔化学奖授予约翰·古德伊纳夫、斯坦利·惠廷厄姆和吉野彰三位科学家,以表彰他们在锂电池领域所做出的巨大贡献。 、 常用作锂离子电池的正极材料,请回答下列问题:(1)、基态锂原子的最高能级的电子云形状是;基态磷原子有个未成对电子;基态铁原子核外电子排布式为。(2)、 中 的配位数为4,配体中N的杂化方式为 , 该配离子中各元素的第一电离能由小到大的顺序为(用元素符号表示)。(3)、 在水中易被还原成 ,而在氨水中可稳定存在,其原因为。(4)、 属于简单磷酸盐,而直链的多磷酸盐则是一种复杂磷酸盐,如:焦磷酸钠、三磷酸钠等。焦磷酸根离子、三磷酸根离子如下图所示:
这类磷酸根离子的化学式可用通式表示为(用n代表P原子数)。
(5)、钴蓝晶体结构如下图,该立方晶胞由4个Ⅰ型和4个Ⅱ型小立方体构成。晶体中 占据 形成的(填“四面体空隙”或“八面体空隙”);钴蓝晶体的密度为 (列出计算式,用 表示阿伏加德罗常数的值)。
四、推断题
-
12. 聚碳酸酯是热塑性材料,双酚A型聚碳酸酯的合成路线如下:
 (1)、B的化学名称为 , B中的官能团的名称是。(2)、反应③的反应类型是。(3)、写出D到E的反应方程式。(4)、写出反应⑥中除生成双酚A型聚碳酸酯外的产物的结构简式。(5)、写出满足下列条件的F的同分异构体的结构简式(不考虑立体异构,只需写出2个)。
(1)、B的化学名称为 , B中的官能团的名称是。(2)、反应③的反应类型是。(3)、写出D到E的反应方程式。(4)、写出反应⑥中除生成双酚A型聚碳酸酯外的产物的结构简式。(5)、写出满足下列条件的F的同分异构体的结构简式(不考虑立体异构,只需写出2个)。①能发生银镜反应 ②遇FeCl3溶液显紫色 ③核磁共振氢谱有六组峰
(6)、设计由1-丙醇制备 的合成路线(无机试剂任选)。
的合成路线(无机试剂任选)。
-