安徽省芜湖市示范高中2020年高考理综-化学5月模拟试卷
试卷更新日期:2020-07-09 类型:高考模拟
一、单选题
-
1. 在2020年抗击新冠肺炎的战役中,化学物质发挥了重要作用。下列说法正确的是( )A、医用消毒酒精中乙醇的体积分数为95% B、生产医用防护口罩的原料聚丙烯纤维属于纯净物 C、抗病毒疫苗冷藏存放的目的之一是避免蛋白质变性 D、84消毒液可作为环境消毒剂,其有效成分为次氯酸钙2. 氮化钡(Ba3N2)是一种重要的化学试剂。高温下,向氢化钡(BaH2)中通入氮气反应生成氮化钡。可用如图装置制备氮化钡。已知:Ba3N2遇水反应;BaH2在潮湿空气中能自燃,遇水反应。下列说法错误的是( )
 A、在实验室中可以用装置乙制备氯气 B、实验时,先点燃装置丙中的酒精喷灯,后点燃装置乙中的酒精灯 C、气流从左向右的字母连接顺序为c→b→a→d→e→g→f D、装置甲中的浓硫酸和装置丁中的碱石灰作用相同,均可防止水蒸气进入装置丙中3. 化合物M(
A、在实验室中可以用装置乙制备氯气 B、实验时,先点燃装置丙中的酒精喷灯,后点燃装置乙中的酒精灯 C、气流从左向右的字母连接顺序为c→b→a→d→e→g→f D、装置甲中的浓硫酸和装置丁中的碱石灰作用相同,均可防止水蒸气进入装置丙中3. 化合物M( )、N(
)、N(  )、P(
)、P(  )都是重要的有机物。下列有关M、N、P的说法正确的是( ) A、M与HBr发生加成反应的产物只有一种 B、P中所有碳原子一定共平面 C、M、N、P互为同分异构体 D、M能使酸性高锰酸钾溶液褪色4. 最近,中国科学院大连化物所“CO2催化转化为CO的研究”获得新进展。如图是使用不同催化剂(NiPc和CoPc)时转化过程中的能量变化,下列说法不合理的是( )
)都是重要的有机物。下列有关M、N、P的说法正确的是( ) A、M与HBr发生加成反应的产物只有一种 B、P中所有碳原子一定共平面 C、M、N、P互为同分异构体 D、M能使酸性高锰酸钾溶液褪色4. 最近,中国科学院大连化物所“CO2催化转化为CO的研究”获得新进展。如图是使用不同催化剂(NiPc和CoPc)时转化过程中的能量变化,下列说法不合理的是( ) A、•CO2经还原反应得到•COOH B、该研究成果将有利于缓解温室效应,并解决能源转化问题 C、相同基团的物种分别吸附在NiPc和CoPc表面,其能量可能不同 D、催化剂可以改变CO2转化为CO反应的焓变5. 要“打赢蓝天保卫战”,意味着对污染防治比过去要求更高。某种利用垃圾渗透液实现发电、环保二位一体相结合的装置示意图如图,当该装置工作时,下列说法正确的是( )
A、•CO2经还原反应得到•COOH B、该研究成果将有利于缓解温室效应,并解决能源转化问题 C、相同基团的物种分别吸附在NiPc和CoPc表面,其能量可能不同 D、催化剂可以改变CO2转化为CO反应的焓变5. 要“打赢蓝天保卫战”,意味着对污染防治比过去要求更高。某种利用垃圾渗透液实现发电、环保二位一体相结合的装置示意图如图,当该装置工作时,下列说法正确的是( ) A、盐桥中K+向X极移动 B、电路中流过7.5mol电子时,共产生标准状况下N2的体积为44.8L C、该装置实现了将电能转化为化学能 D、Y极发生的反应为2NO3--10e-+6H2O=N2↑+12OH- , 周围pH增大6. 如图化合物是有机合成中一种常用的还原剂,其中X、Y、Z为原子序数依次增大的短周期主族元素,且X、Y、Z处于不同周期。下列叙述正确的是( )
A、盐桥中K+向X极移动 B、电路中流过7.5mol电子时,共产生标准状况下N2的体积为44.8L C、该装置实现了将电能转化为化学能 D、Y极发生的反应为2NO3--10e-+6H2O=N2↑+12OH- , 周围pH增大6. 如图化合物是有机合成中一种常用的还原剂,其中X、Y、Z为原子序数依次增大的短周期主族元素,且X、Y、Z处于不同周期。下列叙述正确的是( ) A、Y的最高价氧化物对应的水化物属于两性氢氧化物 B、原子半径:Z<Y<X C、Z与X可形成离子化合物ZX D、该化合物中X、Y、Z均满足8电子稳定结构7. 25℃时,体积均为25.00mL,浓度均为0.0100mo1•L-1的HA、H3B溶液分别用0.0100mo1•L-1NaOH溶液滴定,溶液的pH随V(NaOH)变化曲线如图所示,下列说法正确的是( )
A、Y的最高价氧化物对应的水化物属于两性氢氧化物 B、原子半径:Z<Y<X C、Z与X可形成离子化合物ZX D、该化合物中X、Y、Z均满足8电子稳定结构7. 25℃时,体积均为25.00mL,浓度均为0.0100mo1•L-1的HA、H3B溶液分别用0.0100mo1•L-1NaOH溶液滴定,溶液的pH随V(NaOH)变化曲线如图所示,下列说法正确的是( )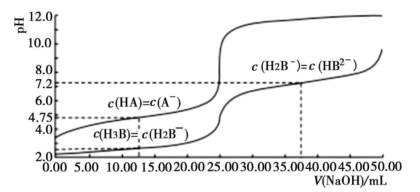 A、25℃时,0.0100mo1•L-1Na2HB溶液的pH>7 B、向HA溶液中滴加NaOH溶液至中性,c(A-)<c(HA) C、NaOH溶液滴定HA溶液应选甲基橙作指示剂 D、25℃时,H2B-离子的水解常数的数量级为10-3
A、25℃时,0.0100mo1•L-1Na2HB溶液的pH>7 B、向HA溶液中滴加NaOH溶液至中性,c(A-)<c(HA) C、NaOH溶液滴定HA溶液应选甲基橙作指示剂 D、25℃时,H2B-离子的水解常数的数量级为10-3二、实验题
-
8. 铋酸钠(NaBiO3)是分析化学中的重要试剂,在水中缓慢分解,遇沸水或酸则迅速分解。某兴趣小组设计实验制取铋酸钠并探究其应用。回答下列问题:(1)、Ⅰ.制取铋酸钠
制取装置如图(加热和夹持仪器已略去),部分物质性质如下:

C中盛放Bi(OH)3与NaOH的混合物,与Cl2反应生成NaBiO3 , 反应的化学方程式为 。B装置的作用是。
(2)、当观察到(填现象)时,可以初步判断C中反应已经完成。(3)、拆除装置前必须先除去残留的Cl2 , 以免污染空气。除去烧瓶A中残留Cl2的操作是:关闭;打开。(4)、反应结束后,为从装置C中获得尽可能多的产品,需要的操作有。(5)、Ⅱ.铋酸钠的应用——检验Mn2+往待检液中加入铋酸钠晶体,加硫酸酸化,生成Bi3+ , 且溶液变为紫红色,证明待检液中存在Mn2+。产生紫红色现象的离子方程式为。
(6)、Ⅲ.产品纯度的测定取上述NaBiO3产品ag,加入足量稀硫酸和MnSO4稀溶液使其完全反应,再用bmo1•L-1的H2C2O4标准溶液滴定生成的MnO4-(已知:H2C2O4+MnO4-—CO2+Mn2++H2O,未配平),当溶液紫红色恰好褪去时,消耗cmL标准溶液。该产品的纯度为(用含a、b、c的代数式表示)。
三、工业流程
-
9. 氧化铬(Cr2O3)的性质独特,在冶金、颜料等领域有着不可替代的地位。一种利用淀粉水热还原铬酸钠制备氧化铬的工艺流程如图:

已知:①向含少量Na2CO3的铬酸钠碱性溶液中通入CO2可制得不同碳化率的铬酸钠碳化母液。
②“还原”反应剧烈放热,可制得Cr(OH)3浆料。
(1)、该工艺中“还原”反应最初使用的是蔗糖或甲醛,后来改用价格低廉的淀粉。请写出甲醛(HCHO)与铬酸钠(Na2CrO4)溶液反应的离子方程式。(2)、将混合均匀的料液加入反应釜,密闭搅拌,恒温发生“还原”反应,下列有关说法错误的是 (填标号)。A、该反应一定无需加热即可进行 B、必要时可使用冷却水进行温度控制 C、铬酸钠可适当过量,使淀粉充分反应 D、应建造废水回收池,回收含铬废水(3)、测得反应完成后在不同恒温温度、不同碳化率下Cr(Ⅵ)还原率如图。实际生产过程中Cr(Ⅵ)还原率可高达99.5%以上,“还原”阶段采用的最佳反应条件为、。 (4)、滤液中所含溶质为。该水热法制备氧化铬工艺的优点有、(写出两条即可)。(5)、由水热法制备的氢氧化铬为无定型氢氧化铬[2Cr(OH)3•H2O]。将洗涤并干燥后的氢氧化铬滤饼充分煅烧,失去质量与固体残留质量比为。
(4)、滤液中所含溶质为。该水热法制备氧化铬工艺的优点有、(写出两条即可)。(5)、由水热法制备的氢氧化铬为无定型氢氧化铬[2Cr(OH)3•H2O]。将洗涤并干燥后的氢氧化铬滤饼充分煅烧,失去质量与固体残留质量比为。四、综合题
-
10. 合成氨技术的创立开辟了人工固氮的重要途径,解决了亿万人口生存问题。
回答下列问题:
(1)、科学家研究利用铁触媒催化合成氨的反应历程如图所示,其中吸附在催化剂表面的物种用“ad”表示。
由图可知合成氨反应N2(g)+3H2(g) 2NH3(g)的∆H=kJ∙mol-1。该历程中速率最快的一步的活化能(E)为 kJ∙mol-1。
(2)、工业合成氨反应为:N2(g)+3H2(g) 2NH3(g),当进料体积比V(N2)∶V(H2)=1∶3时,平衡气体中NH3的物质的量分数随温度和压强变化的关系如图所示:
①500℃时,反应的平衡常数Kp(100MPa) Kp(30MPa)。(填“<”、“=”、“>”)
②500℃、30MPa时,氢气的平衡转化率为(保留3位有效数字),Kp=(MPa)-2(列出计算式)。
[Kp为平衡分压代替平衡浓度计算求得的平衡常数(分压=总压×物质的量分数)]
(3)、科学家利用电解法在常温常压下合成氨,工作时阴极区的微观示意图如图,其中电解液为溶解有三氟甲磺酸锂和乙醇的惰性有机溶剂。
①阴极区生成NH3的电极反应式为。
②下列说法正确的是(填标号)。
A.该装置用金(Au)作催化剂,目的是降低N2的键能
B.三氟甲磺酸锂的作用是增强导电性
C.选择性透过膜可允许N2和NH3通过,防止H2O进入装置
11. Na3OCl是一种良好的离子导体,具有反钙钛矿晶体结构。回答下列问题:
(1)、基态Ti原子4s轨道上的一个电子激发到4p轨道上形成激发态,写出该激发态价层电子排布式。第三电离能:CaTi(填“大于”或“小于”)。(2)、由O、Cl元素可组成不同的单质和化合物,其中Cl2O2能破坏臭氧层。①Cl2O2的沸点比H2O2低,原因是。
②O3分子的中心原子杂化类型为;与O3互为等电子体的是(任意写一种)。
(3)、Na3OCl可由以下方法制得:2Na+2NaOH+2NaCl 2Na3OCl+H2↑,在该反应中,形成的化学键有 (填标号)。A、金属键 B、离子键 C、配位键 D、极性键 E、非极性键(4)、Na3OCl晶体属于立方晶系,其晶胞结构如图所示。已知:晶胞参数为anm,密度为dg•cm3。
①Na3OCl晶胞中,O位于各顶点位置,Cl位于位置。
②用a、d表示阿伏加德罗常数的值NA=(列计算式)。
五、推断题
-
12. 药物瑞德西韦(Remdesivir)对新型冠状病毒(2019-nCoV)有明显抑制作用;K为药物合成的中间体,其合成路线如图(A俗称石炭酸):

已知:①R—OH
 R—Cl
R—Cl②

回答下列问题:
(1)、有机物B的名称为。(2)、I中官能团的名称为。(3)、G到H的反应类型为。(4)、由B生成C的化学反应方程式为。(5)、E中含两个Cl原子,则E的结构简式为。(6)、X是C的同分异构体,写出满足下列条件的X的结构简式。(写出一种即可)①苯环上含有硝基且苯环上只有一种氢原子;②1molX最多消耗2molNaOH。
(7)、设计由苯甲醇为原料制备化合物 的合成路线。(无机试剂任选。合成路线常用的表示方式为:A
的合成路线。(无机试剂任选。合成路线常用的表示方式为:A  B……
B……  目标产物。
目标产物。
-
-