安徽省马鞍山市2020年高考理综-化学二模试卷
试卷更新日期:2020-07-09 类型:高考模拟
一、单选题
-
1. 下列有关氯元素及其化合物的表示正确的是( )A、质子数为17、中子数为20的氯原子: B、氯离子(Cl-)的结构示意图:
 C、氯分子的电子式:
C、氯分子的电子式:  D、氯乙烯分子的结构简式:H3C-CH2Cl
2. 称取(NH4)2SO4和NH4HSO4混合物样品7.24 g,加入含0.1 mol NaOH的溶液,完全反应,生成NH31792 mL(标准状况),则(NH4)2SO4和NH4HSO4的物质的量比为( )A、1:1 B、1:2 C、1.87:1 D、3.65:13. 制备(NH4)2Fe(SO4)2·6H2O的实验中,需对过滤出产品的母液(pH<1)进行处理。室温下,分别取母液并向其中加入指定物质,反应后的溶液中主要存在的一组离子正确的是( )A、通入过量Cl2:Fe2+、H+、NH4+、Cl–、SO42– B、加入少量NaClO溶液:NH4+、Fe2+、H+、SO42–、ClO– C、加入过量NaOH溶液:Na+、Fe2+、NH4+、SO42–、OH– D、加入过量NaClO和NaOH的混合溶液:Na+、SO42–、Cl–、ClO–、OH–4. O2F2可以发生反应:H2S+4O2F2→SF6+2HF+4O2 , 下列说法正确的是( )A、氧气是氧化产物 B、O2F2既是氧化剂又是还原剂 C、若生成4.48LHF,则转移0.8mol电子 D、还原剂与氧化剂的物质的量之比为1:45. 为落实“五水共治”,某工厂拟综合处理含NH4+废水和工业废气(主要含N2、CO2、SO2、NO、CO,不考虑其他成分),设计了如下流程:
D、氯乙烯分子的结构简式:H3C-CH2Cl
2. 称取(NH4)2SO4和NH4HSO4混合物样品7.24 g,加入含0.1 mol NaOH的溶液,完全反应,生成NH31792 mL(标准状况),则(NH4)2SO4和NH4HSO4的物质的量比为( )A、1:1 B、1:2 C、1.87:1 D、3.65:13. 制备(NH4)2Fe(SO4)2·6H2O的实验中,需对过滤出产品的母液(pH<1)进行处理。室温下,分别取母液并向其中加入指定物质,反应后的溶液中主要存在的一组离子正确的是( )A、通入过量Cl2:Fe2+、H+、NH4+、Cl–、SO42– B、加入少量NaClO溶液:NH4+、Fe2+、H+、SO42–、ClO– C、加入过量NaOH溶液:Na+、Fe2+、NH4+、SO42–、OH– D、加入过量NaClO和NaOH的混合溶液:Na+、SO42–、Cl–、ClO–、OH–4. O2F2可以发生反应:H2S+4O2F2→SF6+2HF+4O2 , 下列说法正确的是( )A、氧气是氧化产物 B、O2F2既是氧化剂又是还原剂 C、若生成4.48LHF,则转移0.8mol电子 D、还原剂与氧化剂的物质的量之比为1:45. 为落实“五水共治”,某工厂拟综合处理含NH4+废水和工业废气(主要含N2、CO2、SO2、NO、CO,不考虑其他成分),设计了如下流程:下列说法错误的是( )
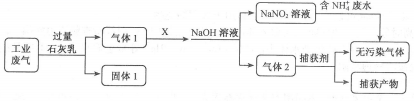 A、固体1中主要含有Ca(OH)2、CaCO3、CaSO3 B、X可以是空气,且需过量 C、捕获剂所捕获的气体主要是CO D、处理含NH4+废水时,发生反应的离子方程式为:NH4++NO2-=N2↑+2H2O6. 根据元素周期表和元素周期律,判断下列叙述错误的是( )A、气态氢化物的稳定性:H2O>NH3>SiH4 B、氢元素与其他元素可形成共价化合物或离子化合物 C、如图所示实验可证明元素的非金属性:Cl>C>Si
A、固体1中主要含有Ca(OH)2、CaCO3、CaSO3 B、X可以是空气,且需过量 C、捕获剂所捕获的气体主要是CO D、处理含NH4+废水时,发生反应的离子方程式为:NH4++NO2-=N2↑+2H2O6. 根据元素周期表和元素周期律,判断下列叙述错误的是( )A、气态氢化物的稳定性:H2O>NH3>SiH4 B、氢元素与其他元素可形成共价化合物或离子化合物 C、如图所示实验可证明元素的非金属性:Cl>C>Si D、用中文“
D、用中文“  ”(ào)命名的第118号元素在周期表中位于第七周期0族
7. 一定条件下,某容器中各微粒在反应前后变化的示意图如下,其中 和 代表不同元素的原子。
”(ào)命名的第118号元素在周期表中位于第七周期0族
7. 一定条件下,某容器中各微粒在反应前后变化的示意图如下,其中 和 代表不同元素的原子。

关于此反应说法错误的是( )
A、一定属于吸热反应 B、一定属于可逆反应 C、一定属于氧化还原反应 D、一定属于分解反应二、工业流程
-
8. 高锰酸钾( )是一种常用氧化剂,主要用于化工、防腐及制药工业等。以软锰矿(主要成分为MnO2)为原料生产高锰酸钾的工艺路线如下:

回答下列问题:
(1)、原料软锰矿与氢氧化钾按1∶1的比例在“烘炒锅”中混配,混配前应将软锰矿粉碎,其作用是。(2)、“平炉”中发生的化学方程式为。(3)、“平炉”中需要加压,其目的是。(4)、将K2MnO4转化为KMnO4的生产有两种工艺。①“ 歧化法”是传统工艺,即在K2MnO4溶液中通入CO2气体,使体系呈中性或弱碱性,K2MnO4发生歧化反应,反应中生成K2MnO4 , MnO2和(写化学式)。
②“电解法”为现代工艺,即电解K2MnO4水溶液,电解槽中阳极发生的电极反应为 , 阴极逸出的气体是。
③“电解法”和“ 歧化法”中,K2MnO4的理论利用率之比为。
(5)、高锰酸钾纯度的测定:称取1.0800 g样品,溶解后定容于100 mL容量瓶中,摇匀。取浓度为0.2000 mol·L−1的H2C2O4标准溶液20.00 mL,加入稀硫酸酸化,用KMnO4溶液平行滴定三次,平均消耗的体积为24.48 mL,该样品的纯度为(列出计算式即可,已知2MnO4-+5H2C2O4+6H+=2Mn2++10CO2↑+8H2O)。
三、实验题
-
9. 过氧化钙微溶于水,溶于酸,可作分析试剂、医用防腐剂、消毒剂。以下是一种制备过氧化钙的实验方法。回答下列问题:(1)、(一)碳酸钙的制备

步骤①加入氨水的目的是。小火煮沸的作用是使沉淀颗粒长大,有利于。
(2)、下图是某学生的过滤操作示意图,其操作不规范的是(填标号)。
a. 漏斗末端颈尖未紧靠烧杯壁
b.玻璃棒用作引流
c.将滤纸湿润,使其紧贴漏斗壁
d.滤纸边缘高出漏斗
e.用玻璃棒在漏斗中轻轻搅动以加快过滤速度
(3)、(二)过氧化钙的制备CaCO 滤液 白色晶体
步骤②的具体操作为逐滴加入稀盐酸,至溶液中尚存有少量固体,此时溶液呈性(填“酸”、“碱”或“中”。将溶液煮沸,趁热过滤。将溶液煮沸的作用是。
(4)、步骤③中反应的化学方程式为 , 该反应需要在冰浴下进行,原因是。(5)、将过滤得到的白色结晶依次使用蒸馏水、乙醇洗涤,使用乙醇洗涤的目的是。(6)、制备过氧化钙的另一种方法是:将石灰石煅烧后,直接加入双氧水反应,过滤后可得到过氧化钙产品。该工艺方法的优点是 , 产品的缺点是。四、综合题
-
10. 丁烯是一种重要的化工原料,可由丁烷催化脱氢制备。回答下列问题:(1)、正丁烷(C4H10)脱氢制1-丁烯(C4H8)的热化学方程式如下:
①C4H10(g)= C4H8(g)+H2(g) ΔH1
已知:②C4H10(g)+ O2(g)= C4H8(g)+H2O(g) ΔH2=-119 kJ·mol-1
③H2(g)+ O2(g)= H2O(g) ΔH3=-242 kJ·mol-1
反应①的ΔH1为 kJ·mol-1。图(a)是反应①平衡转化率与反应温度及压强的关系图,x0.1(填“大于”或“小于”);欲使丁烯的平衡产率提高,应采取的措施是(填标号)。

A.升高温度 B.降低温度 C.增大压强 D.降低压强
(2)、丁烷和氢气的混合气体以一定流速通过填充有催化剂的反应器(氢气的作用是活化催化剂),出口气中含有丁烯、丁烷、氢气等。图(b)为丁烯产率与进料气中n(氢气)/n(丁烷)的关系。图中曲线呈现先升高后降低的变化趋势,其降低的原因是。(3)、图(c)为反应产率和反应温度的关系曲线,副产物主要是高温裂解生成的短碳链烃类化合物。丁烯产率在590 ℃之前随温度升高而增大的原因可能是、;590℃之后,丁烯产率快速降低的主要原因可能是。五、填空题
-
11. [化学——选修3:物质结构与性质]
碳及其化合物广泛存在于自然界中,回答下列问题:
(1)、处于一定空间运动状态的电子在原子核外出现的概率密度分布可用 形象化描述。在基态原子中,核外存在 对自旋相反的电子。(2)、碳在形成化合物时,其键型以共价键为主,原因是 。(3)、CS2分子中,共价键的类型有 ,C原子的杂化轨道类型是 ,写出两个与CS2具有相同空间构型和键合形式的分子或离子 。(4)、CO能与金属Fe形成Fe(CO)5 , 该化合物的熔点为253K,沸点为376K,其固体属于 晶体。(5)、碳有多种同素异形体,其中石墨烯与金刚石的晶体结构如图所示:
①在石墨烯晶体中,每个C原子连接 个六元环,每个六元环占有 个C原子。
②在金刚石晶体中,C原子所连接的最小环也为六元环,每个C原子连接 个六元环,六元环中最多有 个C原子在同一平面。
12. 化合物X是一种香料,可采用乙烯与甲苯为主要原料,按下列路线合成: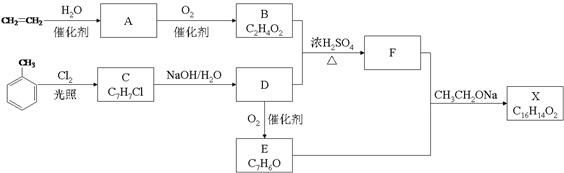
已知:RX ROH;RCHO+CH3COOR’ RCH=CHCOOR’
请回答:
(1)、E中官能团的名称是。(2)、B+D→F的化学方程式。(3)、X的结构简式。(4)、对于化合物X,下列说法正确的是________。A、能发生水解反应 B、不与浓硝酸发生取代反应 C、能使Br2/CCl4溶液褪色 D、能发生银镜反应(5)、下列化合物中属于F的同分异构体的是。
-
-
-