四川省南充市一中2020年中考化学一模试卷
试卷更新日期:2020-07-01 类型:中考模拟
一、单选题
-
1. 下列物质的用途中,利用其物理性质的是( )A、干冰用作冷冻剂 B、氮气用作保护气 C、氧气用于气焊 D、生石灰用作干燥剂2. 下列仪器,既能做反应容器又能直接加热的是( )A、烧杯 B、集气瓶 C、锥形瓶 D、试管3. 下列关于实验现象的描述,正确的是( )A、硫在氧气中燃烧时,发出微弱的淡蓝色火焰 B、红磷在空气中燃烧时,产生大量白雾 C、化肥硫酸铵与熟石灰固体混合研磨,有刺激性气味的气体产生 D、打开盛有浓盐酸的试剂瓶的瓶盖,观察到瓶口处有白烟产生4. 已知: ,如图表示一定质量的 和 固体混合物受热过程中,某变量 随时间的变化趋势,纵坐标表示的是( )
 A、固体中氯酸钾的质量 B、生成 的质量 C、固体中 的质量 D、固体中氧元素的质量5. 推理是一种重要的思维方法,以下推理合理的是( )
A、固体中氯酸钾的质量 B、生成 的质量 C、固体中 的质量 D、固体中氧元素的质量5. 推理是一种重要的思维方法,以下推理合理的是( )选项
事实
推理
A
溶液是均一稳定的物质
均一稳定的物质一定是溶液
B
常温下,测定某溶液的pH=9
该溶液一定呈碱性
C
红磷能在氧气中燃烧
燃烧一定需要氧气
D
分子是由原子构成的
同种原子只能构成一种分子
A、A B、B C、C D、D6. 建立模型是学习化学的一种方法,下列模型正确的是( )A、原子结构 B、物质分类
B、物质分类  C、地壳中元素含量
C、地壳中元素含量  D、空气组成
D、空气组成  7. 生物体中含有多种氨基酸,下列有关甘氨酸的叙述正确的是( )
7. 生物体中含有多种氨基酸,下列有关甘氨酸的叙述正确的是( ) A、甘氨酸中氢元素的含量最高 B、一个甘氨酸分子中含有10个原子 C、甘氨酸是由碳、氢、氧、氮四种原子构成的 D、甘氨酸中碳元素与氧元素的质量比为1:18. 把40gCO和CO2的混合气体,通过足量灼热的氧化铜,充分反应后气体的质量为44g,则原混合气体中碳元素的质量分数为( )A、30% B、42.9% C、72.7% D、90.1%9. 下列实验方案中,设计合理的是()A、分离木炭粉和氧化铜粉末:在空气中充分灼烧 B、除去氨气中的水蒸气:通过盛有浓硫酸的洗气瓶 C、检验氢氧化钠溶液是否变质:取样,滴加酚酞溶液 D、鉴别双氧水和水:取样,加入少量二氧化锰10. 有化合价升降的反应是氧化还原反应.下列一定不是氧化还原反应的是( )A、化合反应 B、分解反应 C、置换反应 D、复分解反应11. 下列曲线表达错误的是( )A、
A、甘氨酸中氢元素的含量最高 B、一个甘氨酸分子中含有10个原子 C、甘氨酸是由碳、氢、氧、氮四种原子构成的 D、甘氨酸中碳元素与氧元素的质量比为1:18. 把40gCO和CO2的混合气体,通过足量灼热的氧化铜,充分反应后气体的质量为44g,则原混合气体中碳元素的质量分数为( )A、30% B、42.9% C、72.7% D、90.1%9. 下列实验方案中,设计合理的是()A、分离木炭粉和氧化铜粉末:在空气中充分灼烧 B、除去氨气中的水蒸气:通过盛有浓硫酸的洗气瓶 C、检验氢氧化钠溶液是否变质:取样,滴加酚酞溶液 D、鉴别双氧水和水:取样,加入少量二氧化锰10. 有化合价升降的反应是氧化还原反应.下列一定不是氧化还原反应的是( )A、化合反应 B、分解反应 C、置换反应 D、复分解反应11. 下列曲线表达错误的是( )A、 KClO3与MnO2制氧气
B、
KClO3与MnO2制氧气
B、 向两份完全相同的稀盐酸中分别加入足量锌粉、镁粉
C、
向两份完全相同的稀盐酸中分别加入足量锌粉、镁粉
C、 硫在氧气中完全燃烧
D、
硫在氧气中完全燃烧
D、 一定量的铜与过量的O2共热
12. 将下列各组中的物质放入烧杯中,加入适量水搅拌,待充分反应后过滤,在滤纸上留下两种金属的是( )A、Zn、NaCl、CuCl2(过量) B、Fe(过量)、Cu(NO3)2、AgNO3 C、Fe(过量)、KNO3、CuSO4 D、Cu (过量)、FeCl2、HCl13. 甲、乙两种固体的溶解度曲线如图所示,相关分析正确的是( )
一定量的铜与过量的O2共热
12. 将下列各组中的物质放入烧杯中,加入适量水搅拌,待充分反应后过滤,在滤纸上留下两种金属的是( )A、Zn、NaCl、CuCl2(过量) B、Fe(过量)、Cu(NO3)2、AgNO3 C、Fe(过量)、KNO3、CuSO4 D、Cu (过量)、FeCl2、HCl13. 甲、乙两种固体的溶解度曲线如图所示,相关分析正确的是( ) A、M点所表示的乙溶液,溶质质量分数是 B、t2℃ 时,甲、乙饱和溶液降低温度,甲先析出晶体 C、t3℃时等质量的甲、乙饱和溶液降温至 t1℃ ,所得溶液中溶质质量相等 D、t1℃时等质量的甲、乙饱和溶液升温至t3℃,所得溶液中溶质质量相等14. 下列变化,能通过加盐酸一步反应实现的是( )
A、M点所表示的乙溶液,溶质质量分数是 B、t2℃ 时,甲、乙饱和溶液降低温度,甲先析出晶体 C、t3℃时等质量的甲、乙饱和溶液降温至 t1℃ ,所得溶液中溶质质量相等 D、t1℃时等质量的甲、乙饱和溶液升温至t3℃,所得溶液中溶质质量相等14. 下列变化,能通过加盐酸一步反应实现的是( )① ② ③ ④
A、①② B、②④ C、①④ D、③15. 向一定质量的Na2CO3、Na2SO4混合溶液中先后滴加BaCl2、HCl溶液,反应过程中加入溶液的质量与产生沉淀或气体的质量关系如图所示,下列说法正确的是( ) A、0﹣a段发生了一个反应 B、c点沉淀的成分为一种 C、取d点对应的溶液,滴加硝酸银溶液,有白色沉淀,说明加入的盐酸已过量 D、m=2.33
A、0﹣a段发生了一个反应 B、c点沉淀的成分为一种 C、取d点对应的溶液,滴加硝酸银溶液,有白色沉淀,说明加入的盐酸已过量 D、m=2.33二、填空题
-
16. 矿物质水中元素及其国标含量如表所示.请回答下列问题:
矿物质水中主要成分
偏硅酸
硫酸根
氯离子
钙
钠
钾
镁
(1)、矿物质水中含有种非金属元素;(2)、久置的水中会溶有一定量的氧气.请写出两个氧分子的符号:;(3)、写出表中的一种阴离子符号:;(4)、偏硅酸 中硅元素的化合价为价.17. 2017年,扬州电缆助力我国货运飞船“天舟一号”顺利升空。(1)、电缆内一般是铜芯,外面包有聚乙烯绝缘层。铜属于 , (选填序号,下同)聚乙烯属于。a.金属材料 b.合成材料 c.复合材料
(2)、纯铜制作铜芯电缆,主要是因为。(选填序号)a.密度大 b.色彩鲜艳 c.导电能力强
18. 物质丙是重要的化工产品,在国民经济中占有重要地位。工业上用甲和乙合成丙。甲、乙、丙的微观示意图见下表。物质
甲
乙
丙

——氢原子

——氮原子
微观示意图


 (1)、甲、乙、丙三种物质都是由(填“分子”、“原子”或“离子”)构成的。(2)、甲、乙、丙中属于化合物的是(填序号) 。(3)、已知物质丙中氢元素的化合价为+1,则另一种元素的化合价为。(4)、甲和乙合成丙的反应中,甲、乙、丙的微粒个数比为。(5)、现有10g的甲和60g的乙混合反应制取丙,反应一段时间后,经测定剩余甲的质量为4g,则剩余乙的质量为g19. 某样品仅含 和 ,为探究样品中 的质量分数,某研究性小组取了19g样品,加入138.8g水使其完全溶解后,再将120g一定溶质质量分数的NaOH溶液不断加入到该溶液中,充分反应后,测得相关数据如表:
(1)、甲、乙、丙三种物质都是由(填“分子”、“原子”或“离子”)构成的。(2)、甲、乙、丙中属于化合物的是(填序号) 。(3)、已知物质丙中氢元素的化合价为+1,则另一种元素的化合价为。(4)、甲和乙合成丙的反应中,甲、乙、丙的微粒个数比为。(5)、现有10g的甲和60g的乙混合反应制取丙,反应一段时间后,经测定剩余甲的质量为4g,则剩余乙的质量为g19. 某样品仅含 和 ,为探究样品中 的质量分数,某研究性小组取了19g样品,加入138.8g水使其完全溶解后,再将120g一定溶质质量分数的NaOH溶液不断加入到该溶液中,充分反应后,测得相关数据如表:实验次数
1
2
3
4
加入NaOH溶液质量/g
30
30
30
30
共生成沉淀的质量/g
2.9
5.8
m
5.8
求:
(1)、表中m的值为。(填字母)a.大于5.8
b.小于5.8
c.等于5.8
d.大于或等于5.8
(2)、样品中 的质量。(写出计算过程)三、实验题
-
20. 水是生命的源泉,也是不可缺少的资源。
 (1)、能确认水是由氧元素和氢元素组成的实验是()(填字母序号)。
(1)、能确认水是由氧元素和氢元素组成的实验是()(填字母序号)。a.氢气在氧气中燃烧生成水
b.水的蒸发
c.水的电解
d.水的净化
(2)、分析图①中水的蒸发的过程中,下列说法正确的是()(填字母序号);a.水分子不断运动
b.水分子之间间隔不变
c.水的化学性质保持不变
d.水的物理性质保持不变
(3)、如图是过滤的操作,规范的操作是()(填字母序号)。
a.用玻璃棒引流
b.滤纸边缘高出漏斗
c.漏斗下端紧靠烧杯内壁
d.将滤纸湿润,使其紧贴漏斗内壁
e.用玻璃棒在漏斗中轻轻搅动以加快过滤速度
四、科普阅读题
-
21. 阅读下面科普短文。
鸡蛋营养价值很高,一个重约50 g的鸡蛋,约含7 g蛋白质。蛋黄中富含卵磷脂,卵磷脂可以阻止胆固醇和脂肪在血管壁上沉积,被称为“血管清道夫”。一般人群每天吃1~2个鸡蛋不会造成血管硬化,但多吃会增加肝、肾负担。
鸡蛋不宜生食,也不建议吃溏心鸡蛋。因为生鸡蛋中含有抗营养因素,会影响营养素的利用,还可能被沙门氏菌污染。烹调鸡蛋达到70~80℃才能杀灭沙门氏菌,当蛋黄凝固时说明温度已接近。所以最好是蛋黄刚凝固时起锅,烹调时间过长会降低鸡蛋的营养价值。
市售鸡蛋常采用三种涂膜保鲜技术,分别是:A-聚乙烯醇溶液涂膜、B-聚乙烯醇和双乙酸钠溶液涂膜、C-聚乙烯醇和氢氧化钙溶液涂膜。三种涂膜剂涂抹于鸡蛋表面后,在温度为20℃、相对湿度为70%的贮藏柜中贮藏30天,测得哈夫单位和蛋黄指数的变化趋势如下图所示,其中CK是对照组,哈夫单位和蛋黄指数的数值越小,鸡蛋越不新鲜。

鸡蛋买回家后,在-1℃、相对湿度80%的条件下储存,最长可以保鲜6个月。
依据文章内容回答下列问题:
(1)、每100 g鸡蛋,约含蛋白质g。(2)、C-聚乙烯醇和氢氧化钙溶液涂膜保鲜鸡蛋的过程中,发生反应的化学方程式为。(3)、三种涂膜保鲜技术中,保鲜效果最好的是。(4)、在进行涂膜保鲜效果的研究中使用了方法。(5)、下列说法正确的是。①鸡蛋营养价值高,每天可以多吃
②鸡蛋煮的时间越长越好,有利于杀灭细菌
③生吃鸡蛋、吃溏心蛋和不吃蛋黄,是不科学的做法
五、科学探究题
-
22. 研究金属的腐蚀对资源的利用和保护意义重大.
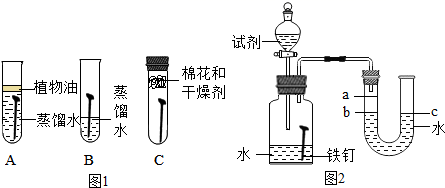 (1)、为了探究铁锈蚀的条件,进行如图 所示实验.经过一周后观察,试管A和C中的铁钉无明显变化,试管B中的铁钉明显锈蚀.通过实验发现:铁锈蚀是铁与发生化学反应的过程.(2)、家中的刀具若沾有食盐水锈蚀更快.为了进一步探究影响铁锈蚀速率的因素,做了如下的实验.
(1)、为了探究铁锈蚀的条件,进行如图 所示实验.经过一周后观察,试管A和C中的铁钉无明显变化,试管B中的铁钉明显锈蚀.通过实验发现:铁锈蚀是铁与发生化学反应的过程.(2)、家中的刀具若沾有食盐水锈蚀更快.为了进一步探究影响铁锈蚀速率的因素,做了如下的实验.(提出问题)铁锈蚀速率与哪些因素有关.
(查阅资料)①物质溶解在水中得到的混合物称为水溶液,如氯化钠溶解在水中得到氯化钠溶液,乙醇溶解在水中得到乙醇溶液.
②氯化钠溶液能导电;乙醇溶液不能导电.
(猜想)铁的锈蚀速率与下列因素有关:
①反应时的温度;②氧气的含量;③水溶液的导电性.
(实验)每次取两套如图 所示的装置,编号为 、 向两套装置中分别装入质量、大小相同的铁钉和等体积的蒸馏水,进行如下三组对比实验(实验开始时,各瓶内气体压强保持一致).
影响因素
实验设计
实验现象
实验结论及解释
①温度
装置 放入 恒温环境中,装置 放入 恒温环境中.
两套装置中铁钉均锈蚀,且U型管中液面均由b处上升至a处,则所需时间 .
锈蚀的速率 ;铁的锈蚀速率与反应时的温度有关, .
②氧气含量
.
.
铁的锈蚀速率与氧气的含量有关,氧气的含量越多,铁的锈蚀越快.
③水溶液的导电性
在相同温度下,装置 集气瓶中加入 氯化钠溶液;装置 集气瓶中加入 乙醇.
两套装置中铁钉均锈;且U型管中液面均由b处上升至a处,则所需时间 .
.
(3)、若将两根铁钉分别放入两支试管中,在一支试管中加入稀硫酸,另一支试管中加入稀盐酸,观察到两支试管内均有大量气泡产生,铁钉逐渐溶解,在酸溶液中被快速腐蚀.(反思与提高)
根据该探究实验以及你所学的知识,判断下列说法正确的是(填序号).
a.金属的腐蚀是指金属单质与其它物质发生化学反应的过程
b.金属越活泼,就越容易被锈蚀
c.金属腐蚀不一定要有氧气参加.
23. 某校化学兴趣小组的同学学习了酸、碱、盐的知识后,对课本中“酸、碱、盐之间并不是都能发生复分解反应”这句话产生了兴趣,展开了探究性学习。(提出问题)发生复分解反应应具备哪些条件?
(1)、(活动探究)该小组同学进行以下四组实验,发现均能反应,写出④的化学方程式:。①硝酸钡溶液与稀硫酸
②稀硫酸与碳酸钾溶液
③稀盐酸与氢氧化钠溶液
④硝酸钡溶液与碳酸钾
(2)、(理论分析)上述反应为什么能够发生?是因为在这些反应物的溶液中有特殊的阴、阳离子,它们两两结合生成了沉淀或气体或水。如:①中有 ;
②中有 ;
③中有 ;
④中有两种离子,所以才发生化学反应。
(3)、(得出结论)经过分析,该小组同学得出以下结论:生成物中是否有沉淀或气体或 , 是判断酸、碱、盐之间能否发生复分解反应的主要条件。(4)、(形成网络)按照一定的顺序排列某些离子,就可以形成一种知识网络。在网络中,用“-”相连接的阴、阳离子间能两两结合生成沉淀或气体或水。现有 、 两种离子,请将它们填入下面合适的“ ”内,使其形成一个更为完整的复分解反应的知识网络。
”内,使其形成一个更为完整的复分解反应的知识网络。 
-
-