上海市长宁区2020年高考化学二模试卷
试卷更新日期:2020-06-23 类型:高考模拟
一、单选题
-
1. 从原理角度来看,下列过程属于物理变化的是( )A、干馏 B、分馏 C、裂化 D、裂解2. 镆(Mc)是一种人工合成的元素,同位素 Mc的原子核内的中子数是( )A、115 B、144 C、173 D、2883. 对储氢材料CaH2描述错误的是( )A、离子半径:H->Li+ B、H-有强还原性 C、Ca2+最外层电子排布式:3s23p6 D、CaH2晶体中既有离子键又有共价键4. 下列属于强电解质的是( )A、硫酸钡 B、食盐水 C、二氧化硅 D、醋酸5. 常温下,铝条与下列溶液不能持续反应的是( )A、氢氧化钠溶液 B、浓硫酸 C、稀硫酸 D、硫酸铜溶液6. 下列关于矿物油(汽油、煤油、柴油等)的判断正确的是( )A、都是烃的衍生物 B、都有固定沸点 C、都易溶于水 D、都不能与氢氧化钠溶液反应7. 下列关于钠的叙述正确的是( )A、钠为银白色固体,熔点很高 B、钠在空气中燃烧,生成淡黄色的过氧化钠 C、钠可保存在酒精中 D、钠与CuSO4溶液反应,可置换出单质铜8. 把铁片分别放入下列物质的溶液中,充分反应后,溶液质量比反应前减轻的是( )A、CuSO4 B、Fe2(SO4)3 C、HCl D、FeSO49. 一定量 固体加水溶解后,以石墨为电极电解该溶液。上述变化过程中会放出热量的是A、 向水中扩散 B、 形成水合离子 C、 发生水解 D、电解产生Cu和10. 下列实验事实可以用共价键键能解释的是( )A、氯化氢的沸点低于溴化氢 B、金刚石熔点高于晶体硅 C、氦气的化学性质稳定 D、甲烷是正四面体型分子11. 下列关于实验室制备乙酸乙酯和乙酸丁酯的描述正确的是( )A、均采用水浴加热 B、制备乙酸丁酯时正丁醇过量 C、均采用边反应边蒸馏的方法 D、制备乙酸乙酯时乙醇过量12. 下列性质的比较,不能用元素周期律解释的是( )A、原子半径:S>Cl B、热稳定性:Na2CO3>NaHCO3 C、还原性:I﹣>Br﹣ D、酸性:H2SO4>H3PO413. 在溶液中加入过量Na2O2后仍能大量共存的是( )A、NH4+、Ba2+、Cl-、NO3- B、K+、CO32-、AlO2-、SO42- C、Fe2+、Mg2+、SCN-、Cl- D、Na+、HCO3-、SO32-、I-14. 只用水就能鉴别的一组物质是( )A、苯、乙酸、四氯化碳 B、乙醇、乙醛、乙酸 C、乙醛、乙二醇、硝基苯 D、己烷、乙醇、甘油15. 将铁粉和活性炭的混合物用NaCl溶液湿润后,置于如图所示装置中,进行铁的电化学腐蚀实验。下列有关该实验的说法正确的是( )
 A、铁被氧化的电极反应式为Fe−3e−=Fe3+ B、铁腐蚀过程中化学能全部转化为电能 C、活性炭的存在会加速铁的腐蚀 D、以水代替NaCl溶液,铁不能发生吸氧腐蚀16. 取1 mL 0.1 mol·L-1 AgNO3溶液进行如下实验(实验中所用试剂浓度均为0.1 mol·L-1):
A、铁被氧化的电极反应式为Fe−3e−=Fe3+ B、铁腐蚀过程中化学能全部转化为电能 C、活性炭的存在会加速铁的腐蚀 D、以水代替NaCl溶液,铁不能发生吸氧腐蚀16. 取1 mL 0.1 mol·L-1 AgNO3溶液进行如下实验(实验中所用试剂浓度均为0.1 mol·L-1):
下列说法错误的是( )
A、实验①白色沉淀是难溶的AgCl B、由实验②说明AgI比AgCl更难溶 C、若按①③顺序实验,看不到黑色沉淀 D、若按②①顺序实验,看不到白色沉淀17. 常温下,在醋酸溶液中加入一定量的醋酸钠固体,下列说法错误的是( )A、c(OH-)减小 B、醋酸的电离程度减小 C、溶液的pH增大 D、c(Ac-)增大18. 下列关于物质或离子检验的叙述正确的是( )A、在溶液中加KSCN,溶液显红色,证明原溶液中有Fe3+ , 无Fe2+ B、气体通过无水硫酸铜,粉末变蓝,证明原气体中含有水蒸气 C、灼烧白色粉末,火焰成黄色,证明原粉末中有Na+ , 无K+ D、将气体通入澄清石灰水,溶液变浑浊,证明原气体是CO219. 向含有FeBr2溶液中通入一定量的Cl2(还原性:Fe2+>Br-),表示该反应的离子方程式肯定错误的是( )A、2Fe2++Cl2=2Fe3++2Cl- B、10Fe2++2Br-+6Cl2=10Fe3++Br2+12Cl- C、2Br-+Cl2=Br2+2Cl- D、2Fe2++4Br-+3Cl2=2Br2+2Fe3++6Cl-20. 测定CuSO4·xH2O晶体的x值,有关质量数据如表中所示,已知x的理论值为5.0,产生误差的可能原因是( ) A、晶体中含不挥发杂质 B、加热时蓝色未完全变白 C、没有放在干燥器中冷却 D、加热时有晶体溅出
A、晶体中含不挥发杂质 B、加热时蓝色未完全变白 C、没有放在干燥器中冷却 D、加热时有晶体溅出二、综合题
-
21. 硒是动物和人体所必需的微量元素之一,在周期表中信息如图所示。完成下列填空:
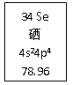 (1)、Se元素在周期表中的位置为。表中78.96的意义为。Se原子最外层电子排布的轨道表示式为。(2)、从原子结构角度解释硫的非金属性大于硒。(3)、硒化氢(H2Se)是一种有恶臭味的有毒气体,是一种(选填“极性、或非极性”)分子,其空间结构为型。(4)、工业上常用浓H2SO4焙烧CuSe的方法提取硒,反应产生SO2、SeO2的混合气体,写出反应的化学方程式。理论上该反应每转移1mol电子,可得到SeO2的质量为g,得到SO2在标准状况下的体积为 L。22. 工业上可由氢气、氮气合成氨气,溶于水形成氨水。一定温度下,向2L固定体积的密闭容器中加入N2(g)和H2(g),发生反应:N2(g)+3H2(g)
(1)、Se元素在周期表中的位置为。表中78.96的意义为。Se原子最外层电子排布的轨道表示式为。(2)、从原子结构角度解释硫的非金属性大于硒。(3)、硒化氢(H2Se)是一种有恶臭味的有毒气体,是一种(选填“极性、或非极性”)分子,其空间结构为型。(4)、工业上常用浓H2SO4焙烧CuSe的方法提取硒,反应产生SO2、SeO2的混合气体,写出反应的化学方程式。理论上该反应每转移1mol电子,可得到SeO2的质量为g,得到SO2在标准状况下的体积为 L。22. 工业上可由氢气、氮气合成氨气,溶于水形成氨水。一定温度下,向2L固定体积的密闭容器中加入N2(g)和H2(g),发生反应:N2(g)+3H2(g) 2NH3(g)+Q(Q>0),NH3物质的量随时间的变化如图所示。
2NH3(g)+Q(Q>0),NH3物质的量随时间的变化如图所示。 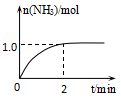 (1)、0~2min内的平均反应速率v(H2)=。(2)、该温度下,反应的平衡常数表达式K=。
(1)、0~2min内的平均反应速率v(H2)=。(2)、该温度下,反应的平衡常数表达式K=。其平衡常数K与温度T的关系如下表:

试判断K1K2(填写“>”、“=”或“<”)。
(3)、能说明该合成氨反应已达到平衡状态的是(选填编号)。a.3v(N2)=v(H2)
b.容器内压强保持不变
c.混合气体的密度保持不变
d.25℃时,测得容器中c(NH3)=0.2mol·L-1 , c(H2)=c(N2)=0.01mol·L-1
常温下,某同学将盐酸与氨水等体积混合,两种溶液的浓度和混合后所得溶液的pH如表。

请回答:
(4)、①中所得混合溶液,pH7(填“>”、“<”或“=”);②中c 0.2(填“>”、“<”或“=”),所得混合溶液中各离子浓度大小关系为。(5)、请你设计一个能证明一水合氨是弱电解质的简要方案。三、推断题
-
23. 2-苯基丙烯酸(俗名阿托酸)是一种重要的医药中间体、材料中间体,可用下列方法合成。首先,由A制得E,过程如下:

已知:i.CH3CH2Br+NaCN CH3CH2CN+NaBr
ii.CH3CH2CN CH3CH2COOH
(1)、烃A的名称是。D的同分异构体中,能发生银镜反应的芳香族化合物有多种,任写一种该类同分异构体的结构简式。写出反应④的化学方程式。又已知,iii:R—CH2—COOCH2R’+HCOOCH2R”
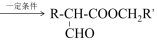 +R”—CH2OH
+R”—CH2OH然后,通过下列路线可得最终产品:
 (2)、检验F是否完全转化为G的试剂是。反应⑤的化学方程式是。(3)、路线二与路线一相比不太理想,理由是。(4)、设计并完善以下合成流程图。
(2)、检验F是否完全转化为G的试剂是。反应⑤的化学方程式是。(3)、路线二与路线一相比不太理想,理由是。(4)、设计并完善以下合成流程图。
(合成路线常用的表示方式为:A
 B……
B……  目标产物)
目标产物)四、实验题
-
24. 为了监测某烟道气中的NOx的含量,选用如下采样和检测方法。
 (1)、I.采样步骤
(1)、I.采样步骤①检验系统气密性;②加热器将烟道气加热至140℃;③打开抽气泵置换系统内空气;④采集无尘、干燥的气样;⑤关闭系统,停止采样。
A中装有无碱玻璃棉,其作用是。采样步骤②加热烟道气的目的是。
C中填充的干燥剂最好的选择是(选填编号)。
a.碱石灰 b.无水CuSO4 c.P2O5
(2)、用实验室常用仪器组装一套装置,其作用与D(装有碱液)相同,在虚线框中画出该装置的示意图,标明气体的流向及试剂。 (3)、Ⅱ.NOx含量的测定
(3)、Ⅱ.NOx含量的测定将一定量的气样通入适量酸化的H2O2溶液中,使NOx完全被氧化为NO3- , 然后加入过量的FeSO4标准溶液,充分反应后,再用K2Cr2O7标准溶液滴定剩余的Fe2+。
NO被H2O2氧化为NO3-的离子方程式是。滴定操作使用的玻璃仪器主要有。
(4)、滴定过程中发生下列反应:3Fe2++NO3−+4H+=NO↑+3Fe3++2H2O、Cr2O72−+6Fe2++14H+=2Cr3++6Fe3++7H2O。判断下列情况对NOx含量测定结果的影响(填“偏高”、“偏低”或“无影响”):若缺少采样步骤③,会使测试结果;若FeSO4标准溶液部分变质,会使测定结果。
-