上海市杨浦区2020年高考化学二模试卷
试卷更新日期:2020-06-23 类型:高考模拟
一、单选题
-
1. 生铁的熔点是1100~1200℃,则可推断纯铁的熔点是( )A、1085℃ B、1160℃ C、1200℃ D、1535℃2. 对 中各数字的描述错误的是( )A、8:质子数 B、16:质量数 C、2-:电子数 D、-2:化合价3. 不能鉴别黄色的溴水和Fe2(SO4)3溶液的是( )A、NaOH溶液 B、CCl4 C、AgNO3溶液 D、淀粉KI试纸4. 下列过程中共价键被破坏的是( )A、氯气溶于水 B、碘升华 C、乙醇溶于水 D、NaOH溶于水5. 氮元素被氧化的反应是( )A、工业合成氨 B、闪电时,空气中产生NO C、常温下,浓硝酸使铁钝化 D、实验室检验NH4+6. 石油分馏得到的石蜡,其中的有色物质常用氯气漂白,该过程中少量的石蜡会与氯气发生( )A、取代反应 B、加成反应 C、还原反应 D、消除反应7. 向FeCl3和BaCl2的混合溶液中通入SO2 , 有沉淀生成,此沉淀是( )A、Fe(OH)3 B、FeS C、S D、BaSO48. 决定气体摩尔体积的主要因素是( )A、微粒的大小 B、微粒间的距离 C、微粒的种类 D、微粒的数目9. 84消毒液(pH约为12,有效成分为NaClO)露置在空气中发生变质,此过程中( )A、未发生复分解反应 B、Na、O化合价未变 C、碱性逐渐增强 D、会产生氧气10. 储存浓H2SO4的铁罐外口易出现腐蚀,主要原因是硫酸具有( )A、脱水性和吸水性 B、强氧化性和脱水性 C、吸水性和酸性 D、难挥发性和酸性11. 对α-甲基苯乙烯(
 )的分析,正确的是( ) A、沸点比苯低 B、聚合反应产物的分子式为:(C9H10)n C、易溶于水 D、分子中所有的原子处于同一平面12. 下列试剂和条件下,
)的分析,正确的是( ) A、沸点比苯低 B、聚合反应产物的分子式为:(C9H10)n C、易溶于水 D、分子中所有的原子处于同一平面12. 下列试剂和条件下, 不能发生化学反应的是( ) A、氧化铜,加热 B、酸性高锰酸钾溶液,常温 C、浓硫酸,加热 D、HBr,加热13. 已知:①I2(g)+H2(g) 2HI(g)+26.5kJ、②I2(s)+H2(g) 2HI(g)-9.5kJ,下列分析正确的是( )A、①是放热反应,无需加热即可发生 B、②需持续不断加热才能发生反应 C、I2(g)和I2(s)的能量关系如图所示
不能发生化学反应的是( ) A、氧化铜,加热 B、酸性高锰酸钾溶液,常温 C、浓硫酸,加热 D、HBr,加热13. 已知:①I2(g)+H2(g) 2HI(g)+26.5kJ、②I2(s)+H2(g) 2HI(g)-9.5kJ,下列分析正确的是( )A、①是放热反应,无需加热即可发生 B、②需持续不断加热才能发生反应 C、I2(g)和I2(s)的能量关系如图所示 D、1molI2(s)和1molH2(g)的能量之和比2molHI(g)能量高
14. 表面有氧化膜的铝片,投入到足量的NaOH溶液中,充分反应( )A、n(还原剂):n(氧化剂)=1:3 B、Al(OH)3表现了弱碱性 C、氧化剂是NaOH D、n(生成AlO2-):n(生成H2)=2:315. 如图是家用消毒液发生器,下列分析错误的是( )
D、1molI2(s)和1molH2(g)的能量之和比2molHI(g)能量高
14. 表面有氧化膜的铝片,投入到足量的NaOH溶液中,充分反应( )A、n(还原剂):n(氧化剂)=1:3 B、Al(OH)3表现了弱碱性 C、氧化剂是NaOH D、n(生成AlO2-):n(生成H2)=2:315. 如图是家用消毒液发生器,下列分析错误的是( ) A、碳棒a是阴极 B、反应中碳棒b附近溶液显酸性 C、电子由碳棒a经溶液流向碳棒b D、发生器中的总反应:NaCl+H2O NaClO+H2↑16. 用FeCl3溶液蚀刻铜箔回收铜的一种流程如图所示。下列叙述正确的是( )
A、碳棒a是阴极 B、反应中碳棒b附近溶液显酸性 C、电子由碳棒a经溶液流向碳棒b D、发生器中的总反应:NaCl+H2O NaClO+H2↑16. 用FeCl3溶液蚀刻铜箔回收铜的一种流程如图所示。下列叙述正确的是( ) A、蚀刻铜箔的离子方程式:2Cu+Fe3+→2Cu2++Fe2+ B、试剂X是盐酸或稀硝酸 C、滤液Y呈浅绿色 D、试剂Z只能是氯水17. 向H2SO4和NH4Al(SO4)2的混合溶液中滴加NaOH溶液,不可能发生( )A、H++OH-→H2O B、Al3++4NH3·H2O→AlO2-+4NH4++2H2O C、NH4++OH-→NH3·H2O D、Al(OH)3+OH-→AlO2-+2H2O18. 固定体积的密闭容器中,发生:4NH3(g)+5O2(g) 4NO(g)+6H2O(g),能判断该反应达到平衡状态的依据是( )A、5υ正(O2)=4υ逆(NO) B、容器内气体密度不再变化 C、c(NH3)不再变化 D、c(NH3)=1.5c(H2O)19. 某纯碱工业的生产流程如图,判断错误的是( )
A、蚀刻铜箔的离子方程式:2Cu+Fe3+→2Cu2++Fe2+ B、试剂X是盐酸或稀硝酸 C、滤液Y呈浅绿色 D、试剂Z只能是氯水17. 向H2SO4和NH4Al(SO4)2的混合溶液中滴加NaOH溶液,不可能发生( )A、H++OH-→H2O B、Al3++4NH3·H2O→AlO2-+4NH4++2H2O C、NH4++OH-→NH3·H2O D、Al(OH)3+OH-→AlO2-+2H2O18. 固定体积的密闭容器中,发生:4NH3(g)+5O2(g) 4NO(g)+6H2O(g),能判断该反应达到平衡状态的依据是( )A、5υ正(O2)=4υ逆(NO) B、容器内气体密度不再变化 C、c(NH3)不再变化 D、c(NH3)=1.5c(H2O)19. 某纯碱工业的生产流程如图,判断错误的是( ) A、该流程是索尔维法制碱 B、X是NaCl C、Y是Na2CO3 D、Z是NH4Cl20. 0.5mol·L-1CH3COONa溶液和水的pH随温度的变化如图所示,下列分析错误的是( )
A、该流程是索尔维法制碱 B、X是NaCl C、Y是Na2CO3 D、Z是NH4Cl20. 0.5mol·L-1CH3COONa溶液和水的pH随温度的变化如图所示,下列分析错误的是( ) A、25℃,CH3COONa溶液的pH=8.2,显碱性 B、60℃,H2O中c(H+)=1×10-6.5mol·L-1 , 呈中性 C、60℃,CH3COONa溶液中c(OH-)=1×10-5.1mol·L-1 D、升高温度,CH3COONa溶液水解程度和pH都减小
A、25℃,CH3COONa溶液的pH=8.2,显碱性 B、60℃,H2O中c(H+)=1×10-6.5mol·L-1 , 呈中性 C、60℃,CH3COONa溶液中c(OH-)=1×10-5.1mol·L-1 D、升高温度,CH3COONa溶液水解程度和pH都减小二、综合题
-
21.(1)、I.N和Li、Na形成的Li3N、NaN3等化合物具有重要的用途。完成下列填空:
氮原子核外能量最高的电子所处的轨道是:。锂离子核外电子的轨道表示式是:。
(2)、已知Li3N熔点为845℃,NH3熔点﹣77.7℃,用物质结构的知识说明这两种含氮化合物熔点差异的可能原因。(3)、II.研究者发明了利用锂循环合成氨的工艺,其流程如下: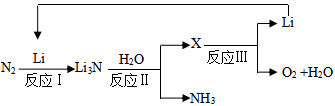
每合成1mol氨,转移电子mol;该过程最终得到的氧化产物是。
(4)、写出反应Ⅱ的化学反应方程式:。向0.35gLi3N中加入40mL1mol/L的盐酸,所得溶液中离子浓度由大到小的顺序是:。(5)、由元素周期律能得到____________(填序号)。A、碱性:LiOH<NaOH B、与水反应的剧烈程度:Li<Na C、溶解度:LiOH<NaOH D、密度:Li<Na(6)、NaN3可用于汽车安全气囊,冲撞时发生如下反应:□NaN3+□KNO3→□K2O+□Na2O+□N2↑,配平此反应的化学方程式,并标出电子转移的数目和方向。22. 钼(Mo)是人体及动植物必需的微量元素,且在芯片制作、药物和医学造影等方面也有重要作用。用辉钼矿冶炼金属钼的某反应:MoS2(s)+2Na2CO3(s)+4H2(g) Mo(s)+2CO(g)+4H2O(g)+2Na2S(s),该反应中氢气的平衡转化率与温度、压强的关系如图所示: (1)、Na2S的电子式为:。上述反应的气态反应物和生成物中属于极性分子的是(填写化学式)。举出一个事实,说明硫的非金属性比碳强(用化学方程式表示)。(2)、写出上述反应的平衡常数表达式K=。上述正反应是反应(填“吸热”或“放热”)。(3)、1100℃,2L恒容密闭容器中,加入0.1molMoS2、0.2molNa2CO3、0.4molH2 , 反应至20min时达到的平衡状态恰好处于上图中的A点。此过程中,用H2表示的平均速率为。其他条件一定时,B点的速率C点(填“大于”“等于”或“小于”),说明理由:。(4)、A、B、C三点代表的平衡状态的平衡常数的大小为:KAKBKC(填“大于”“等于”或“小于”),并说明理由:。23. 化合物D具有抗病毒作用,如图是利用Heck反应合成D的一种路线。
(1)、Na2S的电子式为:。上述反应的气态反应物和生成物中属于极性分子的是(填写化学式)。举出一个事实,说明硫的非金属性比碳强(用化学方程式表示)。(2)、写出上述反应的平衡常数表达式K=。上述正反应是反应(填“吸热”或“放热”)。(3)、1100℃,2L恒容密闭容器中,加入0.1molMoS2、0.2molNa2CO3、0.4molH2 , 反应至20min时达到的平衡状态恰好处于上图中的A点。此过程中,用H2表示的平均速率为。其他条件一定时,B点的速率C点(填“大于”“等于”或“小于”),说明理由:。(4)、A、B、C三点代表的平衡状态的平衡常数的大小为:KAKBKC(填“大于”“等于”或“小于”),并说明理由:。23. 化合物D具有抗病毒作用,如图是利用Heck反应合成D的一种路线。
已知Heck反应:R1-X+R2-CH=CH2
 R1-CH=CH-R2+HX
R1-CH=CH-R2+HX完成下列填空:
(1)、反应①的反应类型是:反应。(2)、丙烯酸(CH2=CH-COOH)中官能团的名称是:。(3)、写出苯环上只有一个侧链且含-COO-的B的所有同分异构体的结构简式:。(4)、利用Heck反应,由苯和乙苯( )为原料制备
)为原料制备  ,写出合成路线。(无机试剂任选)(合成路线的表示方式为:
,写出合成路线。(无机试剂任选)(合成路线的表示方式为:  )。 (5)、工业上可用丙烯氧化法生产丙烯酸(CH2=CH-COOH),得到的丙烯酸中往往混有丙烯醛(CH2=CH-CHO)。
)。 (5)、工业上可用丙烯氧化法生产丙烯酸(CH2=CH-COOH),得到的丙烯酸中往往混有丙烯醛(CH2=CH-CHO)。①制备过程中,证明已有丙烯酸生成的方法是:。
②证明生成的丙烯酸中混有丙烯醛的方法是:。
三、实验题
-
24. 为测定苏打中Na2CO3的含量(含NaHCO3杂质),实验小组设计了如下三个实验方案。
方案Ⅰ.①称量:仪器X的质量为ag;②称量:仪器X和装有试样的质量为bg;③加热;④冷却;⑤称量:仪器X和残余物的质量为cg;⑥重复____________操作,直至恒重,质量为dg。
(1)、仪器X是(填名称),方案 Ⅰ 的实验原理是:(用化学方程式表示)。(2)、请将步骤⑥补充完整:重复操作,步骤⑥的目的是:。(3)、计算Na2CO3的质量分数要用到的数据是(选填a、b、c、d)。(4)、方案Ⅱ.称量一定量样品,选用合适的装置测定样品与硫酸反应生成的气体体积。
为提高测定准确性,应选用发生装置(选填“A”或“B”)和量气装置D;装置D比装置C准确性高的原因是(任一条原因)。
(5)、检查装置A的气密性:向A的分液漏斗中加入适量水,按图连接好装置,关闭止水夹F,打开活塞E,发现分液漏斗中的水持续滴下,说明A漏气。该判断是否正确,并说明理由:。(6)、方案Ⅲ.称量0.2570g样品,置于锥形瓶中,加适量水溶解,滴2滴酚酞试液,用0.1000mol/L盐酸滴定至溶液由浅红色变成无色且半分钟不变色,反应原理:Na2CO3+HCl→NaHCO3+NaCl,重复上述操作两次。用密度为1.19g/mL、质量分数为0.37的浓盐酸,配制1L0.1000mol/L稀盐酸,所需的定量仪器是:滴定管、1L容量瓶,其中滴定管的作用是。滴定管和容量瓶在使用前都要进行的操作是。(选填序号)
Y.检漏 Z.用蒸馏水洗涤 W.用待装液润洗
(7)、根据表中数据,碳酸钠的质量分数为(小数点后保留四位)。滴定次数
样品的质量/g
稀盐酸的体积/mL
滴定前读数
滴定后读数
1
0.2570
1.00
21.01
2
0.2570
0.50
20.49
3
0.2570
1.20
21.20