上海市浦东新区2020年高考化学二模试卷
试卷更新日期:2020-06-23 类型:高考模拟
一、单选题
-
1. 我国自主研发的超薄铷(Rb)原子钟,每3000万年误差仅1秒。下列关于铷的稳定同位素 Rb的说法正确的是( )A、质子数是85 B、中子数是48 C、质量数是37 D、电子数为482. 下列措施会引起大气中SO2含量上升的是( )A、燃煤供热 B、风力发电 C、发展核能 D、植树造林3. 硫化氢气体不具有( )A、毒性 B、可燃性 C、还原性 D、漂白性4. 下列物质与铝的反应属于铝热反应的是( )A、HCl B、Fe2O3 C、H2O D、NaOH5. 下列变化属于物理变化的是( )A、明矾净水 B、铵盐受热分解 C、液溴挥发 D、石油催化裂化6. 苏轼的《格物粗淡》中有这样的记载:“红柿摘下未熟,每篮用木瓜三枚放入,得气即发,并无涩味。”按照现代科技观点,该文中的“气”是指( )A、甲烷 B、乙烯 C、甲醛 D、乙酸7. 海洋是资源的宝库,下列生产过程中不涉及氧化还原反应的是( )A、海水晒盐 B、电解饱和食盐水 C、海带提碘 D、用氯气制漂粉精8. 化学对人类健康意义重大,下列说法错误的是( )A、大量出汗后需补充氯化钠 B、骨质疏松需要补充钙元素 C、HCO3-参与维持人体血液酸碱平衡 D、BaCO3作X射线透视肠胃内服药剂9. 合成氨反应难以发生的根本原因是( )A、该反应是可逆反应 B、氮分子中存在氮氮叁键 C、该反应需要催化剂 D、氨气容易液化10. 埋在下列土壤中的铸铁输油管道,腐蚀速率最慢的是( )A、氧化铁较多的酸性土壤 B、潮湿疏松的中性土壤 C、碳颗粒较多的碱性土壤 D、干燥致密的中性土壤11. 下列有关性质的比较,不能用元素周期律解释的是( )A、酸性:H2SO4>HClO B、金属性:Mg>Al C、碱性:NaOH>LiOH D、稳定性:CH4>SiH412. 某同学想用实验证明硫酸铜溶液的蓝色与SO42-无关。下列实验无意义的是( )A、观察明矾溶液为无色 B、取样,加水稀释,溶液蓝色变浅 C、取样,滴加过量硝酸钡溶液,溶液仍为蓝色 D、取样,滴加过量氢氧化钠溶液,溶液变成无色13. 下列反应不能生成黄色固体的是( )A、氯气通入碘化钾溶液中 B、金属钠在空气中燃烧 C、碘水滴入硝酸银溶液中 D、硫化氢气体通入亚硫酸中14. 通过排饱和食盐水,用大试管收集体积比为1∶1的甲烷和氯气混合气(如图),强光照射下发生反应。下列说法错误的是( )
 A、试管中气体颜色变浅 B、试管内液面慢慢上升 C、水槽中的液体溶有氯化氢 D、试管内壁的油滴是纯净物15. 纯碱是一种重要的化工原料,对于“氨碱法”和“联合制碱法”的分析中,错误的是( )A、主反应的原理相同 B、二氧化碳来源不同 C、都有氨的循环利用 D、都具有一定局限性16. 用碳化铝制取甲烷的化学方程式为:Al4C3+12H2O=4Al(OH)3↓+3CH4↑。下列有关化学用语表示正确的是( )A、铝离子的电子排布式:1s22s22p63s23p1 B、水分子的结构式:H—O—H C、甲烷的比例模型:
A、试管中气体颜色变浅 B、试管内液面慢慢上升 C、水槽中的液体溶有氯化氢 D、试管内壁的油滴是纯净物15. 纯碱是一种重要的化工原料,对于“氨碱法”和“联合制碱法”的分析中,错误的是( )A、主反应的原理相同 B、二氧化碳来源不同 C、都有氨的循环利用 D、都具有一定局限性16. 用碳化铝制取甲烷的化学方程式为:Al4C3+12H2O=4Al(OH)3↓+3CH4↑。下列有关化学用语表示正确的是( )A、铝离子的电子排布式:1s22s22p63s23p1 B、水分子的结构式:H—O—H C、甲烷的比例模型: D、氢氧化铝的电离方程式:H++AlO2-+H2O=Al(OH)3=Al3++3OH-
17. 实验室制取乙酸丁酯的装置如图。下列对该实验的认识正确的是( )
D、氢氧化铝的电离方程式:H++AlO2-+H2O=Al(OH)3=Al3++3OH-
17. 实验室制取乙酸丁酯的装置如图。下列对该实验的认识正确的是( ) A、采用空气浴加热,石棉网可以避免局部温度过高 B、试管上方长导管的作用是让反应产生的气体逸出 C、反应结束后混合液下层呈油状且有果香味 D、欲提纯乙酸丁酯,需使用水、氢氧化钠溶液洗涤18. 下列离子方程式中,只能表示唯一一个酸碱中和反应的是( )A、H++NH3·H2O=NH4++H2O B、CH3COOH+OH-=CH3COO-+H2O C、2H++Mg(OH)2=2H2O+Mg2+ D、2H++Ba2++2OH-+SO42-=2H2O+BaSO4↓19. 利用某些有机物之间的转化可储存太阳能,例如四环烷(QDC)与降冰片二烯(NBD)之间的相互转化,反应过程中的能量变化如图所示。
A、采用空气浴加热,石棉网可以避免局部温度过高 B、试管上方长导管的作用是让反应产生的气体逸出 C、反应结束后混合液下层呈油状且有果香味 D、欲提纯乙酸丁酯,需使用水、氢氧化钠溶液洗涤18. 下列离子方程式中,只能表示唯一一个酸碱中和反应的是( )A、H++NH3·H2O=NH4++H2O B、CH3COOH+OH-=CH3COO-+H2O C、2H++Mg(OH)2=2H2O+Mg2+ D、2H++Ba2++2OH-+SO42-=2H2O+BaSO4↓19. 利用某些有机物之间的转化可储存太阳能,例如四环烷(QDC)与降冰片二烯(NBD)之间的相互转化,反应过程中的能量变化如图所示。

以下叙述中错误的是( )
A、QDC和NBD互为同分异构体 B、相同条件下,NBD比QDC稳定 C、QDC转变为NBD的过程中可以储存太阳能 D、上述转化过程中加入催化剂,对于图中Q的大小没有影响20. 可逆反应xH2S(g) xH2(g)+Sx(g)(x>1)达到平衡后,下列说法错误的是( )A、若恒容充入H2 , 则新平衡后H2S分解率下降 B、若增大压强,气体颜色变深,则Sx为有色气体 C、若恒容升温后,气体密度不变,说明达到了新平衡 D、若改变某一条件后,压强不能作为判断新平衡的标志,则Sx状态发生改变二、综合题
-
21. 二氧化氯(ClO2)可以除去工业污水中的氰化物,反应的离子方程式为:2ClO2+2CN-=2CO2↑+N2↑+2Cl-
完成下列填空:
(1)、上述反应所涉及元素的原子半径由大到小的顺序是;其中原子核外有两个未成对电子的元素有。请比较碳和氮元素非金属性强弱(用一个化学反应方程式表示)。(2)、二氧化氯还可以除去污水中的锰离子,请配平如下反应:。ClO2+MnSO4+H2O→MnO2↓+HCl+H2SO4
若反应中生成0.2molMnO2 , 则电子转移个。
(3)、氯的另一种氧化物Cl2O每个原子都达到8电子稳定结构,它的电子式为。(4)、另一种处理含氰化物污水的方法是电解法,分析判断CN-是在极上(选填编号:①阴;②阳)被反应成CO2和N2 , 判断的依据是。22. 工业烟气中去除氮氧化物的过程称为“脱硝”,某脱硝反应的平衡常数表达式为:K= ,已知该反应的正反应为放热反应。(1)、欲使该反应的K值增大,可采取的措施是。(2)、400℃,在某恒容密闭容器中发生上述反应。测得部分物质浓度与时间的关系如图1所示。分钟后,该反应的正逆反应速率相等;前4min内用O2表示的平均反应速率v(O2)=。
 (3)、保持其他条件不变,探究 的比值对NO转化率的影响,结果如图2所示,当 <1时,NO转化率随着该比值的上升而上升,原因是(用平衡移动原理解释);当 >1后,由于氨气发生副反应导致烟气中NO浓度增大,使得转化率下降,这个副反应可以是(用化学方程式表示)。(4)、烟气脱硝的另一途径是电解NO:8NO+7H2O 3NH4NO3+2HNO3。为得到纯净的NH4NO3 , 向上述所得溶液中通入适量NH3 , 浓度增大的离子有;所得溶液稀释后可给庄稼施肥,稀释时 将(选填“增大”、“不变”或“减小”),理由是。
(3)、保持其他条件不变,探究 的比值对NO转化率的影响,结果如图2所示,当 <1时,NO转化率随着该比值的上升而上升,原因是(用平衡移动原理解释);当 >1后,由于氨气发生副反应导致烟气中NO浓度增大,使得转化率下降,这个副反应可以是(用化学方程式表示)。(4)、烟气脱硝的另一途径是电解NO:8NO+7H2O 3NH4NO3+2HNO3。为得到纯净的NH4NO3 , 向上述所得溶液中通入适量NH3 , 浓度增大的离子有;所得溶液稀释后可给庄稼施肥,稀释时 将(选填“增大”、“不变”或“减小”),理由是。三、实验题
-
23. 已知:2Fe+6H2SO4(浓) Fe2(SO4)3+3SO2↑+6H2O。某学习小组对铁丝(含杂质碳)与浓硫酸反应后的产物进行探究。
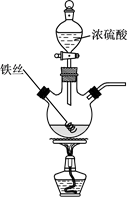 (1)、Ⅰ.溶液探究
(1)、Ⅰ.溶液探究将反应后的溶液稀释,取稀释液,滴加NaOH溶液,观察到现象时,证明有Fe3+存在。为进一步判断溶液中是否存在Fe2+ , 可另取稀释液少许,滴加(选填编号)。
a.KSCN溶液和氯水 b.铁粉和KSCN溶液
c.浓氨水 d.KMnO4酸性溶液
(2)、为判断反应停止后硫酸是否有剩余,制定的实验方案为:测定稀释液的pH。请对此实验设计进行评价。。(3)、Ⅱ.气体探究将产生的气体依次通过品红溶液和澄清石灰水,观察到:品红溶液褪色、澄清石灰水变浑浊。是否(填写“是”或“否”)能据此判断除SO2外,反应后气体中还含有CO2?请说明理由。
最后逸出的气体具有可燃性,推测该气体为H2 , 理由是(用离子方程式表示)。
(4)、收集混合气体336mL(已折算成标准状况),通入足量的氯水中,发生反应:SO2+Cl2+2H2O=H2SO4+2HCl。滴加足量BaCl2溶液,生成的沉淀经过滤、洗涤、干燥、称量,测得质量为2.330g。则混合气体中SO2的体积分数为。(精确至小数点后第二位)(5)、将上述混合气体直接通入BaCl2溶液,未见明显现象,放置一段时间后发现有少许浑浊,分析其中的原因。四、推断题
-
24. 有机物M(
 )是合成药物瑞德西韦的中间体,其合成途径如图:
)是合成药物瑞德西韦的中间体,其合成途径如图: 
已知:
 +HCN→
+HCN→  (R和R′均表示烃基或氢原子)
(R和R′均表示烃基或氢原子)完成下列填空:
(1)、M中含氧官能团的名称为。反应①~③中属于取代反应的有。反应⑤的化学方程式为。(2)、反应④需要在无水条件下进行,如何检验反应③所得产物中的水已被除净?。(3)、写出两种满足下列条件的有机物的结构简式。①(C2H5)2CHOH的同分异构体,②能发生消除反应且只生成一种烯烃。
(4)、聚甲基丙烯酸( )常用作胶黏剂、锅炉阻垢剂以及合成离子交换树脂。根据已有知识并结合题目流程中的信息,设计由丙酮(
)常用作胶黏剂、锅炉阻垢剂以及合成离子交换树脂。根据已有知识并结合题目流程中的信息,设计由丙酮(  )制备甲基丙烯酸(
)制备甲基丙烯酸(  )的合成路线。
)的合成路线。 (合成路线常用的表示方式为:A
 B∙∙∙∙∙∙
B∙∙∙∙∙∙  目标产物)
目标产物)
-