上海市金山区2020年高考化学二模试卷
试卷更新日期:2020-06-23 类型:高考模拟
一、单选题
-
1. 古法酿酒工艺中,以发生化学反应为主的过程是( )A、酒曲捣碎 B、酒曲发酵 C、加热蒸馏 D、泉水勾兑2. 用化学用语表示2H2S+3O2 2SO2+2H2O中的相关微粒,其中正确的是( )A、中子数为18的硫原子:18S B、H2O的结构式:H-O-H C、H2S的比例模型:
 D、S的原子结构示意图:
D、S的原子结构示意图:  3. 下列气态氢化物中最不稳定的是( )A、H2O B、HF C、H2S D、PH34. 下列过程中破坏的化学键只有共价键的是( )A、石墨转化为金刚石 B、NaOH溶于水 C、干冰升华 D、NH4Cl分解5. 加入氧化剂才能实现的过程是( )A、Cl2→ClO- B、SO2→SO42- C、N2→NH3 D、Al3+→AlO2-6. 常温下,0.05 mol/L稀硫酸中OH-浓度是(mol/L)( )A、1×10-12 B、2×10-12 C、1×10-13 D、2×10-137. 0.1 mol Cu与足量浓硫酸加热,充分反应后,被还原的H2SO4的物质的量为(mol)( )A、<0.1 B、0.1 C、<0.2 D、0.28. 侯氏制碱法中没有用到的原料是( )A、CaO B、NaCl C、NH3 D、CO29. 仅用蒸馏水不能鉴别出的一组物质是( )A、乙酸乙酯、乙醇 B、无水硫酸铜、小苏打 C、烧碱、硝酸铵 D、硫化亚铁、氧化铜10. 邮票背面的粘合剂可用水浸除去,根据“相似相溶”原理,该粘合剂的成分可能是( )A、
3. 下列气态氢化物中最不稳定的是( )A、H2O B、HF C、H2S D、PH34. 下列过程中破坏的化学键只有共价键的是( )A、石墨转化为金刚石 B、NaOH溶于水 C、干冰升华 D、NH4Cl分解5. 加入氧化剂才能实现的过程是( )A、Cl2→ClO- B、SO2→SO42- C、N2→NH3 D、Al3+→AlO2-6. 常温下,0.05 mol/L稀硫酸中OH-浓度是(mol/L)( )A、1×10-12 B、2×10-12 C、1×10-13 D、2×10-137. 0.1 mol Cu与足量浓硫酸加热,充分反应后,被还原的H2SO4的物质的量为(mol)( )A、<0.1 B、0.1 C、<0.2 D、0.28. 侯氏制碱法中没有用到的原料是( )A、CaO B、NaCl C、NH3 D、CO29. 仅用蒸馏水不能鉴别出的一组物质是( )A、乙酸乙酯、乙醇 B、无水硫酸铜、小苏打 C、烧碱、硝酸铵 D、硫化亚铁、氧化铜10. 邮票背面的粘合剂可用水浸除去,根据“相似相溶”原理,该粘合剂的成分可能是( )A、 B、
B、 C、
C、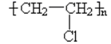 D、
D、 11. H2C=CH-CH=CH2通过一步反应不能得到( )A、
11. H2C=CH-CH=CH2通过一步反应不能得到( )A、 B、
B、 C、
C、 D、CO2
12. 下列反应不属于离子反应的是( )A、乙醇与乙酸 B、氨水与醋酸 C、碳酸钙与盐酸 D、氯化铁溶液与硫氰化钾溶液13. 有关磷原子最外层电子的描述正确的是( )A、有2种不同运动状态 B、有5种不同能量 C、有4种不同的伸展方向 D、只有1种自旋方向14. 在10 mL浓度均为0.1 mol/L的AlCl3与MgCl2混合溶液中,加入60 mL、0.1 mol/L的NaOH溶液后,铝元素的存在形式是( )A、Al3+、Al(OH)3 B、Al(OH)3 C、 lO2-、Al(OH)3 D、 lO2-15. 锌锰碱性干电池是依据原电池原理制成的化学电源。电池中负极与电解质溶液接触直接反应会降低电池的能量转化效率,称为自放电现象。
D、CO2
12. 下列反应不属于离子反应的是( )A、乙醇与乙酸 B、氨水与醋酸 C、碳酸钙与盐酸 D、氯化铁溶液与硫氰化钾溶液13. 有关磷原子最外层电子的描述正确的是( )A、有2种不同运动状态 B、有5种不同能量 C、有4种不同的伸展方向 D、只有1种自旋方向14. 在10 mL浓度均为0.1 mol/L的AlCl3与MgCl2混合溶液中,加入60 mL、0.1 mol/L的NaOH溶液后,铝元素的存在形式是( )A、Al3+、Al(OH)3 B、Al(OH)3 C、 lO2-、Al(OH)3 D、 lO2-15. 锌锰碱性干电池是依据原电池原理制成的化学电源。电池中负极与电解质溶液接触直接反应会降低电池的能量转化效率,称为自放电现象。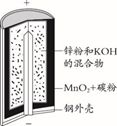
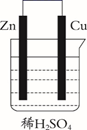
下列关于原电池和干电池的说法错误的是( )
A、两者正极材料不同 B、MnO2的放电产物可能是KMnO4 C、两者负极反应式均为Zn失电子 D、原电池中Zn与稀H2SO4存在自放电现象16. 用滴定法测定含有少量NaCl的小苏打固体中NaHCO3的质量分数,所用标准盐酸的浓度为0.1000 mol/L。有关叙述正确的是( )A、用量筒配制100 mL待测液 B、滴定前用待测液润洗锥形瓶 C、当滴至指示剂变色并能将该颜色保持半分钟即为滴定终点 D、装标准液前未用标准盐酸润洗滴定管,会造成实验结果偏低17. CH4与Cl2生成CH3Cl的反应过程,中间态物质的能量关系见下图。有关说法错误的是( ) A、Cl·是由Cl2在光照下化学键断裂生成的,该过程可表示为:
A、Cl·是由Cl2在光照下化学键断裂生成的,该过程可表示为: B、反应过程一定无CH3CH3的生成
C、图中的反应热Q>0,其大小与Ea1、Ea2无关
D、CH4转化为CH3Cl的过程,C-H键发生了断裂
18. 关于25℃时,体积相同的盐酸与醋酸两种溶液,下列说法正确的是( )A、若浓度相同,中和所需的NaOH物质的量相同 B、若浓度相同,分别与镁条反应的速率相等 C、若pH相等,则c(CH3COO-)>c(Cl-) D、若pH相等,分别与NaOH反应呈中性后,n(CH3COO-)=n(Cl-)19. 将NaCl溶于水配成1mol/L的溶液,溶解过程如图所示,下列说法正确的是( )
B、反应过程一定无CH3CH3的生成
C、图中的反应热Q>0,其大小与Ea1、Ea2无关
D、CH4转化为CH3Cl的过程,C-H键发生了断裂
18. 关于25℃时,体积相同的盐酸与醋酸两种溶液,下列说法正确的是( )A、若浓度相同,中和所需的NaOH物质的量相同 B、若浓度相同,分别与镁条反应的速率相等 C、若pH相等,则c(CH3COO-)>c(Cl-) D、若pH相等,分别与NaOH反应呈中性后,n(CH3COO-)=n(Cl-)19. 将NaCl溶于水配成1mol/L的溶液,溶解过程如图所示,下列说法正确的是( ) A、a离子为Na+ B、溶液中含有NA个Na+ C、水合b离子的图示不科学 D、氯化钠溶于水只发生了水合过程20. 向H2O2溶液中加入Br2可以加快H2O2分解速率。其反应机理可能有两步,第1步:H2O2+Br2→2H++O2↑+2Br-。下列说法正确的是( )A、H2O2分子中含有离子键和非极性键 B、第1步反应每生成0.1 mol O2 , 转移0.4 mol电子 C、第2步反应为:2H++H2O2+2Br-→2H2O +Br2 D、H2O2分解反应前后溶液中Br2的质量不变
A、a离子为Na+ B、溶液中含有NA个Na+ C、水合b离子的图示不科学 D、氯化钠溶于水只发生了水合过程20. 向H2O2溶液中加入Br2可以加快H2O2分解速率。其反应机理可能有两步,第1步:H2O2+Br2→2H++O2↑+2Br-。下列说法正确的是( )A、H2O2分子中含有离子键和非极性键 B、第1步反应每生成0.1 mol O2 , 转移0.4 mol电子 C、第2步反应为:2H++H2O2+2Br-→2H2O +Br2 D、H2O2分解反应前后溶液中Br2的质量不变二、工业流程
-
21. 以粉煤灰(主要成分:Al2O3、SiO2、少量Fe2O3)为原料,制取Al2O3的部分工艺流程如下:

完成下列填空:
(1)、铝原子核外有种不同能量的电子,最外层电子的轨道式是 , 上述流程涉及第二周期元素的原子半径由小到大的顺序是。(2)、“除铁”是将Fe3+转化为Fe(OH)3沉淀,反应的离子方程式为 , 检验溶液中Fe3+是否除尽的方法是。(3)、解释“结晶”过程中向AlCl3浓溶液中通入HCl气体的原因。(4)、上述流程可循环的物质是。(5)、工业上将Al2O3溶解在熔化的冰晶石中电解获得铝,该反应的化学方程式为。三、综合题
-
22. 已知2SO2(g)+O2(g)
 2SO3(g),如图为不同温度(T1、T2)下SO2的转化率随时间的变化曲线。
2SO3(g),如图为不同温度(T1、T2)下SO2的转化率随时间的变化曲线。 
完成下列填空:
(1)、T1(选填“>”“<”或“=”)T2 , 判断依据是;该反应为(选填“放”或“吸”)热反应,判断依据是。(2)、下表为一定温度和压强下,4种投料比[n(SO2):n(O2)]分别为2:18、4:15、7:11和8:10时SO2的平衡转化率。投料比
①
②
③
④
SO2平衡转化率/%
97.1
96.8
95.8
90.0
②对应的投料比为。投料比为8:10时,平衡混合气体中SO3体积分数为。
(3)、在相同温度下:2NO(g)+O2(g) 2NO2(g) K1=a;NO2(g)+SO2(g) SO3(g)+NO(g) K2=b;则2SO2(g)+O2(g) 2SO3(g) 的平衡常数K=(用a、b表示)。(4)、钠碱循环法吸收硫酸厂尾气中的SO2并将其转化为硫酸的工艺如下:
吸收池中发生反应的离子方程式是;NaHSO3溶液呈弱酸性,NaHSO3溶液中离子浓度由大到小排序为。
四、推断题
-
23. 可卡醛是一种食用香料,其一种合成方法如下:

完成下列填空:
(1)、实验室制取A的化学方程式是。(2)、在一定条件下,环氧乙烷( )可以开环与氢气、水等试剂发生类似加成反应的反应,它与氢气反应的产物是 , 写出它与水反应的化学方程式。 (3)、C→D的反应条件是;写出含有四种不同化学环境氢原子,且与D同类别的同分异构体的结构简式。(4)、E→可卡醛的反应类型是。(5)、设计一条由石油裂解气乙烯、丙烯合成
)可以开环与氢气、水等试剂发生类似加成反应的反应,它与氢气反应的产物是 , 写出它与水反应的化学方程式。 (3)、C→D的反应条件是;写出含有四种不同化学环境氢原子,且与D同类别的同分异构体的结构简式。(4)、E→可卡醛的反应类型是。(5)、设计一条由石油裂解气乙烯、丙烯合成 的流程。(合成路线常用的表示方式为:A
的流程。(合成路线常用的表示方式为:A  B……
B……  目标产物)
目标产物) 五、实验题
-
24. NaClO2是一种高效的杀菌消毒剂,也常用来漂白织物等。用下列装置探究NaClO2的制备。

完成下列填空:
(1)、仪器a的名称为 , 装置②的作用是。(2)、检查装置气密性的方法是。(3)、关闭K1 , 从分液漏斗中加入一定量浓硫酸,装置③中生成NaClO2的化学方程式为2ClO2+2NaOH+H2O2→2NaClO2+2H2O+O2↑,该反应的氧化产物是。(4)、实验完成后,为防止装置中残留的有毒气体污染空气,可以进行的操作是:打开止水夹K1 , 。(5)、从装置③的溶液中获得NaClO2晶体的主要操作有减压蒸发浓缩、、过滤洗涤、干燥等。(6)、晶体以NaClO2·3H2O的形式存在,已知:NaClO2·3H2O NaCl+O2↑+3H2O↑。为测定所得固体中NaClO2·3H2O的质量分数,在收集到足量的晶体后,进行如下实验:取样品质量为a g,灼烧恒重后,得到固体b g。则晶体中NaClO2·3H2O的质量分数是。若发生副反应4[NaClO2·3H2O] 2NaCl+2NaClO3+O2↑+12H2O↑,则实验测得的值会。(选填“偏大”、“偏小”或“不变”)
-
-
-