上海市虹口区2020年高考化学二模试卷
试卷更新日期:2020-06-23 类型:高考模拟
一、单选题
-
1. 在预防新冠肺炎中,化学消毒剂发挥了重要作用,以下不是利用氧化性来消毒的是( )A、84消毒液 B、75%酒精 C、臭氧 D、H2O22. 下列化学用语书写正确的是( )A、N2的电子式:
 B、氯乙烯的结构式:CH2=CHCl
C、CCl4的比例模型:
B、氯乙烯的结构式:CH2=CHCl
C、CCl4的比例模型:  D、原子核内有10个中子的氧原子:
3. 能用共价键键能大小解释的是( )A、熔点:I2>Cl2 B、熔点:NaCl>NaI C、沸点:HI>HCl D、热稳定性:HCl>HI4. 某晶体中含有非极性共价键,关于该晶体的说法错误的是( )A、可能是化合物 B、不可能是离子晶体 C、可能是分子晶体 D、可能有很高的熔沸点5. 第三周期的三种元素甲、乙、丙,原子序数依次增大,且原子核外都有1个未成对电子,下列说法错误的是( )A、金属性:甲>乙>丙 B、三种元素的单质都能与水反应 C、离子半径:甲>乙>丙 D、最高价氧化物对应水化物可两两相互反应6. 不能用铝热法制备的金属是()A、镁 B、铁 C、铬 D、锰7. 室温时,两个容积相同的烧瓶中分别盛有下面两种气体(同温同压),打开弹簧夹K,使两烧瓶内的气体充分混合后,容器内的压强最小的是( )
D、原子核内有10个中子的氧原子:
3. 能用共价键键能大小解释的是( )A、熔点:I2>Cl2 B、熔点:NaCl>NaI C、沸点:HI>HCl D、热稳定性:HCl>HI4. 某晶体中含有非极性共价键,关于该晶体的说法错误的是( )A、可能是化合物 B、不可能是离子晶体 C、可能是分子晶体 D、可能有很高的熔沸点5. 第三周期的三种元素甲、乙、丙,原子序数依次增大,且原子核外都有1个未成对电子,下列说法错误的是( )A、金属性:甲>乙>丙 B、三种元素的单质都能与水反应 C、离子半径:甲>乙>丙 D、最高价氧化物对应水化物可两两相互反应6. 不能用铝热法制备的金属是()A、镁 B、铁 C、铬 D、锰7. 室温时,两个容积相同的烧瓶中分别盛有下面两种气体(同温同压),打开弹簧夹K,使两烧瓶内的气体充分混合后,容器内的压强最小的是( ) A、H2S和 SO2 B、NH3和HCl C、H2和Cl2 D、NO和 O28. 下列物质的工业生产过程中,不涉及勒夏特列原理的是( )A、合成氨 B、制硫酸 C、制氯化氢 D、制纯碱9. 在下图的实验装置中,从实验开始过一段时间,对看到的现象叙述错误的是( )A、
A、H2S和 SO2 B、NH3和HCl C、H2和Cl2 D、NO和 O28. 下列物质的工业生产过程中,不涉及勒夏特列原理的是( )A、合成氨 B、制硫酸 C、制氯化氢 D、制纯碱9. 在下图的实验装置中,从实验开始过一段时间,对看到的现象叙述错误的是( )A、 苹果块会干瘪
B、
苹果块会干瘪
B、 胆矾晶体表面有“白斑”
C、
胆矾晶体表面有“白斑”
C、 小试管内有晶体析出
D、
小试管内有晶体析出
D、 pH试纸变红
10. 已知黑火药爆炸的反应:S+2KNO3+3C → K2S+3CO2+ N2↑,下列说法正确的是( )A、该反应中氧化剂只有硝酸钾 B、该反应中还原剂只有碳 C、每生成0.1 mol N2转移电子1 mol D、产物中有两种共价化合物11. 除去下列物质中少量杂质(括号内的物质为杂质)采用的方法中,正确的是( )A、己烷(己烯):溴水,分液 B、FeCl3溶液(AlCl3):过量氨水,过滤 C、乙醛(乙酸):NaOH溶液,分液 D、乙酸乙酯(乙酸):饱和碳酸钠溶液,分液12. 茉莉醛具有浓郁的茉莉花香,结构简式如图所示。下列关于茉莉醛的叙述正确的是( )
pH试纸变红
10. 已知黑火药爆炸的反应:S+2KNO3+3C → K2S+3CO2+ N2↑,下列说法正确的是( )A、该反应中氧化剂只有硝酸钾 B、该反应中还原剂只有碳 C、每生成0.1 mol N2转移电子1 mol D、产物中有两种共价化合物11. 除去下列物质中少量杂质(括号内的物质为杂质)采用的方法中,正确的是( )A、己烷(己烯):溴水,分液 B、FeCl3溶液(AlCl3):过量氨水,过滤 C、乙醛(乙酸):NaOH溶液,分液 D、乙酸乙酯(乙酸):饱和碳酸钠溶液,分液12. 茉莉醛具有浓郁的茉莉花香,结构简式如图所示。下列关于茉莉醛的叙述正确的是( ) A、茉莉醛与苯甲醛互为同系物 B、茉莉醛分子式为C14H20O C、茉莉醛能使溴水褪色,并只发生加成反应 D、在一定条件下,1mol茉莉醛最多能与5 mol氢气加成13. 某溶液含有Ba2+、Fe2+、Cl-、NO3-等离子,向其中加入足量的稀硫酸后,溶液中离子的物质的量几乎不变的是( )A、Ba2+ B、Fe2+ C、Cl- D、NO3-14. 下列关于实验室制备乙酸乙酯和乙酸丁酯的描述中,正确的是( )A、均采用水浴加热 B、制备乙酸乙酯时乙醇过量 C、均采用边反应边蒸馏的方法 D、制备乙酸丁酯时正丁醇过量15. 下列关于饱和食盐水的用途或装置设计错误的是( )A、
A、茉莉醛与苯甲醛互为同系物 B、茉莉醛分子式为C14H20O C、茉莉醛能使溴水褪色,并只发生加成反应 D、在一定条件下,1mol茉莉醛最多能与5 mol氢气加成13. 某溶液含有Ba2+、Fe2+、Cl-、NO3-等离子,向其中加入足量的稀硫酸后,溶液中离子的物质的量几乎不变的是( )A、Ba2+ B、Fe2+ C、Cl- D、NO3-14. 下列关于实验室制备乙酸乙酯和乙酸丁酯的描述中,正确的是( )A、均采用水浴加热 B、制备乙酸乙酯时乙醇过量 C、均采用边反应边蒸馏的方法 D、制备乙酸丁酯时正丁醇过量15. 下列关于饱和食盐水的用途或装置设计错误的是( )A、 模拟工业制纯碱
B、
模拟工业制纯碱
B、 甲烷的取代反应
C、
甲烷的取代反应
C、 实验室制乙炔
D、
实验室制乙炔
D、 除去氯气中的氯化氢
16. 下列反应可用离子方程式 2H+ + CO32- → H2O + CO2↑表示的是( )A、向Na2CO3溶液中滴加过量醋酸 B、向硫酸中滴加少量Na2CO3溶液 C、向Na2CO3溶液中滴加少量稀盐酸 D、向Na2CO3溶液中通入SO2气体17. 下列有关电化学装置不能达到相应实验目的的是( )A、
除去氯气中的氯化氢
16. 下列反应可用离子方程式 2H+ + CO32- → H2O + CO2↑表示的是( )A、向Na2CO3溶液中滴加过量醋酸 B、向硫酸中滴加少量Na2CO3溶液 C、向Na2CO3溶液中滴加少量稀盐酸 D、向Na2CO3溶液中通入SO2气体17. 下列有关电化学装置不能达到相应实验目的的是( )A、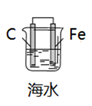 模拟吸氧腐蚀
B、
模拟吸氧腐蚀
B、 电解法制氯气
C、
电解法制氯气
C、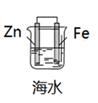 铁的防护
D、
铁的防护
D、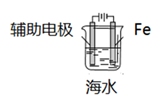 外加电流的阴极保护法
18. 常温下,下列溶液中水的电离程度最大的是( )A、pH=0的硫酸 B、0.01mol/L NaOH溶液 C、pH=10的纯碱溶液 D、pH=5的氯化铵溶液19. 体积相同的盐酸和醋酸溶液,c(Cl-) = c(CH3COO-)= 0.01 mol/L,下列说法正确的是( )A、pH:醋酸>盐酸 B、完全反应消耗NaOH的量:醋酸>盐酸 C、与相同的Na2CO3粉末反应的起始速率:醋酸<盐酸 D、分别用水稀释相同倍数后,所得溶液中:c (Cl-) = c (CH3COO-)20. 下图是可逆反应A+2B 2C + 3D 的化学反应速率与化学平衡随外界条件改变而变化的情况,由此推断错误的是( )
外加电流的阴极保护法
18. 常温下,下列溶液中水的电离程度最大的是( )A、pH=0的硫酸 B、0.01mol/L NaOH溶液 C、pH=10的纯碱溶液 D、pH=5的氯化铵溶液19. 体积相同的盐酸和醋酸溶液,c(Cl-) = c(CH3COO-)= 0.01 mol/L,下列说法正确的是( )A、pH:醋酸>盐酸 B、完全反应消耗NaOH的量:醋酸>盐酸 C、与相同的Na2CO3粉末反应的起始速率:醋酸<盐酸 D、分别用水稀释相同倍数后,所得溶液中:c (Cl-) = c (CH3COO-)20. 下图是可逆反应A+2B 2C + 3D 的化学反应速率与化学平衡随外界条件改变而变化的情况,由此推断错误的是( ) A、A、B一定是气体 B、C可能是气体 C、D一定不是气体 D、正反应是放热反应
A、A、B一定是气体 B、C可能是气体 C、D一定不是气体 D、正反应是放热反应二、综合题
-
21. 二氧化氯(ClO2)是世界卫生组织(WHO)推荐的Al级广谱、安全、高效消毒剂。以下是ClO2的两种制备方法:
方法一:2NaClO3 + 4HCl → 2ClO2↑+ Cl2↑+ 2NaCl + 2H2O
方法二:H2C2O4 + 2NaClO3 + H2SO4 → Na2SO4 + 2CO2↑ + 2ClO2↑ + 2H2O
完成下列填空:
(1)、在方法一中,当有0.2 mol电子发生转移时,参与反应的还原剂为 mol。(2)、在方法二中,反应物H2C2O4(填序号)。a.仅做氧化剂 b.既被氧化又被还原
c.发生氧化反应 d.既未被氧化也未被还原
(3)、两种方法相比,(填写“方法一”或“方法二”)制备的ClO2更适合用于饮用水的消毒,其主要原因是。(4)、实验室也可用氯酸钠(NaClO3)和亚硫酸钠(Na2SO3)用硫酸酸化,加热制备二氧化氯,其化学反应方程式为 。(5)、氯原子核外共有种不同运动状态的电子,氯离子的最外层电子排布式是。(6)、CCl4分子的空间构型为 , CO2的电子式是。(7)、相同压强下,部分元素氯化物的熔点见表:氯化物
NaCl
KCl
CCl4
熔点/℃
804
773
-22.92
试解释表中氯化物熔点差异的原因:。
22. 氮及其化合物在工农业生产、生活中有着重要作用。完成下列填空:合成氨工业中:N2(g) + 3H2(g) 2NH3(g) + Q(Q>0),其化学平衡常数K与温度t的关系如表:
t/℃
200
300
400
K
K1
K2
0.5
(1)、试比较K1、K2的大小,K1 K2(填写“>”、“=”或“<”)(2)、400℃时,反应2NH3(g) N2(g) + 3H2(g)的化学平衡常数的值为。当测得NH3和N2、H2的物质的量浓度分别为3 mol/L和2 mol/L、1 mol/L时,则该反应υ(N2)(正) υ(N2)(逆)(填写“>”、“=”或“<”)
(3)、在密闭恒容的容器中,下列能作为合成氨反应达到平衡的依据的是。a.υ(N2)(正)=3υ (H2)(逆) b.混合气体的密度保持不变
c.容器内压强保持不变 d.N2、H2、NH3的浓度之比为1∶3∶2
(4)、化工生产为做到又“快”又“多”采用多种方法,试写出两项合成氨工业中为实现“多”所采取的措施: , 。(5)、0.1 mol/L的(NH4)2SO4水溶液中各离子浓度由大到小的顺序是 , 在该溶液中加入少量明矾固体,溶液中NH4+的浓度(填“增大”、“减小”或“不变”),其原因是。 (6)、如图是1 mol NO2和1 mol CO反应生成CO2和NO过程中能量变化示意图,请写出NO2和 CO反应的热化学方程式 。23. 奶油中含有一种化合物A,可用作香料。在空气中长时间搅拌奶油,A可转化为化合物B。A发生的一系列化学反应如下:
(6)、如图是1 mol NO2和1 mol CO反应生成CO2和NO过程中能量变化示意图,请写出NO2和 CO反应的热化学方程式 。23. 奶油中含有一种化合物A,可用作香料。在空气中长时间搅拌奶油,A可转化为化合物B。A发生的一系列化学反应如下:
完成下列填空:
(1)、写出反应类型:反应 ①反应 ②(2)、写出反应③所需的试剂与条件:(3)、写出结构简式:F(4)、写出一种满足下列要求的A的同分异构体的结构简式:i.含有酯基 ii.能发生银镜反应
(5)、写出C→D反应的化学方程式:(6)、C也能与乙二酸反应形成环状化合物(C6H8O4),写出该环状化合物的结构简式:(7)、写出以C为原料合成1,4-丁二醇( )的合成路线。(合成路线常用的表示方式为:
)的合成路线。(合成路线常用的表示方式为: 
 )
) 三、工业流程
-
24. 氯化钙可用于生产补钙、抗过敏和消炎等药物。以工业碳酸钙(含有少量Al3+、Fe3+等杂质)生产医药级二水合氯化钙(CaCl2·2H2O)的主要流程如下:
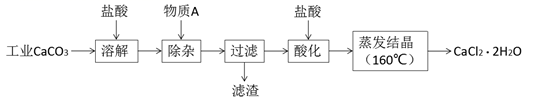
完成下列填空:
(1)、除杂操作是加入物质A来调节溶液的pH,以除去溶液中的Al3+、Fe3+ , 根据下表所给信息,此时控制溶液的pH范围是 , 加入的物质A是(写化学式)。开始沉淀时的pH
沉淀完全时的pH
沉淀开始溶解时的pH
Al(OH)3
3.3
5.2
7.8
Fe(OH)3
1.5
4.1
-
(2)、检验Fe3+是否沉淀完全的实验操作是。(3)、酸化操作是加入盐酸,调节溶液的pH,其目的是。(4)、测定制得的样品的纯度,可采用如下方案:a.称取0.750 g样品,溶解,在250 mL容量瓶中定容;
b.量取25.00 mL待测溶液于锥形瓶中;
c.用0.050 mol/L AgNO3溶液滴定至终点,消耗AgNO3溶液体积的平均值为20.39 mL。
①上述测定过程中,需要用到的玻璃仪器除了容量瓶、锥形瓶,还有。
②计算上述样品中CaCl2·2H2O的质量分数为(保留三位有效数字)。
③若配制和滴定操作均无误,但最终测定的样品中CaCl2·2H2O的质量分数偏高,写出可能导致该结果的一种情况。