上海市奉贤区2020年高考化学二模试卷
试卷更新日期:2020-06-23 类型:高考模拟
一、单选题
-
1. 化学与生活密切相关,下列过程不属于化学反应的是( )
A
B
C
D




酸性重铬酸钾用于检测酒精
铝粉与强碱溶液反应放热
植物油在空气中变质,产生“哈喇”味
海水经风吹日晒获得粗盐
A、A B、B C、C D、D2. 属于人工固氮作用的是( )A、工业合成氨 B、硝酸工厂用NH3氧化制NO C、雷雨时空气中的N2转化为NO D、由NH3制碳铵(NH4HCO3)3. 通过下列反应不可能一步生成MgO的是( )A、化合反应 B、复分解反应 C、分解反应 D、置换反应4. 下列属于碱性氧化物的是( )A、Mn2O7 B、Al2O3 C、Na2O2 D、CaO5. 下列有关化学用语使用错误的是( )A、比例模型 ,可以表示CO2
B、离子结构示意图
,可以表示CO2
B、离子结构示意图  既可以表示35Cl- , 也可以表示37Cl-
C、HClO的结构式:H-O-Cl
D、T原子可以表示为:
6. 可用于检验久置的FeSO4溶液是否变质的试剂( )A、过氧化钠 B、铁粉 C、盐酸 D、KSCN溶液7. 有关化学资源的合成、利用与开发的叙述错误的是( )A、通过有机物的合成,可以制造出比钢铁更强韧的新型材料 B、开发利用可燃冰(固态甲烷水合物),有助于海洋生态环境的治理 C、大量使用化肥和农药,可以提高农作物产量,但对环境和土壤有负面影响 D、安装煤炭燃烧过程的“固硫”装置,主要是为了脱硫,防止废气污染环境8. 某无色溶液中含Na+、I-、NO3-、Cl- , 加入下列哪种溶液不会使其变色( )A、淀粉溶液 B、硫酸氢钠溶液 C、H2O2溶液 D、氯水9. 我国研发一款拥有自主知识产权的超薄铷(Rb)原子钟,每3000万年误差仅1秒。Rb是第五周期第ⅠA族元素,下列关于37Rb的说法正确的是( )A、自然界有游离态銣元素存在 B、与同周期元素53I的原子半径比较:Rb>I C、元素的金属性:K>Rb D、最高价氧化物对应的水化物的碱性:KOH>RbOH10. 在生活中 Na2CO3和NaHCO3都可作食用碱。下列对其性质的描述用化学方程式或离子方程式表示正确的是( )A、NaHCO3可作发酵粉:2NaHCO3 Na2CO3 + CO2↑ + H2O B、饱和Na2CO3溶液中通入CO2: CO32- +CO2+ H2O → HCO3- C、Na2CO3溶液呈碱性:CO32-+ 2H2O → H2CO3+ 2OH- D、饱和Na2CO3溶液除去CH3COOC2H5中的CH3COOH:CO32- +2H+ →CO2↑ + H2O11. 下列实验室制备物质装置图正确的是( )A、
既可以表示35Cl- , 也可以表示37Cl-
C、HClO的结构式:H-O-Cl
D、T原子可以表示为:
6. 可用于检验久置的FeSO4溶液是否变质的试剂( )A、过氧化钠 B、铁粉 C、盐酸 D、KSCN溶液7. 有关化学资源的合成、利用与开发的叙述错误的是( )A、通过有机物的合成,可以制造出比钢铁更强韧的新型材料 B、开发利用可燃冰(固态甲烷水合物),有助于海洋生态环境的治理 C、大量使用化肥和农药,可以提高农作物产量,但对环境和土壤有负面影响 D、安装煤炭燃烧过程的“固硫”装置,主要是为了脱硫,防止废气污染环境8. 某无色溶液中含Na+、I-、NO3-、Cl- , 加入下列哪种溶液不会使其变色( )A、淀粉溶液 B、硫酸氢钠溶液 C、H2O2溶液 D、氯水9. 我国研发一款拥有自主知识产权的超薄铷(Rb)原子钟,每3000万年误差仅1秒。Rb是第五周期第ⅠA族元素,下列关于37Rb的说法正确的是( )A、自然界有游离态銣元素存在 B、与同周期元素53I的原子半径比较:Rb>I C、元素的金属性:K>Rb D、最高价氧化物对应的水化物的碱性:KOH>RbOH10. 在生活中 Na2CO3和NaHCO3都可作食用碱。下列对其性质的描述用化学方程式或离子方程式表示正确的是( )A、NaHCO3可作发酵粉:2NaHCO3 Na2CO3 + CO2↑ + H2O B、饱和Na2CO3溶液中通入CO2: CO32- +CO2+ H2O → HCO3- C、Na2CO3溶液呈碱性:CO32-+ 2H2O → H2CO3+ 2OH- D、饱和Na2CO3溶液除去CH3COOC2H5中的CH3COOH:CO32- +2H+ →CO2↑ + H2O11. 下列实验室制备物质装置图正确的是( )A、 制备及收集乙烯
B、
制备及收集乙烯
B、 制备乙酸乙酯
C、
制备乙酸乙酯
C、 制备硝基苯
D、
制备硝基苯
D、 制备乙炔
12. 镁、铝、铜三种金属混合物粉末,加入过量盐酸充分反应过滤后,向滤液中加入过量烧碱溶液,再过滤,滤液中(除Na+、Cl-外)存在大量离子有( )A、Mg2+ B、Cu2+ C、Al3+ D、AlO2-13. 实验室用标准盐酸滴定氢氧化钠溶液,下列情况不影响测定结果的是( )A、洗净的锥形瓶,再用碱液润洗 B、酸式滴定管洗净后,直接注入标准盐酸 C、在放碱液时,锥形瓶中留有少量蒸馏水 D、滴定至终点时,在滴定管尖嘴部位有气泡14. 痛风病与关节滑液中形成的尿酸钠(NaUr)有关(NaUr增多,病情加重),其化学原理为: HUr(aq)+ Na+(aq) NaUr(s) + H+(aq) +Q (Q>0),下列说法错误的是( )A、寒冷季节更易诱发关节疼痛 B、饮食中摄入过多食盐,会加重痛风病病情 C、大量饮水会增大痛风病发作的可能性 D、患痛风病的人应少吃能代谢产生更多尿酸钠的食物15. 有机物甲、乙的碳架结构如图所示,下列说法错误的是( )
制备乙炔
12. 镁、铝、铜三种金属混合物粉末,加入过量盐酸充分反应过滤后,向滤液中加入过量烧碱溶液,再过滤,滤液中(除Na+、Cl-外)存在大量离子有( )A、Mg2+ B、Cu2+ C、Al3+ D、AlO2-13. 实验室用标准盐酸滴定氢氧化钠溶液,下列情况不影响测定结果的是( )A、洗净的锥形瓶,再用碱液润洗 B、酸式滴定管洗净后,直接注入标准盐酸 C、在放碱液时,锥形瓶中留有少量蒸馏水 D、滴定至终点时,在滴定管尖嘴部位有气泡14. 痛风病与关节滑液中形成的尿酸钠(NaUr)有关(NaUr增多,病情加重),其化学原理为: HUr(aq)+ Na+(aq) NaUr(s) + H+(aq) +Q (Q>0),下列说法错误的是( )A、寒冷季节更易诱发关节疼痛 B、饮食中摄入过多食盐,会加重痛风病病情 C、大量饮水会增大痛风病发作的可能性 D、患痛风病的人应少吃能代谢产生更多尿酸钠的食物15. 有机物甲、乙的碳架结构如图所示,下列说法错误的是( ) A、甲的一种同分异构体能发生银镜反应 B、甲、乙互为同分异构体 C、甲、乙都能发生取代、加成和水解反应 D、等物质的量的甲和乙与足量的NaOH溶液反应,消耗NaOH的物质的量相等16. 用NaOH溶液清洗试管壁上的硫,发生反应S + NaOH—Na2SO3 + Na2S + H2O(未配平),下列说法错误的是( )A、清洗之后的废液一定呈碱性 B、也可以用CS2清洗试管壁上的硫 C、生成的Na2SO3 和Na2S的物质的量之比为1 : 2 D、氧化产物是Na2S17. 石灰石是一种化工原料,可以通过反应生成一系列物质,如图:
A、甲的一种同分异构体能发生银镜反应 B、甲、乙互为同分异构体 C、甲、乙都能发生取代、加成和水解反应 D、等物质的量的甲和乙与足量的NaOH溶液反应,消耗NaOH的物质的量相等16. 用NaOH溶液清洗试管壁上的硫,发生反应S + NaOH—Na2SO3 + Na2S + H2O(未配平),下列说法错误的是( )A、清洗之后的废液一定呈碱性 B、也可以用CS2清洗试管壁上的硫 C、生成的Na2SO3 和Na2S的物质的量之比为1 : 2 D、氧化产物是Na2S17. 石灰石是一种化工原料,可以通过反应生成一系列物质,如图:
下列说法正确的是( )
A、漂粉精是混合物,有效成分是氯化钙 B、图示的制纯碱方法,要求先向饱和食盐水中通NH3 , 然后再通CO2 C、工业制漂粉精通常用氯气通入澄清石灰水中 D、制取纯碱和漂粉精所涉及的反应都是非氧化还原反应18. 图为氯碱工业的简易装置示意图,其中两电极均为惰性电极,下列说法正确的是( )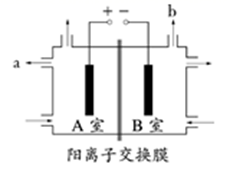 A、粗盐水中含有的少量Ca2+和Mg2+可用NaOH除去 B、阳离子交换膜允许Na+通过,而阻挡了Cl2进入B室 C、a处得到的是浓NaOH溶液 D、饱和食盐水从B室底部加入19. 研究表明N2O与CO在Fe+作用下发生反应的能量变化及反应历程如图所示,下列说法错误的是( )
A、粗盐水中含有的少量Ca2+和Mg2+可用NaOH除去 B、阳离子交换膜允许Na+通过,而阻挡了Cl2进入B室 C、a处得到的是浓NaOH溶液 D、饱和食盐水从B室底部加入19. 研究表明N2O与CO在Fe+作用下发生反应的能量变化及反应历程如图所示,下列说法错误的是( ) A、反应总过程是放热的 B、Fe+作为催化剂改变了反应途径,提高了反应速率 C、Fe++N2O→FeO++N2、FeO++CO→Fe++CO2 两步反应均为放热反应 D、若反应在恒容密闭容器中进行,温度越高,反应速率一定越快20. 下列酸碱溶液恰好完全中和,如图所示,则下列叙述正确的是( )
A、反应总过程是放热的 B、Fe+作为催化剂改变了反应途径,提高了反应速率 C、Fe++N2O→FeO++N2、FeO++CO→Fe++CO2 两步反应均为放热反应 D、若反应在恒容密闭容器中进行,温度越高,反应速率一定越快20. 下列酸碱溶液恰好完全中和,如图所示,则下列叙述正确的是( ) A、因为两种酸溶液的pH相等,故V1一定等于V2 B、若V1>V2 , 则说明HA为强酸,HB为弱酸 C、若实验①中,V=V1 , 则混合液中c(Na+)=c(A-) D、实验②的混合溶液,可能溶液呈酸性
A、因为两种酸溶液的pH相等,故V1一定等于V2 B、若V1>V2 , 则说明HA为强酸,HB为弱酸 C、若实验①中,V=V1 , 则混合液中c(Na+)=c(A-) D、实验②的混合溶液,可能溶液呈酸性二、综合题
-
21. 不锈钢是由铁、铬(Cr)、镍(Ni)、碳、硅及众多不同元素组成的合金。完成下列填空:(1)、写出碳原子最外层电子的轨道表示式 , 其最外层有种不同运动状态的电子。(2)、硅烷(SiH4)可用于制备高纯硅,已知硅烷的分解温度远低于甲烷,从原子结构角度解释其原因:。(3)、下面是工业上冶炼Cr时涉及到的反应:
①请将方程式补充完整并配平。
CrO42-+ S+ H2O→ Cr(OH)3↓+ S2O32-+
②上述反应中,若转移了3mol电子,得到的还原产物是mol。
③Cr(OH)3和Al(OH)3类似,也是两性氢氧化物,写出Cr(OH)3的电离方程式。
(4)、镍粉在CO中低温加热,生成无色挥发性液态Ni(CO)4 , 呈四面体构型。Ni(CO)4是晶体,Ni(CO)4易溶于下列(填序号)。a.水 b.四氯化碳 c.苯 d.硫酸镍溶液
22. 工业上可用O2将HCl转化为Cl2 , 反应为:O2(g)+4HCl(g) 2Cl2(g)+2H2O(g)。请完成下列填空:(1)、该反应化学平衡常数K的表达式为;实验测得P0压强下,HCl平衡转化率α(HCl)随反应温度T的变化如图所示,则正反应是反应(填“吸热”或者“放热”)。 (2)、写出一种能提高HCl转化率的方法。(3)、上述实验中若压缩体积使压强由P0增大至P1 , 在图中画出P1压强下HCl平衡转化率α(HCl)随反应温度T变化的曲线 , 并简要说明理由:。(4)、根据图中信息所示,在P0、320℃条件下进行,达平衡状态A时,测得容器内n(Cl2)=7.2×10–3mol,则此时容器中n(HCl)=mol。(5)、氯元素能组成多种化合物,如常见的铵态氮肥,氯化铵溶液呈性,其原因用离子方程式表示:。现有一瓶氯化铵、氯化钠和氨水的混合液,经测定溶液呈中性,此时三种离子的关系是:[Na+]+[NH4+][Cl-](填“>”“<”或“=”)。23. α-苯基丙烯酸可用于合成人造龙涎香,现以甲苯为原料,按下列方法合成(从F开始有两条合成路线)
(2)、写出一种能提高HCl转化率的方法。(3)、上述实验中若压缩体积使压强由P0增大至P1 , 在图中画出P1压强下HCl平衡转化率α(HCl)随反应温度T变化的曲线 , 并简要说明理由:。(4)、根据图中信息所示,在P0、320℃条件下进行,达平衡状态A时,测得容器内n(Cl2)=7.2×10–3mol,则此时容器中n(HCl)=mol。(5)、氯元素能组成多种化合物,如常见的铵态氮肥,氯化铵溶液呈性,其原因用离子方程式表示:。现有一瓶氯化铵、氯化钠和氨水的混合液,经测定溶液呈中性,此时三种离子的关系是:[Na+]+[NH4+][Cl-](填“>”“<”或“=”)。23. α-苯基丙烯酸可用于合成人造龙涎香,现以甲苯为原料,按下列方法合成(从F开始有两条合成路线)
已知:①CH3CH2Br+NaCN
 CH3CH2CN+NaBr
CH3CH2CN+NaBr②CH3CH2CN
 CH3CH2COOH
CH3CH2COOH 完成下列填空:
(1)、写出反应④的反应类型是反应;写出反应①所需试剂与条件是 。(2)、写出C的结构简式:。(3)、写出一种符合下列条件的F的同分异构体。①氧原子不与苯环直接相连;②能发生银镜反应;③1mol该物质与足量钠反应产生1mol氢气;④有5种不同氢原子。
(4)、检验E是否完全转化为F的方法是。(5)、路线二与路线一相比不太理想,理由是。(6)、利用已知条件,设计一条由 制备
制备  的合成路线。
的合成路线。 (合成路线的表示方法为
 )
)三、实验题
-
24. 氢气、氯气是中学实验室常见气体,在实验室可以利用该反应2KMnO4+16HCl(浓)→2KCl+2MnCl2+5Cl2↑+8H2O,制备Cl2 , 并在实验室模拟工业制备盐酸,请回答下列问题:(1)、甲组同学用下列装置制取H2和Cl2。

①实验室常用NaCl+H2SO4(浓)→NaHSO4+HCl↑反应制备HCl气体,该反应利用了浓硫酸的性。
②用工业级锌粒(主要成分 Zn,含少量 FeS、Pb、Cu 等杂质)作原料,装置 I、Ⅱ均可以制取 H2 , 但装置 I 比装置Ⅱ更好,理由;检验氯气所用的试纸是。
(2)、乙组同学拟用甲组的装置 I、Ⅲ及下列装置(可以重复选用)模拟工业上制取盐酸。
①乙组中氢气的部分实验装置连接是a-f-g-d……,其中装置Ⅴ的作用是 , 制取氯气并模拟合成盐酸的实验装置的合理连接顺序(用玻璃接口表示)为 c-。
②装置VII中仪器 X 的名称是 ,合成 HCl时需控制H2的体积略大于Cl2的体积,其目的是 ;装置VII末端接抽气水泵的目的是。
(3)、设计实验证明HCl极易溶于水且水溶液呈酸性:。