重庆市北碚区2020年中考化学模拟试卷
试卷更新日期:2020-06-22 类型:中考模拟
一、单选题
-
1. 下列仪器中,均可直接在火焰上加热的是( )A、试管和蒸发皿 B、蒸发皿和集气瓶 C、集气瓶和量筒 D、烧杯和试管2. 下列说法正确的是( )A、酸能与所有的金属反应制得氢气 B、盐酸与某些不溶性的碱也能发生中和反应 C、皮肤上沾到酸可用NaOH溶液中和 D、NaOH固体可用于干燥任何气体3. 下列叙述正确的是( )A、分子在不停运动,原子不运动 B、原子的最外层电子数决定元素的种类 C、氯化钠是由钠离子和氯离子构成的化合物 D、保持二氧化碳化学性质的粒子是碳原子和氧原子4. 某干粉灭火器的填充剂中含有磷酸二氢铵(化学式为NH4H2PO4)。已知23.0g磷酸二氢铵加热完全分解得到固体物质X、5.4g水蒸气和3.4g氨气。固体物质x既不能燃燃烧也不能支持燃烧。下列说法错误的是()A、磷酸二氢铵属于复合肥料 B、用磷酸二氢铵灭火既可降低温度,又可隔绝空气 C、固体物质X属于氧化物 D、该反应中固体物质X与氨气的分子个数比为2:15. 逻辑推理是一种 重要的化学思维方法。以下推理合理的是( )A、氧化物含有氧元素,所以含有氧元素的物质都是氧化物 B、化学变化伴随有能量变化,所以有能量变化的过程一定是化学变化 C、燃烧需要同时满足三个条件,所以灭火也要同时控制这三个条件 D、化合物是由不同种元素组成的,所以由不同种元素组成的纯净物一定是化合物6. 小华采用加热氯酸钾的方法制取氧气,错把高锰酸钾当作二氧化锰放入氯酸钾内,其结果与只加氯酸钾相比,正确的是( )
A、反应速率不变,生成氧气的质量不变 B、反应速率加快,生成氧气的质量不变 C、反应速率加快,生成氧气的质量增加 D、高锰酸钾在反应中起催化剂的作用7. A~G都是初中化学常见物质,在高温或加热条件下可以发生如图所示的转化。已知:A是一种最常用的溶剂;常温下,C、D、F为气体,B、G为固体单质。
下列说法中错误的是( )
A、A~G中共有4种氧化物 B、E中含有氧元素,且氧元素的质量分数一定为20% C、反应①~④中只有2个反应属于置换反应 D、反应①中,B一定发生了氧化反应8. 将盛有等质量、等溶质质量分数的稀硫酸的两只烧杯,放在托盘天平左右两盘上,调节至平衡,再向两只烧杯中分别放入质量相等的铁和锌,待反应停止后,请判断,下列说法不合理的是( )A、放铁的一边产生的氢气一定比放锌的一边产生的氢气多 B、若天平仍保持平衡,烧杯中的铁一定有剩余 C、反应后两只烧杯中溶液的质量都比反应前的溶液质量增重了 D、若天平失去平衡,指针一定偏向放锌的一边9. 用化学知识判断下列说法,正确的有( )①氧化物中含有氧元素,所以含氧元素的物质一定是氧化物
②饱和溶液一定是浓溶液,不饱和溶液一定是稀溶液
③金刚石、石墨、C60的碳原子排列方式不同,所以它们的化学性质差异很大
④由金属离子和酸根离子构成的物质是盐,但盐中不一定含有金属元素
⑤原子核内一定含有质子,不一定含有中子,且质子数不一定等于中子数
A、1个 B、2个 C、3个 D、4个10. 如图所示的四个图象,能正确反映对应变化关系的是( )A、 B、
B、 C、
C、 D、
D、 向硫酸亚铁溶液中加入锌粉
11. 下图是某汽车尾气净化装置中发生反应的微观示意图。下列说法正确的是( )
向硫酸亚铁溶液中加入锌粉
11. 下图是某汽车尾气净化装置中发生反应的微观示意图。下列说法正确的是( ) A、参加反应的X与生成的Z的质量比为9:8 B、一个Y和W分子中均有10个电子 C、该反应中,Z是由Y分解生成的 D、化学反应前后,催化剂的质量和性质一定不变12. 如图是甲、乙、丙三种物质的溶解度曲线,下列叙述正确的是( )
A、参加反应的X与生成的Z的质量比为9:8 B、一个Y和W分子中均有10个电子 C、该反应中,Z是由Y分解生成的 D、化学反应前后,催化剂的质量和性质一定不变12. 如图是甲、乙、丙三种物质的溶解度曲线,下列叙述正确的是( )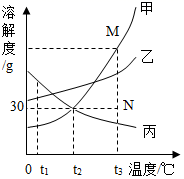 A、t1 ℃时,等质量的甲、丙溶液中所含溶质的质量分数为丙>甲 B、t2 ℃时,20 g丙溶解于50 g水中能形成70 g溶液 C、分别将三种物质的饱和溶液从t3 ℃降温至t2 ℃时,所得溶液溶质质量分数的大小关系为乙>甲=丙 D、若要将组成在N点的甲溶液转变为M点的甲溶液,可采取恒温蒸发溶剂的方法13. 只用下列鉴别方法不能把待鉴别的物质区分开的是( )
A、t1 ℃时,等质量的甲、丙溶液中所含溶质的质量分数为丙>甲 B、t2 ℃时,20 g丙溶解于50 g水中能形成70 g溶液 C、分别将三种物质的饱和溶液从t3 ℃降温至t2 ℃时,所得溶液溶质质量分数的大小关系为乙>甲=丙 D、若要将组成在N点的甲溶液转变为M点的甲溶液,可采取恒温蒸发溶剂的方法13. 只用下列鉴别方法不能把待鉴别的物质区分开的是( )选项
待鉴别的物质
鉴别方法
A
澄清石灰水和蒸馏水
肥皂水
B
二氧化锰和碳粉
看外观,颜色
C
水、过氧化氢溶液
加二氧化锰,观察能否产生气体
D
区别人呼出气体、氧气和空气
分别将燃着的木条伸入瓶中,观察现象
A、A B、B C、C D、D14. 我国科学家在水煤气变换中引入了高效催化体系,使该反应可在120℃时进行,反应过程如图所示。下列说法错误的是( ) A、反应过程中,每消耗1个甲分子,同时消耗1个乙分子 B、反应每消耗28g甲,可生成44g丙 C、反应前后分子的总数不变 D、该过程体现了催化剂吸附微粒的选择性15. 密闭容器中有氧气、X、水和二氧化碳4种物质,在一定条件下充分反应,测得反应前后各物质的质量如下表所示。下列说法正确的是( )
A、反应过程中,每消耗1个甲分子,同时消耗1个乙分子 B、反应每消耗28g甲,可生成44g丙 C、反应前后分子的总数不变 D、该过程体现了催化剂吸附微粒的选择性15. 密闭容器中有氧气、X、水和二氧化碳4种物质,在一定条件下充分反应,测得反应前后各物质的质量如下表所示。下列说法正确的是( )物质
X
反应前质量/g
76.0
16.0
4.0
3.0
反应后质量/g
待测
0
40.0
47.0
A、表中待测的值为5.0 B、X由碳、氢、氧三种元素组成 C、该反应中 与 的化学计量数之比为2:1 D、反应生成的 与 的质量比为40:4716. 下列图像能正确反映对应变化关系的是( )A
B
C
D




高温煅烧一定质量石灰石
向一定质量镁条中加入过量稀盐酸
向澄清石灰水中通入过量二氧化碳
加热氯酸钾和二氧化锰的混合物
A、A B、B C、C D、D二、填空题
-
17. 我们的生活离不开化学 现有①醋酸②硝酸钾③过磷酸钙④氯化钠⑤二氧化硫⑥烧碱⑦纯碱,选择适当的物质填空 填序号(1)、农业上用来选种的是;(2)、能除去铝壶中水垢的是;(3)、属于复合肥料的是;(4)、产生酸雨的主要物质是;(5)、广泛应用于肥皂、石油、造纸等工业的是 .18. 金属用途广泛,其结构和性质等是化学的重要研究内容。
 (1)、某化学小组用一定量AgNO3和Al(NO3)3混合溶液进行了如图实验,已知溶液甲呈蓝色,向固体乙上滴加盐酸时没有泡产生.
(1)、某化学小组用一定量AgNO3和Al(NO3)3混合溶液进行了如图实验,已知溶液甲呈蓝色,向固体乙上滴加盐酸时没有泡产生.①溶液甲中一定含有哪些溶质?(写化学式)
②请写出该实验过程中所发生反应的化学方程式 .
(2)、某工厂利用废铁屑与废硫酸起反应来制取硫酸亚铁.现有废硫酸(溶质质量分数为10%)49t,与足量废铁屑起反应,可生产硫酸亚铁的质量是 .三、选择填充题
-
19. KNO3与NH4Cl的溶解度曲线如图。下列说法正确的是

A.KNO3的溶解度比NH4Cl的大
B.t2℃时,两种溶液中的溶质质量相等
C.t3℃时,配制等质量的KNO3与NHCl的饱和溶液,需要水的质量NH4Cl>KNO3
D.两种物质的饱和溶液从t3℃降温到t1℃时,所得溶液的溶质质量分数大小关系是
四、实验题
-
20. 化学是一门以实验为基础的科学,下面是初中化学中几组重要的对比实验。
 (1)、实验1中,观察到A烧杯中的现象是 , 由此可验证分子的性质。(2)、实验2中,观察到铜片上的白磷燃烧而红磷不燃烧,可得出可燃物燃烧的一个条件为。(3)、实验3中,实验过程中布条能变红色的试剂瓶是 , C烧杯发生反应的化学方程式为。21.(1)、下图是可用来测定空气中氧气的体积分数的实验装置图。
(1)、实验1中,观察到A烧杯中的现象是 , 由此可验证分子的性质。(2)、实验2中,观察到铜片上的白磷燃烧而红磷不燃烧,可得出可燃物燃烧的一个条件为。(3)、实验3中,实验过程中布条能变红色的试剂瓶是 , C烧杯发生反应的化学方程式为。21.(1)、下图是可用来测定空气中氧气的体积分数的实验装置图。
实验步骤如下(装置气密性良好):
Ⅰ.打开止水夹a和b,鼓入一定量空气,当液面下降至燃烧匙以下,关闭a和b,测得进入量筒中水的体积为V1;
Ⅱ.强光照射引燃白磷;
Ⅲ.待白磷熄灭并冷却至室温后,打开b,最后读数测得量筒中水的体积变为V2;
Ⅳ.计算空气中氧气的体积分数。
①该反应的化学方程式为。
②步骤Ⅲ当中,观察到的现象为。
③实验中测得空气中氧气的体积分数为(用V1和V2表示)。
(2)、某反应的微观示意图如图所示:
①该反应所属的基本反应类型为。
②参加反应的乙物质和生成的丁物质的质量比为。
五、流程题
-
22. 自然界的矿物中有一种重晶石矿的主要成分是 ,它不溶于任何酸。碱和水,纯净的硫酸钡可供医疗等方面应用,某同学用重晶石和焦炭为原料,制取纯净硫酸钡,部分流程如下(设矿物中杂质不与焦炭反应,也不溶于水):
 (1)、步骤①的化学反应中,属于还原剂的是;(2)、步骤②中溶液A中溶质的化学式:;(3)、写出利用溶液A中的溶质为主要原料制取 的化学方程式:。(4)、步骤②产生有毒气体 ,应加以改进,为使实验既不产生 又能获得纯净 ,请你提出改进意见:。
(1)、步骤①的化学反应中,属于还原剂的是;(2)、步骤②中溶液A中溶质的化学式:;(3)、写出利用溶液A中的溶质为主要原料制取 的化学方程式:。(4)、步骤②产生有毒气体 ,应加以改进,为使实验既不产生 又能获得纯净 ,请你提出改进意见:。六、简答题
-
23. 甲、乙、丙三个试管分别注入同体积不同温度的水,分别放入相同质量的白磷(着火点为40℃),如下图所示:
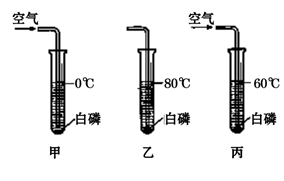
问:试管甲内白磷能否燃烧 , 其原因是。
试管乙内白磷能否燃烧 , 其原因是。
试管丙内白磷能否燃烧 , 其原因是。
七、科学探究题
-
24. 为验证空气中氧气的体积分数,小明按图甲所示的装置进行了多次实验,发现每次测得的氧气体积分数总是远小于21%.他认 为误差主要由实验装置造成,于是改用图乙装置进行实验,步骤如下:
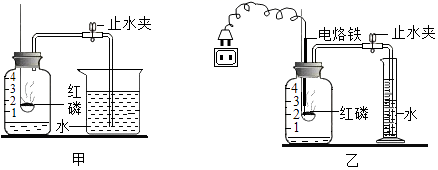
①连接装置并检査气密性.
②在量筒内加入100毫升的水.
③在广口瓶中加入少量水,使瓶内空气体积为250毫升.
④在燃烧匙内放入过量的红磷,塞紧瓶塞.关闭止水夹,接通电源使电烙铁发热,点燃红磷后,断开电源.
⑤燃烧结束并充分冷却后,打开止水夹,待量筒内水面不再下降时,记录量筒内水的体积为65毫升.
(1)、小明按图甲装置进行实验时,该如何检査装置的气密性?(2)、与装置甲相比,装置乙中使用电烙铁可以减小实误差,其原因是:(3)、根据本实验数据,计算出空气中氧气的体积分数为(4)、通过比较发现,小明的测量结果与真实值仍有差距,你认为引起本实验的误差还有什么因素?请你再探究一种因素即可 .
-
-
-