广东省广州市2020年高考理综-化学二模试卷
试卷更新日期:2020-06-17 类型:高考模拟
一、选择题
-
1. 化学与社会、生活、生产密切相关。对下列应用的解释错误的是( )
 A、A B、B C、C D、D2. 降冰片烯(
A、A B、B C、C D、D2. 降冰片烯( )在一定的条件下可以转化为降冰片烷(
)在一定的条件下可以转化为降冰片烷(  )。下列说法正确的是( ) A、降冰片烯不能使酸性高锰酸钾溶液褪色 B、降冰片烷易溶于水 C、降冰片烷与
)。下列说法正确的是( ) A、降冰片烯不能使酸性高锰酸钾溶液褪色 B、降冰片烷易溶于水 C、降冰片烷与 互为同分异构体
D、降冰片烷的一氯代物有3种(不含立体异构)
3. 实验室探究SO2性质的装置如图所示。下列说法错误的是( )
互为同分异构体
D、降冰片烷的一氯代物有3种(不含立体异构)
3. 实验室探究SO2性质的装置如图所示。下列说法错误的是( )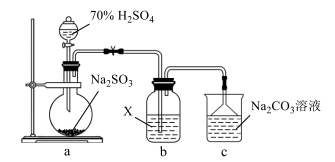 A、装置a中的反应可用铜片和浓硫酸代替 B、若X为H2S溶液,装置b中产生淡黄色沉淀 C、若X为含HCl、BaCl2的FeCl3溶液,装置b中产生白色沉淀 D、反应后装置c中溶液的pH降低4. NA是阿伏加德罗常数的值。下列说法正确的是( )A、1 mol K2Cr2O7被还原为Cr3+转移的电子数为3N B、0.1 mol CH4与Cl2在光照下反应生成的CH3Cl分子数为0.1 NA C、常温常压下,124 g P4中所含P-P键数目4 NA D、标准状况下,22.4 L丙烷中所含共价键数目为10 NA5. 一种化合物Y2ZW3X可用作牙膏的添加剂,W、X、Y、Z为原子序数依次增大的短周期主族元素,其中Z的最高价氧化物的水化物是三元酸,Y的原子半径是短周期主族元素中最大的,W与X的最外层电子数之和为13。下列说法错误的是( )A、简单氢化物的沸点:W>X B、离子半径:Y>W>X C、Z的最高价氧化物可用作干燥剂 D、Y与X形成的化合物的水溶液呈碱性6. 我国科学家研发了一种水系可逆Zn-CO2电池,将两组阴离子、阳离子复合膜反向放置分隔两室电解液,充电、放电时,复合膜层间的H2O解离成H+和OH- , 工作原理如图所示。下列说法错误的是( )
A、装置a中的反应可用铜片和浓硫酸代替 B、若X为H2S溶液,装置b中产生淡黄色沉淀 C、若X为含HCl、BaCl2的FeCl3溶液,装置b中产生白色沉淀 D、反应后装置c中溶液的pH降低4. NA是阿伏加德罗常数的值。下列说法正确的是( )A、1 mol K2Cr2O7被还原为Cr3+转移的电子数为3N B、0.1 mol CH4与Cl2在光照下反应生成的CH3Cl分子数为0.1 NA C、常温常压下,124 g P4中所含P-P键数目4 NA D、标准状况下,22.4 L丙烷中所含共价键数目为10 NA5. 一种化合物Y2ZW3X可用作牙膏的添加剂,W、X、Y、Z为原子序数依次增大的短周期主族元素,其中Z的最高价氧化物的水化物是三元酸,Y的原子半径是短周期主族元素中最大的,W与X的最外层电子数之和为13。下列说法错误的是( )A、简单氢化物的沸点:W>X B、离子半径:Y>W>X C、Z的最高价氧化物可用作干燥剂 D、Y与X形成的化合物的水溶液呈碱性6. 我国科学家研发了一种水系可逆Zn-CO2电池,将两组阴离子、阳离子复合膜反向放置分隔两室电解液,充电、放电时,复合膜层间的H2O解离成H+和OH- , 工作原理如图所示。下列说法错误的是( ) A、a膜是阳离子膜,b膜是阴离子膜 B、放电时负极的电极反应式为Zn+4OH−-2e− =Zn(OH)42− C、充电时CO2在多孔Pd纳米片表面转化为甲酸 D、外电路中每通过1 mol电子,复合膜层间有1 mol H2O解离7. 已知Ka(CH3COOH)=1.7×10−5 ,Kb(NH3·H2O)=1.7×10−5。常温下,用0.01mol·L−1氨水滴定20 mL浓度均为 0.01 mol·L−1的HCl和CH3COOH混合溶液,相对导电能力随加入氨水体积变化曲线如图所示。下列叙述错误的是( )
A、a膜是阳离子膜,b膜是阴离子膜 B、放电时负极的电极反应式为Zn+4OH−-2e− =Zn(OH)42− C、充电时CO2在多孔Pd纳米片表面转化为甲酸 D、外电路中每通过1 mol电子,复合膜层间有1 mol H2O解离7. 已知Ka(CH3COOH)=1.7×10−5 ,Kb(NH3·H2O)=1.7×10−5。常温下,用0.01mol·L−1氨水滴定20 mL浓度均为 0.01 mol·L−1的HCl和CH3COOH混合溶液,相对导电能力随加入氨水体积变化曲线如图所示。下列叙述错误的是( ) A、a点的混合溶液中c(CH3COO−)约为1.7×10−5mol·L−1 B、b点的混合溶液中:c(CH3COOH) >c(NH4+) C、c点的混合溶液中: D、混合溶液pH=7时,加入氨水体积大于40mL
A、a点的混合溶液中c(CH3COO−)约为1.7×10−5mol·L−1 B、b点的混合溶液中:c(CH3COOH) >c(NH4+) C、c点的混合溶液中: D、混合溶液pH=7时,加入氨水体积大于40mL二、非选择题:
-
8. 乙酸正丁酯是无色透明有果香气味的液体。实验室制备乙酸正丁酯的反应方程式如下:

制备流程和有关数据如下:


已知:乙酸正丁酯、正丁醇和水组成的三元共沸物的沸点为90.7℃。
反应装置如图所示。在烧瓶中加入反应物和沸石,分水器中加入一定体积水,80℃反应15分钟,然后提高温度使反应处于回流状态,分水器中液面不断上升,当液面达到分水器支管口时,上层液体返回到烧瓶中。

回答下列问题:
(1)、仪器甲的名称是。步骤①在80℃反应时温度计水银球置于(填“a”或“b”)处。(2)、使用分水器能提高酯的产率,原因是 (用平衡移动原理解释)。(3)、步骤②观察到 (填标号)现象时,酯化反应已基本完成。A、当分水器中出现分层 B、分水器中有液体回流至烧瓶 C、分水器水层高度不再变化 D、仪器甲有液体滴落(4)、若反应前分水器中加水不足,会导致 , 使产率偏低。(5)、步骤③操作a的名称是 。(6)、步骤④中,依次用10%Na2CO3溶液、水洗涤有机相,分出的产物加入少量无水MgSO4固体,蒸馏,得到乙酸正丁酯4.64g。加入10% Na2CO3溶液的目的是除去。乙酸正丁酯的产率为 %。9. 氧化钪(Sc2O3)是一种稀土氧化物,可用于制作激光、半导体材料。以钪锰矿石(主要含MnO2、SiO2及少量Sc2O3、Al2O3、CaO、FeO)为原料制备Sc2O3的工艺流程如下,其中TBP和P507均为有机萃取剂。
回答下列问题:
(1)、Sc2O3中Sc的化合价为 。(2)、“溶解”时铁屑被MnO 氧化为Fe3+ , 该反应的离子方程式是 。(3)、“滤渣”的主要成分是。(4)、“萃取除铁”时铁和钪的萃取率与O/A比(有机相与水相的体积比)的关系如图所示。该工艺中最佳O/A比为 。 (5)、有机萃取剂P507萃取Sc3+的反应原理为阳离子交换:ScCl3+3HR=ScR3+3HCl(HR代表P507)。在“富钪有机相”中反应生成Sc(OH)3的化学方程式是 。(6)、“萃余液2”中的金属阳离子除Al3+、Ca2+外,还有。(7)、Sc2(C2O4)3在空气中“煅烧”生成Sc2O3的化学方程式是 。(8)、某厂用1000 kg的钪锰矿制备Sc2O3 , 最终得到Sc2O3306g,该矿中含钪的质量分数为 。10. 甲苯(C7H8)和二甲苯(C8H10)是重要的化工原料。利用苯(C6H6)和甲醇(CH3OH)在催化剂作用下反应得到C7H8、C8H10和副产物三甲苯(C9H12),发生的主要反应如下:
(5)、有机萃取剂P507萃取Sc3+的反应原理为阳离子交换:ScCl3+3HR=ScR3+3HCl(HR代表P507)。在“富钪有机相”中反应生成Sc(OH)3的化学方程式是 。(6)、“萃余液2”中的金属阳离子除Al3+、Ca2+外,还有。(7)、Sc2(C2O4)3在空气中“煅烧”生成Sc2O3的化学方程式是 。(8)、某厂用1000 kg的钪锰矿制备Sc2O3 , 最终得到Sc2O3306g,该矿中含钪的质量分数为 。10. 甲苯(C7H8)和二甲苯(C8H10)是重要的化工原料。利用苯(C6H6)和甲醇(CH3OH)在催化剂作用下反应得到C7H8、C8H10和副产物三甲苯(C9H12),发生的主要反应如下:Ⅰ.
Ⅱ.
Ⅲ.
(1)、500℃、0.18Mpa条件下,反应达到平衡时,结果如图所示。
① 由图分析,随着投料比 增加,CH3OH的平衡转化率 , 平衡时 的值。(填“增大”、“减小”或“不变”)
②投料比 为1.0时,C6H6的平衡转化率为50%,产物中C7H8、C8H10和C9H12物质的量之比为6︰3︰1。CH3OH的平衡转化率为 , 反应I的平衡常数K= 。
(2)、我国学者结合实验与计算机模拟结果,研究了反应I在固体酸(HB)催化剂表面进行的反应历程如图所示。其中吸附在固体酸(HB)表面的物种用*标注。
① 反应I的∆H = kJ·mol−1。
② 吸附CH3OH的焓变 吸附C6H6的焓变(填“>”或“<”)。
③ C6H6*在催化剂表面转化为C7H8*的反应方程式为 。
④ 在固体酸(HB)催化作用下,测得反应I的速率方程为v =k∙p(C6H6)(k为速率常数)。在刚性容器中发生反应 I,关于反应 I 的平衡常数(K)和反应速率(v)的叙述正确的是(填标号)。
A. 升高温度,K和 v均增大
B. 增大p(C6H6),K不变, v增大
C. 降低温度,K和 v均减小
D. 增大p(CH3OH),K不变, v增大
三、选考题
-
11. [化学——选修3:物质结构与性质]
铜碘杂化团簇具有优异的光学性能,可用于制备发光二极管、发光墨水、生物成像仪器等。一种铜碘杂化团簇的合成路线如下:
 (1)、已知SbCl3(三氯化锑)是挥发性显著的物质,由此判断SbCl3中主要含有的化学键类型是。(2)、Sb为第四周期VA族元素,预测SbCl3的立体结构为 。(3)、Et2O(CH3CH2OCH2CH3 , 乙醚)中氧原子以及
(1)、已知SbCl3(三氯化锑)是挥发性显著的物质,由此判断SbCl3中主要含有的化学键类型是。(2)、Sb为第四周期VA族元素,预测SbCl3的立体结构为 。(3)、Et2O(CH3CH2OCH2CH3 , 乙醚)中氧原子以及 中碳原子的杂化类型分别是 、 。 (4)、CuI中Cu+的核外电子排布式为 。(5)、SbCy3只能与一个Cu+配位的原因是。+(6)、已知上述铜碘杂化团簇属四方晶系,晶胞参数分别为a nm、b nm、c nm,棱间夹角为α=β=γ=90°,平均一个晶胞含有一个铜碘杂化团簇,该团簇的化学式为。设阿伏加德罗常数的值为NA,已知SbCy的相对分子量是371,则该铜碘杂化团簇的密度是 g·cm−3(列计算式)。12. [化学——选修5:有机化学基础]
中碳原子的杂化类型分别是 、 。 (4)、CuI中Cu+的核外电子排布式为 。(5)、SbCy3只能与一个Cu+配位的原因是。+(6)、已知上述铜碘杂化团簇属四方晶系,晶胞参数分别为a nm、b nm、c nm,棱间夹角为α=β=γ=90°,平均一个晶胞含有一个铜碘杂化团簇,该团簇的化学式为。设阿伏加德罗常数的值为NA,已知SbCy的相对分子量是371,则该铜碘杂化团簇的密度是 g·cm−3(列计算式)。12. [化学——选修5:有机化学基础]化合物W是一种医药化工合成中间体,其合成路线如下:

回答下列问题:
(1)、链烃A的名称是 。B中官能团的名称是 。(2)、反应②、④的反应类型分别是 、 。(3)、反应③的化学方程式是 。(4)、F的结构简式是 。(5)、W的分子式是 。(6)、芳香化合物X是W的同分异构体,X能够发生银镜反应,核磁共振氢谱有五组峰,峰面积之比为6︰4︰3︰2︰1,写出三种X的同分异构体的结构简式。(7)、设计由1,2-二氯乙烷与 制备
制备  的合成路线。(无机试剂任选)
的合成路线。(无机试剂任选)