湖南省娄底市2020年中考化学模拟试卷
试卷更新日期:2020-06-12 类型:中考模拟
一、单选题
-
1. 在空气的成分中,体积分数约占21%的是( )A、氮气 B、二氧化碳 C、氧气 D、稀有气体2. 下列物质在氧气中燃烧,火星四射、生成黑色固体的是( )A、木炭 B、铁丝 C、蜡烛 D、红磷3. 为防止骨质疏松,应补充的元素是( )
A、铁 B、钙 C、锌 D、碳4. 下列物质中,属于纯净物的是()A、 茶饮料
B、
茶饮料
B、 苹果醋
C、
苹果醋
C、 蒸馏水
D、
蒸馏水
D、 纯牛奶
5. 下列符号中,表示2个氢分子的是( )A、H2 B、2H C、2H2 D、2H2O6. 水果散发出诱人的香味,你能闻到香味的原因是( )A、分子的体积很小 B、分子在不断运动 C、分子之间有间隔 D、分子的质量很小7. 下列物质的用途中,利用其化学性质的是( )A、液氮用作冷冻剂 B、干冰用于人工降雨 C、氧气用于气焊 D、浓硫酸用作干燥剂8. 下列物质露置于空气中,质量会减小的是( )A、浓硫酸 B、浓盐酸 C、氢氧化钠 D、氯化钠9. 次氯酸钠(NaClO)是某种消毒液的有效成分,次氯酸钠中氯元素的化合价为( )A、-2 B、-1 C、+1 D、+210. 下列实验操作中,正确的是( )A、
纯牛奶
5. 下列符号中,表示2个氢分子的是( )A、H2 B、2H C、2H2 D、2H2O6. 水果散发出诱人的香味,你能闻到香味的原因是( )A、分子的体积很小 B、分子在不断运动 C、分子之间有间隔 D、分子的质量很小7. 下列物质的用途中,利用其化学性质的是( )A、液氮用作冷冻剂 B、干冰用于人工降雨 C、氧气用于气焊 D、浓硫酸用作干燥剂8. 下列物质露置于空气中,质量会减小的是( )A、浓硫酸 B、浓盐酸 C、氢氧化钠 D、氯化钠9. 次氯酸钠(NaClO)是某种消毒液的有效成分,次氯酸钠中氯元素的化合价为( )A、-2 B、-1 C、+1 D、+210. 下列实验操作中,正确的是( )A、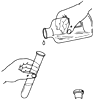 倾倒液体
B、
倾倒液体
B、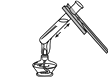 加热液体
C、
加热液体
C、 点燃酒精灯
D、
点燃酒精灯
D、 过滤
11. 下列数据是一些物质的pH,其中呈碱性的是( )A、牙膏
过滤
11. 下列数据是一些物质的pH,其中呈碱性的是( )A、牙膏 B、胡萝卜
B、胡萝卜  C、橘子
C、橘子  D、食醋
D、食醋  12. 甲和乙点燃条件下反应生成丙和丁。反应前后分子变化的微观示意图如下,下列说法错误的是( )
12. 甲和乙点燃条件下反应生成丙和丁。反应前后分子变化的微观示意图如下,下列说法错误的是( ) A、一个甲分子中含有4个原子 B、丁的化学式为H2O C、生成物丙和丁的质量比为14:9 D、4种物质中,属于化合物的是甲和丁13. 下列实验操作一定能达到实验目的的是( )
A、一个甲分子中含有4个原子 B、丁的化学式为H2O C、生成物丙和丁的质量比为14:9 D、4种物质中,属于化合物的是甲和丁13. 下列实验操作一定能达到实验目的的是( )选项
实验目的
实验操作
A
除去CaO中的CaCO3
加入足量的水,过滤
B
检验某种固体是否为碳酸盐
取少量样品,加入稀盐酸
C
鉴别稀盐酸和NaCl溶液
分别滴加酚酞溶液
D
比较Zn、Cu、Ag的金属活动性
将Zn和Ag分别放入CuSO4溶液中
A、A B、B C、C D、D14. 实验小组用传感器探究稀NaOH溶液与稀盐酸反应过程中温度和pH的变化。测定结果如图所示。下列说法正确的是( ) A、该实验是将稀盐酸滴入稀NaOH溶液 B、50s时,溶液中溶质为NaOH和NaCl C、溶液温度升高是由于NaOH溶于水放热 D、从20s到40s,溶液的温度升高,pH不变
A、该实验是将稀盐酸滴入稀NaOH溶液 B、50s时,溶液中溶质为NaOH和NaCl C、溶液温度升高是由于NaOH溶于水放热 D、从20s到40s,溶液的温度升高,pH不变二、填空题
-
15. 如图是大型成就展中的“碳足迹计算器模型”。倡导“低碳”生活,应从生活中的点滴做起。

下列做法不符合“低碳”理念的是( )
A、外出随手关灯 B、双面使用纸张 C、骑自行车出行 D、丢弃未喝完的矿泉水瓶16. 用化学符号表示:(1)、最简单的有机物是;(2)、幼儿缺少会患佝偻病、青少年缺少会影响身高、老年人缺少会发生骨质疏松症的元素是。17. 向含乳饮料中加入蔗糖(化学式为C12H22O11)可改变口感。蔗糖中氢、氧元素的质量比为。18. 请用下列物质的序号填空:①石墨②熟石灰③氯化钠④明矾⑤氮气
(1)、可用于净水的是;(2)、充入食品包装袋中可以防腐的气体单质是;(3)、可用于改良酸性土壤的是;(4)、用于配制生理盐水的是。19. “洁厕灵”的有效成分是稀盐酸,若与“漂白水”混用,易产生一种有毒气体单质。化学方程式为NaClO + 2HCl=NaCl + X↑ + H2O,则X的化学式为20. 生活中的能量大部分来自于化石燃料的燃烧。化石燃料包括煤、和天然气。天然气燃烧的化学方程式为。21. 甲、乙、丙三种固体物质的溶解度曲线如图所示,请回答下列问题: (1)、a3时,三种物质的溶解度由大到小的顺序是:;(2)、a1时,的溶解度大小相等;(3)、在20℃时,将25g甲固体加入50g水中,充分搅拌后,仍有9.2g甲固体未溶解,则20℃时甲的溶解度为;若将20℃下甲的不饱和溶液变成该温度下的饱和溶液,可采用的方法是:(任写一种即可)。
(1)、a3时,三种物质的溶解度由大到小的顺序是:;(2)、a1时,的溶解度大小相等;(3)、在20℃时,将25g甲固体加入50g水中,充分搅拌后,仍有9.2g甲固体未溶解,则20℃时甲的溶解度为;若将20℃下甲的不饱和溶液变成该温度下的饱和溶液,可采用的方法是:(任写一种即可)。三、流程题
-
22. 尿素[CO(NH2)2]是一种常用化肥。图为利用天然气制尿素的主要流程。
 (1)、设备Ⅰ内发生的变化是 填“物理变化”或者“化学变化”(2)、设备Ⅱ中发生的反应所属的基本反应类型是。(3)、设备Ⅲ中产生并分离出CO2和H2两种物质,依据流程图判断进入设备Ⅳ的是H2 , 理由是。(4)、设备Ⅴ中发生反应:2NH3+CO2=CO(NH2)2+H2O,若生产60t尿素,需要NH3的质量为t。
(1)、设备Ⅰ内发生的变化是 填“物理变化”或者“化学变化”(2)、设备Ⅱ中发生的反应所属的基本反应类型是。(3)、设备Ⅲ中产生并分离出CO2和H2两种物质,依据流程图判断进入设备Ⅳ的是H2 , 理由是。(4)、设备Ⅴ中发生反应:2NH3+CO2=CO(NH2)2+H2O,若生产60t尿素,需要NH3的质量为t。四、实验题
-
23. 请根据下图所示装置,回答下列问题。
 (1)、仪器①的名称是 , 仪器②的名称是。(2)、若实验室用高锰酸钾制取氧气,选取的发生装置是 , 反应的化学方程式为。(3)、D中试管a中产生的气体为。(4)、若实验室制取二氧化碳,选取的发生装置是 , 收集装置只能选择C,其原因是。(5)、E中观察到的现象是。
(1)、仪器①的名称是 , 仪器②的名称是。(2)、若实验室用高锰酸钾制取氧气,选取的发生装置是 , 反应的化学方程式为。(3)、D中试管a中产生的气体为。(4)、若实验室制取二氧化碳,选取的发生装置是 , 收集装置只能选择C,其原因是。(5)、E中观察到的现象是。五、科学探究题
-
24. 如下图的加热袋常用于野外加热食物。加热袋中的固体粉末含镁粉、铁粉和氯化钠,使用时向其中加入水袋中的水,即可产生大量热。实验小组针对放热过程中的反应原理展开探究。


(查阅资料)
常温下镁粉能与水发生置换反应,且放热。
(进行实验)
同学们用下图所示装置进行模拟实验:分别取不同成分的固体粉末放入甲中,通过分液漏斗向其中均加入8 mL水,读取甲中所得固液混合物的最高温度,实验记录如下表:

(实验时的室温为22.8℃)
实验序号
A
B
C
D
E
F
固体成分
Mg
Fe
Mg+Fe
Mg+NaCl
Fe+NaCl
Mg+Fe+NaCl
乙中现象
少量肥皂泡,难以点燃
?
少量肥皂泡,难以点燃
较多肥皂泡,点燃有爆鸣声
无肥皂泡
大量肥皂泡,点燃有爆鸣声
混合物温度
23.1℃
22.8℃
23.1℃
24.2℃
22.8℃
27.2℃
(解释与结论)
(1)、实验B,乙中现象为。(2)、实验A证明了镁粉与水能反应,完成该反应的化学方程式Mg+2H2O=+H2↑(3)、使镁粉与水迅速反应并放热的最佳方法是向镁粉中加入。(4)、(反思改进)同学们分析实验数据发现,升高的温度没有达到食品加热袋的效果,其可能的原因是。
(5)、同学们根据实验结果进一步猜测,实验F中的反应结束后,甲中剩余固体混合物中仍然含有铁粉,检验其铁粉存在的的实验方案为:取少量固体混合物。(6)、从上述实验初步得出“NaCl溶于水没有热量的变化”的结论,依据的两个实验是(填实验序号)。六、计算题
-
25. 化学兴趣小组用一瓶久置的过氧化氢溶液制取氧气并测量过氧化氢的质量分数。现称量68g 过氧化氢溶液和 0.1g 二氧化锰进行实验,反应前后质量随时间变化关系如图.

计算:
(1)、制得氧气的质量是__g;(2)、过氧化氢质量分数是?
-
-
-