浙教版科学 中考冲刺专题之化学简答题(基础)
试卷更新日期:2020-06-11 类型:三轮冲刺
一、解答题
-
1.
每年5、6月是蓝莓丰收的时节,蓝莓中含有丰富的花青素(化学式为C15H11O6)。花青素是一种水溶性色素,颜色与细胞液的酸碱性有关,细胞液酸性时呈红色,碱性时呈蓝色。
 (1)、在白醋中滴加花青素,溶液变色。(2)、一个花青素分子中共有个原子。(3)、28.7克花青素中含有多少克碳元素?(请列式计算)2. 影片《唐人街探案2》中,多人因被七氟烷(化学式C4H3F7O)麻醉而丧失反抗力。七氟烷为无色无味、有香味无刺激性气味的液体,对热、强酸稳定,不燃烧、不爆炸。请回答问题:(1)、已知七氟烷的化学式为C4H3F7O,则下列说法正确的是 __。A、七氟烷的相对分子质量为200 B、一个七氟烷分子中含有18个原子 C、七氟烷的含碳量为26.7% D、七氟烷中C、H、O三种元素的质量比为4:3:7:1(2)、吸入的七氟烷经过呼吸道进入肺部,再经过肺泡的毛细血管进入系统,最后作用于大脑的 , 产生昏迷。(3)、现场勘探时,要十分注意痕迹,破案人员根据脚印深浅可以大致判断疑犯的体重,原因是。3. 2020年的新春出现了新冠肺炎疫情,全国人民众志成城、抗击疫情。我国多地采用一天两次高空雾炮进行杀菌消毒(如图),所用的主要消毒液是84消毒液。它是由氯气通入氢氧化钠溶液中制得,有效成分是次氯酸钠(NaClO)。
(1)、在白醋中滴加花青素,溶液变色。(2)、一个花青素分子中共有个原子。(3)、28.7克花青素中含有多少克碳元素?(请列式计算)2. 影片《唐人街探案2》中,多人因被七氟烷(化学式C4H3F7O)麻醉而丧失反抗力。七氟烷为无色无味、有香味无刺激性气味的液体,对热、强酸稳定,不燃烧、不爆炸。请回答问题:(1)、已知七氟烷的化学式为C4H3F7O,则下列说法正确的是 __。A、七氟烷的相对分子质量为200 B、一个七氟烷分子中含有18个原子 C、七氟烷的含碳量为26.7% D、七氟烷中C、H、O三种元素的质量比为4:3:7:1(2)、吸入的七氟烷经过呼吸道进入肺部,再经过肺泡的毛细血管进入系统,最后作用于大脑的 , 产生昏迷。(3)、现场勘探时,要十分注意痕迹,破案人员根据脚印深浅可以大致判断疑犯的体重,原因是。3. 2020年的新春出现了新冠肺炎疫情,全国人民众志成城、抗击疫情。我国多地采用一天两次高空雾炮进行杀菌消毒(如图),所用的主要消毒液是84消毒液。它是由氯气通入氢氧化钠溶液中制得,有效成分是次氯酸钠(NaClO)。 (1)、次氯酸钠中钠、氯、氧元素的原子个数比为。(2)、制备次氯酸钠的化学方程式为:Cl2+2NaOH=NaCl+NaClO+X,则X的化学式是。(3)、市售的84消毒液必须经过稀释才能使用,其标签如图所示。现需配制0.2%浓度的消毒液2000kg,需要该消毒液多少千克?加水多少千克?4. 死海因其高盐度出名,海里没有鱼虾、水草,甚至连海边也寸草不生。美国科学家对其十分好奇,乘船到死海,做了一个实验:(如图)他们将一件黑色礼服用钢丝固定,放入死海中,两年后取出,发现衣服表面挂满了白色盐晶。经检测,晶体中的成分主要包含氯化钠、氯化钙、氯化钾等。
(1)、次氯酸钠中钠、氯、氧元素的原子个数比为。(2)、制备次氯酸钠的化学方程式为:Cl2+2NaOH=NaCl+NaClO+X,则X的化学式是。(3)、市售的84消毒液必须经过稀释才能使用,其标签如图所示。现需配制0.2%浓度的消毒液2000kg,需要该消毒液多少千克?加水多少千克?4. 死海因其高盐度出名,海里没有鱼虾、水草,甚至连海边也寸草不生。美国科学家对其十分好奇,乘船到死海,做了一个实验:(如图)他们将一件黑色礼服用钢丝固定,放入死海中,两年后取出,发现衣服表面挂满了白色盐晶。经检测,晶体中的成分主要包含氯化钠、氯化钙、氯化钾等。 (1)、鱼虾、水草等生物随河水到死海后会死亡的主要原因是;(2)、黑色礼服上的白色盐晶,在这两年中经历的最主要过程是 ;A、凝固 B、蒸馏 C、结晶 D、升华(3)、将衣服表面盐晶溶于水,加入饱和碳酸钠溶液,将出现 现象;5. 漂白液是家庭常用的洗涤剂。工业上常用氢氧化钠溶液吸收氯气来制漂白液,反应的化学方程式是Cl2+2NaOH=NaClO+NaCl+H2O。现向氢氧化钠溶液中通入氯气,恰好完全反应,得到含次氯酸钠(NaClO)5%的漂白液(漂白液中的溶质是氯化钠和次氯酸钠)1490g,请计算:(1)、上述反应方程式中,氯元素呈现了种化合价。(2)、原氢氧化钠溶液中溶质的质量分数(计算结果精确到0.1%)。6. 家里蒸馒头用的纯碱中含有少量的氯化钠,课外探究小组的同学欲测定纯碱中碳酸钠的含量。他们取该纯碱样品11.0g,全部溶解在100.0g水中,再加入氯化钙溶液141.0g,恰好完全反应。过滤干燥后,称得沉淀质量为10.0g。请计算:(1)、纯碱样品中碳酸钠的质量;(2)、反应后所得滤液中溶质的质量分数。7. 某科学兴趣小组用足量的稀硫酸对10克铜锌合金样品进行科学探究,有关数据见图。
(1)、鱼虾、水草等生物随河水到死海后会死亡的主要原因是;(2)、黑色礼服上的白色盐晶,在这两年中经历的最主要过程是 ;A、凝固 B、蒸馏 C、结晶 D、升华(3)、将衣服表面盐晶溶于水,加入饱和碳酸钠溶液,将出现 现象;5. 漂白液是家庭常用的洗涤剂。工业上常用氢氧化钠溶液吸收氯气来制漂白液,反应的化学方程式是Cl2+2NaOH=NaClO+NaCl+H2O。现向氢氧化钠溶液中通入氯气,恰好完全反应,得到含次氯酸钠(NaClO)5%的漂白液(漂白液中的溶质是氯化钠和次氯酸钠)1490g,请计算:(1)、上述反应方程式中,氯元素呈现了种化合价。(2)、原氢氧化钠溶液中溶质的质量分数(计算结果精确到0.1%)。6. 家里蒸馒头用的纯碱中含有少量的氯化钠,课外探究小组的同学欲测定纯碱中碳酸钠的含量。他们取该纯碱样品11.0g,全部溶解在100.0g水中,再加入氯化钙溶液141.0g,恰好完全反应。过滤干燥后,称得沉淀质量为10.0g。请计算:(1)、纯碱样品中碳酸钠的质量;(2)、反应后所得滤液中溶质的质量分数。7. 某科学兴趣小组用足量的稀硫酸对10克铜锌合金样品进行科学探究,有关数据见图。 (1)、图中M的值为克。(2)、AB和BC不在同一直线上的原因是。(3)、求所用稀硫酸的溶质的质量分数。8. 2019年澳大利亚发生了大面积的森林火灾,灭火工作异常困难,如图甲为消防员戴的一种“自生氧防毒面具”,其使用生氧剂的主要成分是超氧化钾(化学式KO2)。超氧化钾能与人呼出的气体中的水蒸气和二氧化碳反应生成氧气。
(1)、图中M的值为克。(2)、AB和BC不在同一直线上的原因是。(3)、求所用稀硫酸的溶质的质量分数。8. 2019年澳大利亚发生了大面积的森林火灾,灭火工作异常困难,如图甲为消防员戴的一种“自生氧防毒面具”,其使用生氧剂的主要成分是超氧化钾(化学式KO2)。超氧化钾能与人呼出的气体中的水蒸气和二氧化碳反应生成氧气。 (1)、某同学利用面具中的生氧剂与水反应来制氧气,其化学反应方程式:4KO2+2H2O═4KOH+3O2↑。则制取时可选用乙图中的(填“A”或“B”)发生装置。(2)、若成人每分钟正常需氧量约为0.32克,则能维持成人正常呼吸30分钟的“自生氧防毒面具”至少要装入含超氧化钾80%的生氧剂多少克?(呼出的二氧化碳与超氧化钾反应的化学方程式为:4KO2+2CO2═2K2CO3+3O2)9. 有铁粉和铜粉的均匀混合物,甲、乙、丙三位同学分别取该混合物与稀硫酸反应,所得数据如下表所示:
(1)、某同学利用面具中的生氧剂与水反应来制氧气,其化学反应方程式:4KO2+2H2O═4KOH+3O2↑。则制取时可选用乙图中的(填“A”或“B”)发生装置。(2)、若成人每分钟正常需氧量约为0.32克,则能维持成人正常呼吸30分钟的“自生氧防毒面具”至少要装入含超氧化钾80%的生氧剂多少克?(呼出的二氧化碳与超氧化钾反应的化学方程式为:4KO2+2CO2═2K2CO3+3O2)9. 有铁粉和铜粉的均匀混合物,甲、乙、丙三位同学分别取该混合物与稀硫酸反应,所得数据如下表所示: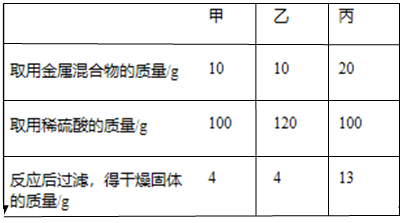
数据,回答下列问题:
(1)、丙同学所得混合物中铜的质量是。(2)、甲所得溶液中含有溶质的是。(3)、根据实验数据分析,若取用金属混合物15g,加入到120g稀硫酸中,充分反应后最终得到固体质量为。(4)、计算丙同学所得溶液中溶质的质量分数。(写出计算过程,计算结果精确到0.1%)10. 小黄同学对不同催化剂在氯酸钾分解反应中的催化效果进行研究,在相同的加热条件下,用下图装置完成表中实验:
 (1)、设置实验1的目的是。(2)、根据表中数据,催化效果最佳的催化剂是。(3)、小黄还发现维持加热条件不变,用实验1再继续收集50mLO2 , 所需时间明显少于171s,请解释原因:。(4)、在另一次实验中小黄用氯酸钾和二氧化锰制取氧气,加热一段时间后,测得试管内的固体质量减少了4.8克,则试管内分解了多少克氯酸钾?
(1)、设置实验1的目的是。(2)、根据表中数据,催化效果最佳的催化剂是。(3)、小黄还发现维持加热条件不变,用实验1再继续收集50mLO2 , 所需时间明显少于171s,请解释原因:。(4)、在另一次实验中小黄用氯酸钾和二氧化锰制取氧气,加热一段时间后,测得试管内的固体质量减少了4.8克,则试管内分解了多少克氯酸钾?
11. 为了测定某种贝壳中碳酸钙的质量分数,小金同学称取50g贝壳样品,分别在5只烧杯中进行了实验,实验数据见下表(假设贝壳中其它物质不与盐酸反应):根据实验设计及有关数据进行分析与计算:烧杯A
烧杯B
烧杯C
烧杯D
烧杯E
加入贝壳样品的质量/g
10
10
10
10
10
加入稀盐酸的质量/g
10
20
30
40
50
充分反应后生成气体的质量/g
0.88
1.76
x
3.52
3.52
(1)、表格中x的值为;(2)、求样品中碳酸钙的质量分数;12. 氢氧化钠是一种重要的化工原料,但其在空气中很容易变质。兴趣小组为了研究某氢氧化钠样品变质的情况,进行了如图甲所示实验(恰好完全反应),加入稀硫酸的质量与产生气体质量的关系如图乙所示。请分析计算: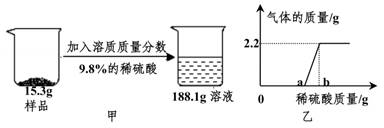 (1)、图乙中b的数值是。(2)、图乙中a的数值是多少?(写出分析计算过程)(3)、通过计算分析原样品的具体组成情况。13. 课堂上老师演示了锌跟稀硫酸的反应,小明对实验后试管中溶液的成分产生了兴趣,他先用pH试纸测得反应后剩余溶液的pH=1,然后往该试管中逐滴加入氢氧化钡溶液,发现当他滴下第一滴溶液后,立即产生白色沉淀。请回答下列问题:
(1)、图乙中b的数值是。(2)、图乙中a的数值是多少?(写出分析计算过程)(3)、通过计算分析原样品的具体组成情况。13. 课堂上老师演示了锌跟稀硫酸的反应,小明对实验后试管中溶液的成分产生了兴趣,他先用pH试纸测得反应后剩余溶液的pH=1,然后往该试管中逐滴加入氢氧化钡溶液,发现当他滴下第一滴溶液后,立即产生白色沉淀。请回答下列问题: (1)、老师根据实验现象画出了沉淀质量随滴加的氢氧化钡溶液质量的变化曲线如图所示。则BC段产生的沉淀是。(填化学式)(2)、当老师将稀硫酸加入有锌粒的试管后,随着反应的进行,锌粒有上浮到液面的现象,请解释此现象。14. 向34.2g的Ba(OH)2溶液中先后滴加质量分数为8%的CuSO4和质量分数为9.8%的H2SO4溶液,滴加过程中加入溶液的质量与产生沉淀的质量关系如图所示。
(1)、老师根据实验现象画出了沉淀质量随滴加的氢氧化钡溶液质量的变化曲线如图所示。则BC段产生的沉淀是。(填化学式)(2)、当老师将稀硫酸加入有锌粒的试管后,随着反应的进行,锌粒有上浮到液面的现象,请解释此现象。14. 向34.2g的Ba(OH)2溶液中先后滴加质量分数为8%的CuSO4和质量分数为9.8%的H2SO4溶液,滴加过程中加入溶液的质量与产生沉淀的质量关系如图所示。 (1)、a点对应溶液pH7(选填“>”“=”或“<”)。(2)、通过计算确定加入的CuSO4溶液中的溶质质量为多少?(3)、原Ba(OH)2溶液溶质的质量分数为多少?15. 有一包白色固体样品,可能含有NaOH、Na2CO3、K2SO4、BaCl2中的一种或几种,为确定其组成,进行如下实验:
(1)、a点对应溶液pH7(选填“>”“=”或“<”)。(2)、通过计算确定加入的CuSO4溶液中的溶质质量为多少?(3)、原Ba(OH)2溶液溶质的质量分数为多少?15. 有一包白色固体样品,可能含有NaOH、Na2CO3、K2SO4、BaCl2中的一种或几种,为确定其组成,进行如下实验:步骤Ⅰ:取少量样品于烧杯中,加足量水,充分搅拌,静置,有固体剩余。
步骤Ⅱ:取步骤I所得上层清液于试管中,滴入几滴酚酞溶液,溶液变红色;再滴入过量稀盐酸,无气泡产生,红色逐渐褪去,得到无色溶液。
步骤Ⅲ:取步骤Ⅱ所得溶液于试管中,滴入过量Ba(NO3)2溶液,无明显现象。
根据上述实验,回答下列问题:
(1)、步骤Ⅱ中溶液的红色褪去,发生反应的化学方程式是(2)、分析上述实验过程,关于样品的组成,一定含有的是(3)、若要进一步确定样品的组成,还需进行的实验操作是16. 实验室有氧化铜和铁的混合物粉末,为提炼其中的铜,现进行如下操作:
(1)、步骤Ⅱ所需用到的仪器有铁架台、烧杯、。(请再写出两种玻璃仪器)。(2)、溶液C中的溶质是。(填化学名称)(3)、现有20g溶质质量分数为98%的浓硫酸,要将其稀释成质量分数为9.8%的稀硫酸,需加水多少毫升?(写出计算过程)17. 桑葚(又名桑果),为多年生木本植物桑树的果实。桑果中含有一种叫“白黎芦醇”(化学式可表示为C14H12O3)的物质。白藜芦醇的外观为无色针状结晶,无味,难溶于水,易溶于乙醚、三氯甲烷、甲醇、乙醇、丙酮等物质遇到氨水等碱性溶液可显红色,与三氯化铁一铁氰化钾可发生显色反应,利用此性质可以鉴定白藜芦醇。 (1)、请写出白黎芦醇的一条物理性质:。(2)、白黎芦醇分子中碳、氢、氧原子个数比为。(3)、白黎芦醇中碳元素的质量分数为。(结果精确到0.1%)18. 现有一定质量含有少量泥沙等不溶性杂质和少量氯化钙和氯化镁等可溶性杂质的粗盐样品,实验室提纯流程如图,请认真分析各步骤的信息作答:
(1)、请写出白黎芦醇的一条物理性质:。(2)、白黎芦醇分子中碳、氢、氧原子个数比为。(3)、白黎芦醇中碳元素的质量分数为。(结果精确到0.1%)18. 现有一定质量含有少量泥沙等不溶性杂质和少量氯化钙和氯化镁等可溶性杂质的粗盐样品,实验室提纯流程如图,请认真分析各步骤的信息作答: (1)、过滤操作中除了需带铁圈的铁架台、滤纸、烧杯外,还需要用到的仪器有。(2)、试剂x的名称是。(3)、蒸发过程中,观察到时,就可熄灭酒精灯。19. 某兴趣小组的同学从实验室收集到一桶含有FeSO4、CuSO4的废液,欲从中回收金属铜和硫酸亚铁晶体,设计了如图实验方案。
(1)、过滤操作中除了需带铁圈的铁架台、滤纸、烧杯外,还需要用到的仪器有。(2)、试剂x的名称是。(3)、蒸发过程中,观察到时,就可熄灭酒精灯。19. 某兴趣小组的同学从实验室收集到一桶含有FeSO4、CuSO4的废液,欲从中回收金属铜和硫酸亚铁晶体,设计了如图实验方案。 (1)、步骤②中,加入过量稀硫酸的目的是。(2)、实验室进行“操作③”时,需要用到下列器材中的 (可多选)。
(1)、步骤②中,加入过量稀硫酸的目的是。(2)、实验室进行“操作③”时,需要用到下列器材中的 (可多选)。 (3)、实验过程中需要一定溶质质量分数的稀硫酸溶液。现要配制9.8千克溶质质量分数为10%的稀硫酸溶液,需要溶质质量分数为98%的浓硫酸溶液多少千克?20. 某固体可能含有Ba(NO3)2、Na2SO4、Na2CO3、CuSO4、KNO3中的一种或几种,现对其进行如下实验:
(3)、实验过程中需要一定溶质质量分数的稀硫酸溶液。现要配制9.8千克溶质质量分数为10%的稀硫酸溶液,需要溶质质量分数为98%的浓硫酸溶液多少千克?20. 某固体可能含有Ba(NO3)2、Na2SO4、Na2CO3、CuSO4、KNO3中的一种或几种,现对其进行如下实验:①取少量固体于试管中,加适量蒸馏水,固体完全溶解成无色透明溶液;
②取少量上述①所得溶液,加适量稀硫酸,产生气泡;
③取②所得溶液少量,滴加BaCl2溶液,产生白色沉淀。
通过分析整个实验过程产生的现象,推断原固体组成。
21. 2019年6月21日,杭州市开始在全市范围稳步推进垃圾分类管理,将生活垃圾分为下图所示的4类: (1)、以下四种物品中属于垃圾分类中可回收物的是________。A、破碗瓷片 B、过期药物 C、废旧报纸 D、枯枝落叶(2)、易腐垃圾经过处理会产生沼气,沼气可以燃烧发电。沼气的主要成分是甲烷(CH4),请写出甲烷燃烧的化学方程式。(3)、杭州九峰垃圾焚烧发电项目通过焚烧垃圾可以达到年发电量4×108千瓦时,相当于完全燃烧吨的烟煤释放出的能量。(烟煤的热值取3.0×107焦/千克)(4)、废电池属于“有害垃圾”,主要是因为废电池里含有大量的汞、镉、锰、铅等重金属(选填“元素”或“单质”)。(5)、“可回收物”中也包含铝制易拉罐,对铝制易拉罐的回收一般分四步:破碎、脱漆、打包、熔炼。将易拉罐熔炼成铝块的过程,铝发生的物态变化是。22. 小明为测定某石灰石样品(主要成分为碳酸钙,其它成分不与稀盐酸反应)中碳酸钙的含量,进行了如下实验:(碳酸钙与盐酸反应的化学方程式为:CaCO3+2HCl=CaCl2+H2O+CO2↑)
(1)、以下四种物品中属于垃圾分类中可回收物的是________。A、破碗瓷片 B、过期药物 C、废旧报纸 D、枯枝落叶(2)、易腐垃圾经过处理会产生沼气,沼气可以燃烧发电。沼气的主要成分是甲烷(CH4),请写出甲烷燃烧的化学方程式。(3)、杭州九峰垃圾焚烧发电项目通过焚烧垃圾可以达到年发电量4×108千瓦时,相当于完全燃烧吨的烟煤释放出的能量。(烟煤的热值取3.0×107焦/千克)(4)、废电池属于“有害垃圾”,主要是因为废电池里含有大量的汞、镉、锰、铅等重金属(选填“元素”或“单质”)。(5)、“可回收物”中也包含铝制易拉罐,对铝制易拉罐的回收一般分四步:破碎、脱漆、打包、熔炼。将易拉罐熔炼成铝块的过程,铝发生的物态变化是。22. 小明为测定某石灰石样品(主要成分为碳酸钙,其它成分不与稀盐酸反应)中碳酸钙的含量,进行了如下实验:(碳酸钙与盐酸反应的化学方程式为:CaCO3+2HCl=CaCl2+H2O+CO2↑)方案一:按如图甲实验方案,取石灰石样品和足量的稀盐酸进行实验,通过测量反应前后装置总质量的变化来计算石灰石样品中碳酸钙的含量。
方案二:利用气密性良好的图乙装置进行实验:①称取石灰石样品8克,加入锥形瓶中,塞紧瓶塞,从左侧持续缓慢鼓入氮气;②一段时间后打开分液漏斗活塞,注入足量的稀盐酸,开始计时;③待装置C总质量不再增加时停止鼓入氮气。实验过程中测得装置C增加的质量随时间变化图像如图丙。
 (1)、有同学认为利用方案一,测得石灰石样品中碳酸钙的质量分数会偏大,原因是 (答出一点即可)。(2)、方案二在反应结束后,继续往A装置通入一会儿氮气的目的是。(3)、根据图丙,计算该石灰石样品中碳酸钙的质量分数。23. 设计方案是实验探究的保证,感悟方法是探究的根本目的。某合作学习小组开展了如下探究。
(1)、有同学认为利用方案一,测得石灰石样品中碳酸钙的质量分数会偏大,原因是 (答出一点即可)。(2)、方案二在反应结束后,继续往A装置通入一会儿氮气的目的是。(3)、根据图丙,计算该石灰石样品中碳酸钙的质量分数。23. 设计方案是实验探究的保证,感悟方法是探究的根本目的。某合作学习小组开展了如下探究。【实验目的】检验氢氧化钠溶液中是否含有氢氧化钙。
(1)、【分析】从组成上看,氢氧化钙和氢氧化钠都属于碱,所以具有相似的化学性质。如果在它们的水溶液中滴加酚酞溶液,都能看到的现象是;但由于电离出的Na+和Ca2+不同,所以性质也有不同。设计实验时可加入能电离出CO32﹣的试剂,利用CO32﹣与Ca2+结合产生白色沉淀这一特殊现象予以检验。实验操作
现象
结论
方案一
取少量待测溶液于试管中,通入CO2
出现白色沉淀
氢氧化钠溶液中含有氢氧化钙
方案二
取少量待测溶液于试管中,滴加Na2CO3溶液
出现白色沉淀
(2)、【设计方案并实验】写出方案二中出现白色沉淀反应的化学方程式。【方法感悟】在检验物质时,要分析物质的组成和性质,据此选择加入恰当的试剂,最后根据不同现象得出结论。
(3)、【定量研究】某氢氧化钠样品中混有氯化钠,为测定样品中氢氧化钠的质量分数,称取10g该样品,加入54g水完全溶解后,缓慢加入稀盐酸,同时测定溶液的pH,当pH=7时,刚好用去10%的稀盐酸73g。计算:①将200g质量分数为38%的浓盐酸稀释成10%的稀盐酸,需要加水多少?
②样品中氢氧化钠的质量分数。
(4)、反应后所得溶液中溶质的质量分数。24. 垃圾发电是把各种垃圾收集后,进行分类处理。其中:一是对燃烧值较高的进行高温焚烧,在高温焚烧中产生的热能转化为高温蒸气,推动涡轮机转动,使发电机产生电能。二是对不能燃烧的有机物在缺乏空气的条件下进行腐烂发酵、产生一种气体沼气。据测算,1立方米的沼气池一天产生沼气量0.2立方米。1立方米沼气可以供6口之家三餐的烹饪,可以使3吨的卡车运行3千米,点亮60W电灯工作6小时。 (1)、垃圾进行无氧分解会产生沼气和二氧化碳,请写出沼气燃烧的化学方程式;(2)、已知沼气由甲烷细菌在分解腐烂物时释放出来的,1立方米沼气可以产生焦耳能量。甲烷细菌的新陈代谢类型是.
(1)、垃圾进行无氧分解会产生沼气和二氧化碳,请写出沼气燃烧的化学方程式;(2)、已知沼气由甲烷细菌在分解腐烂物时释放出来的,1立方米沼气可以产生焦耳能量。甲烷细菌的新陈代谢类型是.A.需氧自养型 B.厌氧自养型 C.需氧异养型 D.厌氧异养型
(3)、据计算,每燃烧1吨垃圾,产生7.2×108焦的电能,这些电能相当于千克烟煤燃烧放出的热量(烟煤的热值约3×107焦/千克,燃烧转化率为60%)。(4)、我国积极发展绿色能源能,以减少污染性气体的排放。对于①水力发电;②风力发电;③天然气发电;④太阳能发电;⑤垃圾焚烧发电等5种方式,你认为有利于减少温室气体排放的是(填序号)。25. 小明学习了有关气体知识后,进行如图所示的探究,实验开始前红墨水左右两端液面保持相平。容器Ⅰ、Ⅱ体积相同,装置气密性良好。将针筒内全部液体同时迅速注入容器中,实验内容如下表所示:
实验编号
容器Ⅰ
针筒Ⅰ
容器Ⅱ
针筒Ⅱ
红墨水液面位置
一
0.65g锌片
15mL盐酸
0.65g铁片
15mL盐酸
二
二氧化碳(充满)
15mL澄清石灰水
二氧化碳(充满)
15mL水
(1)、实验一中,针筒Ⅰ、Ⅱ内盛放足量且溶质质量分数相同的盐酸,产生气泡更剧烈的容器是 (选填“I”或“Ⅱ”),实验一整个过程中红墨水的位置变化情况是。(2)、实验二中,产生的现象有。26. 现有硫酸铜溶液、氢氧化钾溶液、碳酸钠溶液、氯化钠溶液和稀硫酸五种溶液。鉴别它们可按下图所示的步骤进行操作。(提示:碳酸钠溶液呈碱性) (1)、步骤①中通过观察可以鉴别出硫酸铜溶液。(2)、步骤③用试剂Y鉴别氢氧化钾溶液和碳酸钠溶液时,试剂Y可以选用不同类别的物质。
(1)、步骤①中通过观察可以鉴别出硫酸铜溶液。(2)、步骤③用试剂Y鉴别氢氧化钾溶液和碳酸钠溶液时,试剂Y可以选用不同类别的物质。①若试剂Y为酸,写出有气体生成的反应的化学方程式 。
②若试剂Y为碱,写出有沉淀生成的反应的化学方程式。
27. 如图所示是一个带“救生圈”的钥匙链。这个钥匙链遇水将会弹出一个安全气囊,它能拉起超过了1千克的物体。另外,水还会触发这个钥匙链的LED灯,使它发出明亮的光,即使是在晚上,你也很容易找到漂浮在水中的钥匙。注意:洗衣服或游泳的时候一定要把钥匙链放到安全的地方,否则就会“嘭……”。 (1)、此钥匙链遇水后LED灯发光,说明水能够(填物理性质);(2)、若重物为1千克时,气囊刚好完全浸没(忽略钥匙链和钥匙的体积),则气囊中产生的气体体积多大?(3)、安全气囊中的气体是由水与过氧化钠反应产生的,化学方程式:2H2O+2Na2O2==4NaOH+O2↑,请根据化学方程式计算:此钥匙链中最少需要放入多少克过氧化钠才能浮起1千克的物体(已知氧气密度为:1.429克/升,结果保留2位小数)。
(1)、此钥匙链遇水后LED灯发光,说明水能够(填物理性质);(2)、若重物为1千克时,气囊刚好完全浸没(忽略钥匙链和钥匙的体积),则气囊中产生的气体体积多大?(3)、安全气囊中的气体是由水与过氧化钠反应产生的,化学方程式:2H2O+2Na2O2==4NaOH+O2↑,请根据化学方程式计算:此钥匙链中最少需要放入多少克过氧化钠才能浮起1千克的物体(已知氧气密度为:1.429克/升,结果保留2位小数)。