2020高考化学常考知识点专练 10:流程题
试卷更新日期:2020-06-04 类型:一轮复习
一、单选题
-
1. 某同学利用贝壳制备氢氧化钾的工艺流程如下
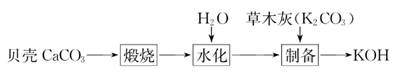
上述流程中没有涉及的化学反应类型是( )
A、化合反应 B、分解反应 C、置换反应 D、复分解反应2. 下列制备物质的工业生产流程合理的是( )A、由铝土矿冶炼铝:铝土矿 Al B、制硫酸:硫铁矿 SO2 H2SO3 H2SO4 C、由NaCl制漂白粉:NaCl(aq) Cl2 漂白粉 D、合成NH3:NH4Cl和Ca(OH)2固体 NH3 纯净干燥的氨气3. 工业上用铝土矿(主要成分为Al2O3 , 含Fe2O3等杂质)为原料冶炼铝的工艺流程如下:
对上述流程中的判断正确的是( )
A、试剂X为稀硫酸 B、结合质子( H+)的能力由强到弱的顺序是:AlO2-> OH- >CO32- C、反应II中生成Al(OH)3的反应为:CO2+AlO2- +2H2O =Al(OH)3↓+HCO3- D、Al2O3熔点很高,工业上还可采用电解熔融AlCl3冶炼Al4. 从实验室含银废液中回收Ag的流程如下:
下列说法正确的是( )
A、步骤①的操作为分液 B、步骤②中离子方程式为2Ag++Zn=2Ag+Zn2+ C、步骤②中锌不宜过量太多,否则Ag的产率降低 D、步骤③的目的是除去过量的锌5. 工业上利用无机矿物资源生产部分材料的流程图如下。下列说法不正确的是( ) A、在铝土矿制备较高纯度Al的过程中常用到NaOH溶液、CO2气体、冰晶石 B、石灰石、纯碱、石英、玻璃都属于盐,都能与盐酸反应 C、在制粗硅时,被氧化的物质与被还原的物质的物质的量之比为2∶1 D、黄铜矿(CuFeS2)与O2反应产生的Cu2S、FeO均是还原产物6. 高纯度氧化铝有广泛的用途,某研究小组用以下流程制取高纯度氧化铝:
A、在铝土矿制备较高纯度Al的过程中常用到NaOH溶液、CO2气体、冰晶石 B、石灰石、纯碱、石英、玻璃都属于盐,都能与盐酸反应 C、在制粗硅时,被氧化的物质与被还原的物质的物质的量之比为2∶1 D、黄铜矿(CuFeS2)与O2反应产生的Cu2S、FeO均是还原产物6. 高纯度氧化铝有广泛的用途,某研究小组用以下流程制取高纯度氧化铝:
以下说法不合理的是( )
A、“除杂”操作是加入过氧化氢后,用氨水调节溶液的pH约为8.0,以除去硫酸铵溶液中的少量Fe2+ . 发生的主要反应的离子方程式为2Fe2++H2O2+4NH3·H2O=2Fe(OH)3 ↓+4NH4+ B、配制硫酸铝溶液时,需用硫酸酸化的目的是抑制Al3+水解 C、“结晶”这步操作中,母液需要蒸干后才能获得铵明矾晶体(含结晶水) D、“分离”操作的名称是过滤二、实验探究题
-
7. 以下为工业从海水中提取液溴的流程图:
 (1)、当进行步骤①时,应关闭活塞 , 打开活塞。
(1)、当进行步骤①时,应关闭活塞 , 打开活塞。
(2)、已知:溴的沸点为 59 ℃,微溶于水,有毒性。某同学利用下图装置进行步骤①至步骤④的实验,请回答:

步骤②中可根据现象,简单判断热空气的流速。
(3)、步骤③中简单判断反应完全的依据是。(4)、步骤⑤用下图装置进行蒸馏。装置 C 中直接加热不合理,应改为 , 蒸馏时冷凝水应从端进入(填“e”或“f”), F 的作用是。 8. 用含锌废渣(主要含Zn以及少量S、Fe、Mn、Cd等)制取氧化锌(ZnO)的工艺流程如图
8. 用含锌废渣(主要含Zn以及少量S、Fe、Mn、Cd等)制取氧化锌(ZnO)的工艺流程如图
回答下列问题:
(1)、“酸浸”时,锌、铁的浸出率如图(a)所示,应控制浸取终点的pH为。 (2)、“氧化”时,Fe2+、Mn2+去除率与温度的关系如图(b)所示,相同条件下还原性较强的是(填“Fe2+”或“Mn2+”),Fe2+被KMnO4氧化生成Fe3+和MnO2的离子方程式为。(3)、加Zn粉“操作”的目的是。(4)、“沉锌”的离子方程式为 , 由碱式碳酸锌制备轻质氧化锌的方法是。
(2)、“氧化”时,Fe2+、Mn2+去除率与温度的关系如图(b)所示,相同条件下还原性较强的是(填“Fe2+”或“Mn2+”),Fe2+被KMnO4氧化生成Fe3+和MnO2的离子方程式为。(3)、加Zn粉“操作”的目的是。(4)、“沉锌”的离子方程式为 , 由碱式碳酸锌制备轻质氧化锌的方法是。三、综合题
-
9. 海洋是人类巨大的资源宝库,如图为从海水中提取金属镁的简易流程图。
 (1)、海洋中含量最多的物质是。(2)、实验室中进行操作1时,玻璃棒的作用是。(3)、生石灰转化为石灰乳的过程是反应(选填“吸热”或“放热”)。(4)、上述流程中未涉及到的基本反应类型是反应。10. 氧化铁黄(化学式为FeOOH)是一种黄色颜料,工业上用废铁为主要原料生产氧化铁黄的一种工艺流程如下:
(1)、海洋中含量最多的物质是。(2)、实验室中进行操作1时,玻璃棒的作用是。(3)、生石灰转化为石灰乳的过程是反应(选填“吸热”或“放热”)。(4)、上述流程中未涉及到的基本反应类型是反应。10. 氧化铁黄(化学式为FeOOH)是一种黄色颜料,工业上用废铁为主要原料生产氧化铁黄的一种工艺流程如下: (1)、氧化铁黄中铁元素的化合价为 , 废铁在反应前常用热的纯碱溶液清洗表面油污,其原理是 (写离子方程式)。(2)、氧化过程生成氧化铁黄的化学方程式是。(3)、上述流程中,检验“洗涤”是否完全的方法是。(4)、氧化时应控制pH的合理范围是3.5-4.0,pH过小导致氧化铁黄产率较低的可能原因是。11. 以废镍(含NiO,杂质为少量Fe2O3)生产Ni2O3的一种工艺流程如下:
(1)、氧化铁黄中铁元素的化合价为 , 废铁在反应前常用热的纯碱溶液清洗表面油污,其原理是 (写离子方程式)。(2)、氧化过程生成氧化铁黄的化学方程式是。(3)、上述流程中,检验“洗涤”是否完全的方法是。(4)、氧化时应控制pH的合理范围是3.5-4.0,pH过小导致氧化铁黄产率较低的可能原因是。11. 以废镍(含NiO,杂质为少量Fe2O3)生产Ni2O3的一种工艺流程如下: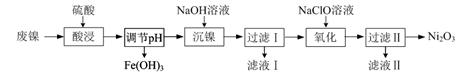 (1)、“酸浸”时为了提高酸浸的速率(浸取率),可采取的措施有(任写出一条)。(2)、“酸浸”时Fe2O3发生反应的离子方程式:。(3)、“调节pH”使溶液中的Fe3+沉淀完全(离子浓度≤10-5 mol·L-1时,离子沉淀完全),则需维持c(OH-)不低于 [已知Fe(OH)3的Ksp=4×10-38 , ≈1.6 ]。(4)、“沉镍”的目的是将溶液中的Ni2+转化为Ni(OH)2沉淀,确认Ni2+已经完全沉淀的实验方法是。(5)、“滤液Ⅱ”所含阴离子主要为Cl- , 写出“氧化”时反应的离子方程式:。(6)、以Fe、Ni为电极制取Na2FeO4的原理如图所示。通电后,在铁电极附近生成紫红色的 。电解时阳极的电极反应式为 , 离子交换膜(b)为(填“阴”或“阳”)离子交换膜。
(1)、“酸浸”时为了提高酸浸的速率(浸取率),可采取的措施有(任写出一条)。(2)、“酸浸”时Fe2O3发生反应的离子方程式:。(3)、“调节pH”使溶液中的Fe3+沉淀完全(离子浓度≤10-5 mol·L-1时,离子沉淀完全),则需维持c(OH-)不低于 [已知Fe(OH)3的Ksp=4×10-38 , ≈1.6 ]。(4)、“沉镍”的目的是将溶液中的Ni2+转化为Ni(OH)2沉淀,确认Ni2+已经完全沉淀的实验方法是。(5)、“滤液Ⅱ”所含阴离子主要为Cl- , 写出“氧化”时反应的离子方程式:。(6)、以Fe、Ni为电极制取Na2FeO4的原理如图所示。通电后,在铁电极附近生成紫红色的 。电解时阳极的电极反应式为 , 离子交换膜(b)为(填“阴”或“阳”)离子交换膜。 12. 铁及其化合物在日常生产生活中用途广泛,利用FeSO4制备还原铁粉的工业流程如下:
12. 铁及其化合物在日常生产生活中用途广泛,利用FeSO4制备还原铁粉的工业流程如下:
实验室中可用FeSO4(用铁粉和稀硫酸反应制得)和NH4HCO3溶液在如下装置模拟上述流程中的“转化”环节。
 (1)、装置A的仪器名称是 , 装置B中盛放的药品是。(2)、实验过程中,欲将生成的FeSO4溶液和NH4HCO3溶液混合,操作方法是。FeSO4溶液要现用现配制的原因是。(3)、干燥过程的主要目的是脱去产物FeCO3中的游离水,该过程中会有少量FeCO3在空气中被氧化为FeOOH,该反应的化学方程式为 , 取干燥后的FeCO3样品24.98 g,与炭混合后焙烧,最终得到还原铁粉12.32 g,计算样品中FeCO3的质量分数%(计算结果取整数)。
(1)、装置A的仪器名称是 , 装置B中盛放的药品是。(2)、实验过程中,欲将生成的FeSO4溶液和NH4HCO3溶液混合,操作方法是。FeSO4溶液要现用现配制的原因是。(3)、干燥过程的主要目的是脱去产物FeCO3中的游离水,该过程中会有少量FeCO3在空气中被氧化为FeOOH,该反应的化学方程式为 , 取干燥后的FeCO3样品24.98 g,与炭混合后焙烧,最终得到还原铁粉12.32 g,计算样品中FeCO3的质量分数%(计算结果取整数)。 (4)、高铁酸钠(Na2FeO4)是一种新型净水剂.用如图装置可以制取少量高铁酸钠.写出在用电解法制取高铁酸钠时,阳极的电极反应式(5)、25 ℃时,Ksp[Fe(OH)3]=4.0×10-38 , 此温度下,若实验室中配制2.5mol/L 100mL硫酸铁溶液,为使配制过程中不出现浑浊,则至少需要加入10mol/L的硫酸mL(忽略加入硫酸的体积)。
(4)、高铁酸钠(Na2FeO4)是一种新型净水剂.用如图装置可以制取少量高铁酸钠.写出在用电解法制取高铁酸钠时,阳极的电极反应式(5)、25 ℃时,Ksp[Fe(OH)3]=4.0×10-38 , 此温度下,若实验室中配制2.5mol/L 100mL硫酸铁溶液,为使配制过程中不出现浑浊,则至少需要加入10mol/L的硫酸mL(忽略加入硫酸的体积)。