山东省潍坊市2020年高考化学二模试卷
试卷更新日期:2020-06-03 类型:高考模拟
一、选择题
-
1. 高分子材料在疫情防控和治疗中起到了重要的作用。下列说法正确的是( )A、聚乙烯是生产隔离衣的主要材料,能使酸性高锰酸钾溶液褪色 B、聚丙烯酸树脂是3D打印护目镜镜框材料的成分之一,可以与NaOH溶液反应 C、天然橡胶是制作医用无菌橡胶手套的原料,它是异戊二烯发生缩聚反应的产物 D、聚乙二醇可用于制备治疗新冠病毒的药物,聚乙二醇的结构简式为
 2. 曲酸和脱氧曲酸是非常有潜力的食品添加剂,具有抗菌抗癌作用,其结构如图所示。下列叙述错误的是( )
2. 曲酸和脱氧曲酸是非常有潜力的食品添加剂,具有抗菌抗癌作用,其结构如图所示。下列叙述错误的是( ) A、两物质都能使溴的四氯化碳溶液褪色 B、曲酸经消去反应可得脱氧曲酸 C、1mol脱氧曲酸最多能与3molH2发生加成反应 D、曲酸与脱氧曲酸中含有相同种类的官能团3. 用化学沉淀法去除粗盐中的杂质离子,包括粗盐溶解、加沉淀剂、过滤、调节pH、蒸发结晶等步骤。下列说法错误的是( )A、沉淀剂的添加顺序可以是NaOH溶液、BaCl2溶液、Na2CO3溶液 B、向滤液中滴加盐酸,调节pH至滤液呈中性 C、蒸发结晶时,当蒸发皿中出现较多固体时,停止加热,利用余热将滤液蒸干 D、溶解、过滤、蒸发结晶等过程都使用玻璃棒搅拌溶液4. 最新发现C3O2是金星大气的成分之一,化学性质与CO相似。C3O2分子中不含环状结构且每个原子均满足8电子稳定结构。下列叙述错误的是( )A、元素的第一电离能:O>C B、3p轨道上有1对成对电子的基态X原子与基态O原子的性质相似 C、C3O2中C原子的杂化方式为sp3 D、C3O2分子中σ键和π键的个数比为1:15. 芘经氧化后可用于染料合成。芘的一种转化路线如下:
A、两物质都能使溴的四氯化碳溶液褪色 B、曲酸经消去反应可得脱氧曲酸 C、1mol脱氧曲酸最多能与3molH2发生加成反应 D、曲酸与脱氧曲酸中含有相同种类的官能团3. 用化学沉淀法去除粗盐中的杂质离子,包括粗盐溶解、加沉淀剂、过滤、调节pH、蒸发结晶等步骤。下列说法错误的是( )A、沉淀剂的添加顺序可以是NaOH溶液、BaCl2溶液、Na2CO3溶液 B、向滤液中滴加盐酸,调节pH至滤液呈中性 C、蒸发结晶时,当蒸发皿中出现较多固体时,停止加热,利用余热将滤液蒸干 D、溶解、过滤、蒸发结晶等过程都使用玻璃棒搅拌溶液4. 最新发现C3O2是金星大气的成分之一,化学性质与CO相似。C3O2分子中不含环状结构且每个原子均满足8电子稳定结构。下列叙述错误的是( )A、元素的第一电离能:O>C B、3p轨道上有1对成对电子的基态X原子与基态O原子的性质相似 C、C3O2中C原子的杂化方式为sp3 D、C3O2分子中σ键和π键的个数比为1:15. 芘经氧化后可用于染料合成。芘的一种转化路线如下:
下列叙述正确的是( )
A、芘的一氯代物有4种 B、甲分子中所有碳原子一定都在同一平面上 C、1mol乙与足量NaOH溶液反应,最多消耗2molNaOH D、甲催化氧化后,再发生酯化反应也能得到乙6. 短周期主族元素X、Y、Z、W的原子序数依次增大。Z原子2p轨道上有3个未成对电子。甲、乙、丙、丁、戊是这四种元素之间形成的化合物,75%的甲溶液常用于消毒,戊是Z和X组成的10电子分子,常温下己溶液显中性,它们有如下转化关系:
则下列说法中错误的是( )
A、四种元素原子半径由大到小的顺序为:Y>Z>W>X B、W的氢化物中的某一种具有漂白性 C、丙的电子式为 D、W的氢化物沸点一定比Y的氢化物沸点高
7. SiO2是合成“中国蓝”的重要原料之一。如图是SiO2晶胞中Si原子沿z轴方向在xy平面的投影图(即俯视投影图,O原子略去。),Si原子旁标注的数字是Si原子位于z轴的高度,则SiA与SiB的距离是( )
D、W的氢化物沸点一定比Y的氢化物沸点高
7. SiO2是合成“中国蓝”的重要原料之一。如图是SiO2晶胞中Si原子沿z轴方向在xy平面的投影图(即俯视投影图,O原子略去。),Si原子旁标注的数字是Si原子位于z轴的高度,则SiA与SiB的距离是( ) A、 B、 d C、 d D、d8. 根据下列实验操作和现象能得到相应结论的是( )
A、 B、 d C、 d D、d8. 根据下列实验操作和现象能得到相应结论的是( )选项
实验操作和现象
结论
A
向苯酚钠溶液中通入足量CO2 , 溶液变浑浊
酸性:H2CO3>C6H5OH>HCO3-
B
向KBrO3溶液中通入少量Cl2 , 然后再加入少量苯,有机层呈橙红色
氧化性:Cl2>Br2
C
将等浓度等体积的KI溶液和FeCl3溶液混合,充分反应后滴入KSCN溶液,溶液变红
溶液中存在平衡:2Fe3++2I- 2Fe2++I2
D
向2支均盛有2mL相同浓度银氨溶液的试管中,分别滴入2滴相同浓度的KCl、KI溶液,前者无明显现象,后者有黄色沉淀
Kap(AgI)>Kap(AgCl)
A、A B、B C、C D、D9. 铋酸钠(NaBiO3) 是分析化学中的重要试剂,不溶于冷水,遇沸水或酸则迅速分解。某化学兴趣小组设计下图实验装置制取铋酸钠。装置丙中盛有Bi(OH)3(难溶于水) 与NaOH溶液混合物。下列说法错误的是( ) A、装置乙中盛装的试剂是饱和食盐水 B、装置丙中发生反应的离子方程式是:Bi(OH)3+3OH-+Na++Cl2=NaBiO3+2Cl-+3H2O C、从装置丙中获得产品的操作为:在冰水中冷却结晶、过滤、洗涤、干燥 D、为除去所得固体中混有的Bi(OH)3 , 可用稀盐酸洗涤10. 金属铬(Cr) 常用于制造不锈钢和仪器仪表的金属表面镀铬。由FeCr2O4 , (亚铬酸亚铁)制备Cr的流程如下(+6价铬元素在酸性条件下以Cr2O72-的形式存在)。下列说法错误的是( )
A、装置乙中盛装的试剂是饱和食盐水 B、装置丙中发生反应的离子方程式是:Bi(OH)3+3OH-+Na++Cl2=NaBiO3+2Cl-+3H2O C、从装置丙中获得产品的操作为:在冰水中冷却结晶、过滤、洗涤、干燥 D、为除去所得固体中混有的Bi(OH)3 , 可用稀盐酸洗涤10. 金属铬(Cr) 常用于制造不锈钢和仪器仪表的金属表面镀铬。由FeCr2O4 , (亚铬酸亚铁)制备Cr的流程如下(+6价铬元素在酸性条件下以Cr2O72-的形式存在)。下列说法错误的是( ) A、FeCr2O4中Cr元素的化合价为+3价 B、反应①中参加反应的FeCr2O4和Na2CO3的物质的量之比为3:1 C、反应③的化学方程式为Na2Cr2O7+2C Cr2O3+Na2CO3+CO↑ D、反应④中的Si可用Al来代替
A、FeCr2O4中Cr元素的化合价为+3价 B、反应①中参加反应的FeCr2O4和Na2CO3的物质的量之比为3:1 C、反应③的化学方程式为Na2Cr2O7+2C Cr2O3+Na2CO3+CO↑ D、反应④中的Si可用Al来代替二、不定项选择题
-
11. 燃煤工业锅炉烟气中含有1%~3%的CO和0.02%~0.04%的NO,在新型催化剂作用下可消除CO和NO两种有害气体,反应机理如图所示,在反应过程中CO可被O2氧化。下列说法中正确的是( )
 A、温度越高越有利于有害气体消除 B、O2浓度越大催化除杂效果越好 C、催化反应的速率由氧化吸附过程决定 D、总反应方程式为2NO+2CO=N2+2CO212. 锂/氟化碳电池稳定性很高。电解质为LiClO4的乙二醇二甲醚溶液,总反应为xLi+CFx=xLiF+C,放电产物LiF沉积在正极,工作原理如图所示。下列说法正确的是( )
A、温度越高越有利于有害气体消除 B、O2浓度越大催化除杂效果越好 C、催化反应的速率由氧化吸附过程决定 D、总反应方程式为2NO+2CO=N2+2CO212. 锂/氟化碳电池稳定性很高。电解质为LiClO4的乙二醇二甲醚溶液,总反应为xLi+CFx=xLiF+C,放电产物LiF沉积在正极,工作原理如图所示。下列说法正确的是( )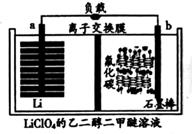 A、正极的电极反应式为CFx+xe-+xLi+=xLiF+C B、交换膜为阴离子交换膜 C、电解质溶液可用LiClO4的乙醇溶液代替 D、b极电势高于a极电势13. 四氧化钌(RuO4)是金黄色针状晶体,微溶于水,有强氧化性,能氧化浓盐酸生成Cl2和Ru³+。酸性介质中固体Na2RuO4与NaClO溶液或NaClO3溶液反应均可制得RuO4。下列说法正确的是( )A、若NaClO3与Na2RuO4物质的量之比1:3, 则还原产物为Cl2 B、RuO4与浓盐酸反应生成11.2LCl2 转移电子数为NA C、酸性介质中氧化性:RuO4>ClO3->Cl2 D、在稀硫酸环境中,Na2RuO4与NaClO反应制备RuO4的化学方程式为Na2RuO4+NaClO+H2SO4=RuO4+Na2SO4+NaCl+H2O14. 一种新型的电解废水处理技术是以活性炭为电极板和粒子凝胶颗粒填充的电解装置(如图所示)。用该装置电解过程中产生的羟基自由基(·OH)氧化能力极强,能氧化苯酚为CO2、H2O。下列说法错误的是( )
A、正极的电极反应式为CFx+xe-+xLi+=xLiF+C B、交换膜为阴离子交换膜 C、电解质溶液可用LiClO4的乙醇溶液代替 D、b极电势高于a极电势13. 四氧化钌(RuO4)是金黄色针状晶体,微溶于水,有强氧化性,能氧化浓盐酸生成Cl2和Ru³+。酸性介质中固体Na2RuO4与NaClO溶液或NaClO3溶液反应均可制得RuO4。下列说法正确的是( )A、若NaClO3与Na2RuO4物质的量之比1:3, 则还原产物为Cl2 B、RuO4与浓盐酸反应生成11.2LCl2 转移电子数为NA C、酸性介质中氧化性:RuO4>ClO3->Cl2 D、在稀硫酸环境中,Na2RuO4与NaClO反应制备RuO4的化学方程式为Na2RuO4+NaClO+H2SO4=RuO4+Na2SO4+NaCl+H2O14. 一种新型的电解废水处理技术是以活性炭为电极板和粒子凝胶颗粒填充的电解装置(如图所示)。用该装置电解过程中产生的羟基自由基(·OH)氧化能力极强,能氧化苯酚为CO2、H2O。下列说法错误的是( ) A、阳极电极反应为2H2O-4e-=O2↑+4H+ B、H+通过离子交换膜向阴极移动 C、苯酚被氧化的化学方程式为C6H5OH+28·OH=6CO2↑+17H2O D、每转移0.7mole-两极室共产生气体体积为11.2L(标况)15. 常温下,用AgNO3溶液分别滴定浓度均为0.01mol·L-1的KSCN、K2CrO4溶液,所得的沉淀溶解平衡图像如图所示。下列叙述错误的是( )
A、阳极电极反应为2H2O-4e-=O2↑+4H+ B、H+通过离子交换膜向阴极移动 C、苯酚被氧化的化学方程式为C6H5OH+28·OH=6CO2↑+17H2O D、每转移0.7mole-两极室共产生气体体积为11.2L(标况)15. 常温下,用AgNO3溶液分别滴定浓度均为0.01mol·L-1的KSCN、K2CrO4溶液,所得的沉淀溶解平衡图像如图所示。下列叙述错误的是( ) A、Ksp(Ag2CrO4)的数值为10-9.92 B、a点表示的是Ag2CrO4的不饱和溶液 C、沉淀废液中的Ag+用K2CrO4溶液比等浓度的KSCN溶液效果好 D、Ag2CrO4(s)+2SCN-(aq) 2AgSCN(s)+CrO4²-(aq)的平衡常数为1012.08
A、Ksp(Ag2CrO4)的数值为10-9.92 B、a点表示的是Ag2CrO4的不饱和溶液 C、沉淀废液中的Ag+用K2CrO4溶液比等浓度的KSCN溶液效果好 D、Ag2CrO4(s)+2SCN-(aq) 2AgSCN(s)+CrO4²-(aq)的平衡常数为1012.08三、非选择题
-
16. 我国采用的Cu2O/TiO2-NaBiO3光催化氧化技术能深度净化工业含有机物的废水。回答下列问题:(1)、钛(Ti)的基态原子M能层中能量不同的电子有种。(2)、该技术能有效将含有机物废水中的农药、醇、油等降解为水、二氧化碳、硝酸根离子等小分子。
①H2O、CH3OH、HO一
 分子中O-H键的极性最强的是。
分子中O-H键的极性最强的是。②C、N、O三种元素的电负性由大到小的顺序是。
(3)、将少量无水硫酸铜溶解在水中,形成蓝色溶液,再加入过量氨水,溶液变为深蓝色。深蓝色离子的结构如图所示,1mol该离子中所含σ键为mol(包括配位键);向深蓝色溶液中缓慢加入乙醇,得到深蓝色晶体,加热该晶体先失去组分b的原因是 。 (4)、铋合金具有凝固时不收缩的特性,用于铸造高精度铸型。金属铋的结构示意图如图1所示,其晶胞结构如图2所示。若铋原子的半径为rpm,则该晶体的密度为g·cm-3(用含r和N数学表达式表示)。
(4)、铋合金具有凝固时不收缩的特性,用于铸造高精度铸型。金属铋的结构示意图如图1所示,其晶胞结构如图2所示。若铋原子的半径为rpm,则该晶体的密度为g·cm-3(用含r和N数学表达式表示)。 17. 1,3-丁二烯是重要的化工原料,工业上常用1-丁烯催化脱氢的方法制备。将0.1mol 1-丁烯和0.675mol水蒸气组成的混合气,在80kPa恒压下进行反应:
17. 1,3-丁二烯是重要的化工原料,工业上常用1-丁烯催化脱氢的方法制备。将0.1mol 1-丁烯和0.675mol水蒸气组成的混合气,在80kPa恒压下进行反应:CH3CH2CH=CH2(g) CH2=CHCH=CH2(g)+H2(g)△H。
请回答下列问题:
(1)、已知化学键键能数据如下,由此计算△H=kJ·mol-1。化学键
C-C
C=C
C-H
H-H
键能/kJ·mol-1
348
612
412
436
(2)、下图表示脱氢反应中温度对1-丁烯的平衡转化率的影响,工业生产通常控制反应温度为600℃。
①请解释工业生产控制温度在600℃的原因 。
②此温度下反应进行2.5h后达到平衡,从开始反应到建立平衡,以H2表示的反应速率为v(H2)=kPa·h-1;脱氢反应的平衡常数Kp=kPa(Kp为以分压表示的平衡常数,P分=P总×物质的量分数)。
(3)、在密闭容器中反应达到平衡后,再充入1.575mol 1-丁烯和1.625mol 1,3-丁二烯,化学反应向 (填“正反应”、“逆反应”或“不移动”)方向进行。18. 氯化亚铜(CuCl)是一种重要的化工原料,常用作催化剂、杀菌剂。化学小组用下图装置(部分夹持装置略去)制备氯化亚铜。
已知:①氯化亚铜是一种白色固体,能溶于氨水,微溶于水,不溶于酒精;在空气中会被迅速氧化。
②在酸性条件下,某些中间价态的离子能发生自身氧化还原反应。
实验步骤:
Ⅰ.打开分液漏斗活塞,向三颈瓶中加盐酸调pH至2~3。打开活塞K,通入SO2 , 溶液中产生白色沉淀,待反应完全后,再通一段时间的气体。
Ⅱ.将反应混合液过滤、洗涤、干燥得CuCl粗产品,纯化后得CuCl产品。
回答下列问题
(1)、装置B的作用是。(2)、步骤Ⅰ中通入SO2发生反应的离子方程式是。(3)、步骤Ⅱ中采用抽滤法过滤的主要目的是;用95%的乙醇代替蒸馏水洗涤的优点是。(4)、化学小组同学在实验过程中,将分液漏斗中的0.1mol·L-1盐酸换为6mol·L-1盐酸,通入SO2 , 最终未得到白色沉淀。①对此现象有如下猜想:
猜想一:Cl-浓度过大,与CuCl发生反应
小组同学对猜想一的原理进行深入研究,查阅资料知:CuCl+Cl- CuCl2- , 据此设计实验:将上述未得到沉淀的溶液 (填操作),若观察到有白色沉淀析出,证明猜想一正确。
②猜想二:。
设计验证猜想二是否成立的实验方案。
19. “稀土之父”徐光宪对稀土萃取分离做出了巨大贡献。稀土是隐形战机、超导、核工业等高精尖领域必备的原料。钪(Sc)是稀土金属之一,下图是制备Sc的工艺流程。
已知:xNH4Cl·yScF3·Zh2O是ScF3与氯化物形成的复盐沉淀,在强酸中部分溶解。“脱水除铵”是复盐沉淀的热分解过程。
据此回答:
(1)、在空气中焙烧Sc2(C2O4)3 , 只生成一种碳氧化物的化学方程式为。(2)、图1是含Sc元素的离子与F-浓度和pH的关系。用氨水调节溶液pH,调节3.5<pH<4.2原因是。 (3)、图2是“脱水除铵”过程中固体质量与温度的关系,其中在380℃到400℃会有白烟冒出,保温至无烟气产生,即得到ScF3 , 由图像中数据计算复盐中x:z= ;工艺流程中可回收利用的物质是。
(3)、图2是“脱水除铵”过程中固体质量与温度的关系,其中在380℃到400℃会有白烟冒出,保温至无烟气产生,即得到ScF3 , 由图像中数据计算复盐中x:z= ;工艺流程中可回收利用的物质是。 (4)、传统制备ScF3的方法是先得到ScF3·6H2O沉淀,再高温脱水得ScF3 , 但通常含有ScOF杂质,原因是(用化学方程式表示)。流程中将复盐沉淀后“脱水除铵”制得纯度很高的ScF3 , 其原因是 。20. DL一m一酪氨酸是一种营养增补剂,能提高人体的免疫力。一种合成DL一m一酪氨酸的路线如下:
(4)、传统制备ScF3的方法是先得到ScF3·6H2O沉淀,再高温脱水得ScF3 , 但通常含有ScOF杂质,原因是(用化学方程式表示)。流程中将复盐沉淀后“脱水除铵”制得纯度很高的ScF3 , 其原因是 。20. DL一m一酪氨酸是一种营养增补剂,能提高人体的免疫力。一种合成DL一m一酪氨酸的路线如下:
已知:
①

②

③

回答下列问题:
(1)、A的化学名称为 ,F中含氧官能团的名称是 。(2)、E到F的反应类型为。(3)、写出D到E的化学方程式 。(4)、化合物M是一种α-氨基酸,是H的同分异构体。满足以下条件的M的同分异构体有种。i.环上有两个处于邻位上的取代基,与FeCl3溶液不能发生显色反应;
ii.1molM与足量金属钠反应产生1.5molH2。
其中分子中存在两个手性碳原子,且能在浓硫酸催化加热条件下发生消去反应而消除旋光性,该异构体的结构简式为 (已知:分子中存在手性碳原子的分子叫作手性分子,手性分子具有旋光性)。
(5)、 ,是合成药物扑热息疼的中间体。设计由苯酚和ClCH2-O-CH3制备
,是合成药物扑热息疼的中间体。设计由苯酚和ClCH2-O-CH3制备  的合成路线 (无机试剂任选)。
的合成路线 (无机试剂任选)。