2020高考化学常考知识点专练 09:物质结构与性质
试卷更新日期:2020-06-01 类型:一轮复习
一、单选题
-
1. 已知C3N4晶体很可能具有比金刚石更大的硬度,且原子间以单键结合。下列有关C3N4晶体的说法中正确的是( )A、C3N4晶体是分子晶体 B、C3N4晶体中C—N键的键长比金刚石中的C—C键的键长长 C、C3N4晶体中C、N原子个数之比为4∶3 D、C3N4晶体中粒子间通过共价键相结合
-
2. 下列说法不正确的是( )A、含有离子键和共价键的化合物一定是离子化合物 B、Na投入到水中,有共价键的断裂与形成 C、液态水转变为气态水需要吸热,说明旧键断裂吸收的能量大于新键形成放出的能量 D、N2和NCl3两种分子中,每个原子的最外层都具有8电子稳定结构
-
3. 请阅读下列材料,回答问题。
联合国将2019年定为“国际化学元素周期表年”,以纪念门捷列夫发现元素周期律150周年。元素周期律把元素及其化合物纳入一个统一的理论体系,为系统研究元素及其化合物提供了科学方法,为发现和探索新元素、新物质提供了有效思路。
(1)、为纪念门捷列夫,科学家将1955年人工合成的一种新元素用符号“Md”表示,中文命名为“钔”。核素 Md的质量数为( )A、101 B、157 C、258 D、359(2)、Mg和Si都属于元素周期表第3周期元素,它们原子结构中相同的是( )A、质子数 B、电子层数 C、核外电子数 D、最外层电子数(3)、判断Cl的非金属性比S的强,可依据的事实是( )A、HCl的热稳定性比H2S的强 B、氯气能溶于水,硫难溶于水 C、常温下,氯单质呈气态,硫单质呈固态 D、AgCl是白色固体,Ag2S是黑色固体(4)、锂是第2周期ⅠA族元素,下列有关锂元素性质推测正确的是( )A、最高化合价为+2 B、原子半径比钠的大 C、单质与水的反应比钠更剧烈 D、最高价氧化物对应的水化物碱性比钠的弱 -
4. 下列变化过程中无化学键断裂或生成的是( )A、石墨转化为金刚石 B、NaCl晶体溶于水 C、干冰升华 D、氮的固定
-
5. W、X、Y、Z是同周期主族元素,Y的最外层电子数是X次外层电子数的3倍,四种元素与锂组成的盐是一种新型的锂离子电池的电解质(结构如图,箭头指向表示共同电子对由W提供)。下列说法不正确的是( )
 A、W的非金属性比Y的强 B、在该物质中Ⅹ原子满足8电子稳定结构 C、该物质中含离子键和共价键 D、Z的氧化物都易溶于水中
A、W的非金属性比Y的强 B、在该物质中Ⅹ原子满足8电子稳定结构 C、该物质中含离子键和共价键 D、Z的氧化物都易溶于水中 -
6. 2mol金属钠和1mol氯气反应的能量关系如图所示,下列说法不正确的( )
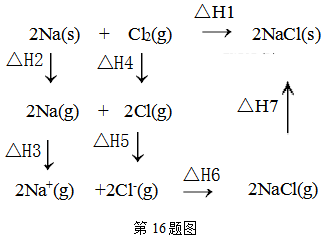 A、△H2+△H3+△H4+△H5+△H6+△H7=△H1 B、△H4的值数值上和Cl-Cl共价键的键能相等 C、△H5<0,在相同条件下,2Br(g)的△H5′<△H5 D、△H7<0,且该过程形成离子键
A、△H2+△H3+△H4+△H5+△H6+△H7=△H1 B、△H4的值数值上和Cl-Cl共价键的键能相等 C、△H5<0,在相同条件下,2Br(g)的△H5′<△H5 D、△H7<0,且该过程形成离子键 -
7. 下列各原子或离子的电子排列式错误的是( )A、Na+1s22s22p6 B、F¯1s22s22p6 C、N3+1s22s22p6 D、O2¯1s22s22p6
二、综合题
-
8. C、Si、Ge、Sn是同族元素,该族元素单质及其化合物在材料、医药等方面有重要应用。请回答下列问题:(1)、Si的原子核外价电子排布图为(2)、金刚石的结构是正四面体则其中的碳原子杂化方式是(3)、按要求指出下列氧化物的空间构型、成键方式或性质
①CO2分子的空间构型及碳氧之间的成键方式;
②CO可以和很多金属形成配合物,如Ni(CO)4 , Ni与CO之间的键型为;
③乙烯的分子是C2H4 , 是根据其结构推断是分子(填 “极性”或“非极性”)
(4)、碳氧键的红外伸缩振动频率与键的强度成正比,已知Ni(CO)4中碳氧键的伸缩振动频率为2060cm-1 , CO分子中碳氧键的伸缩振动频率为2143cm-1 , 则Ni(CO)4中碳氧键的强度比CO分子中碳氧键的强度__________(填字母)A、强 B、弱 C、相等 D、无法判断 -
9. 有A,B,C,D四种元素,其中A元素和B元素的原子都有1个未成对电子,A+比B-少一个电子层,B原子得一个电子填入3p轨道后,3p轨道已充满;C原子的p轨道中有3个未成对电子,其气态氢化物在水中的溶解度在同族元素所形成的氢化物中最大;D的最高化合价和最低化合价的代数和为4,其最高价氧化物中含D的质量分数为 40%,且其核内质子数等于中子数。R是由A、D两元素形成的离子化合物,其中A+与D2-离子数之比为2∶1。
回答下列问题:
 (1)、A元素形成的晶体属于A2密堆积型式,则其晶体内晶胞类型应属于(填写“六方”、“面心立方”或“体心立方”)。(2)、B-的电子排布式为 , 在CB3分子中C元素原子的原子轨道发生的是杂化。(3)、C的氢化物的空间构型为 , 其氢化物在同族元素所形成的氢化物中沸点最高的原因是。(4)、B元素的电负性D元素的电负性(填“>”、“<”或“=”);用一个化学方程式说明。(5)、如图所示是R形成的晶体的晶胞,设晶胞的棱长为a cm。试计算R晶体的密度为。(阿伏加德罗常数用NA表示)
(1)、A元素形成的晶体属于A2密堆积型式,则其晶体内晶胞类型应属于(填写“六方”、“面心立方”或“体心立方”)。(2)、B-的电子排布式为 , 在CB3分子中C元素原子的原子轨道发生的是杂化。(3)、C的氢化物的空间构型为 , 其氢化物在同族元素所形成的氢化物中沸点最高的原因是。(4)、B元素的电负性D元素的电负性(填“>”、“<”或“=”);用一个化学方程式说明。(5)、如图所示是R形成的晶体的晶胞,设晶胞的棱长为a cm。试计算R晶体的密度为。(阿伏加德罗常数用NA表示) -
10. 祖母绿被称为绿宝石之王,是国际珠宝世界公认的四大名贵宝石之一,其化学式为Be3Al2Si6O18。回答下列问题:(1)、基态Be原子的电子排布图为 , 基态Al原子核外电子占据个轨道,其中能量最高能级的原子轨道的形状为。(2)、Al、Si、O的第一电离能由大到小的排序为。(3)、SO3分子中硫原子的杂化类型是 , SO3分子的空间构型是。(4)、工业上,电解制取金属铝,不能用熔融的AlCl3 , AlCl3的晶体类型是 , 将Be3Al2Si6O18写为氧化物的式子是。(5)、LiAlH4在有机合成中可将羧基还原成羟基。甲酸和乙醇的熔、沸点如图所示:

1mol甲酸分子中σ键与π键的比值为 , 甲酸和乙醇的熔点相差较大的主要原因是。
 (6)、碳化硅的晶体类型类似金刚石,晶胞结构如图所示。已知:碳化硅的晶体密度为ag/cm3 , NA代表阿伏加德罗常数的数值。该晶胞边长为pm。
(6)、碳化硅的晶体类型类似金刚石,晶胞结构如图所示。已知:碳化硅的晶体密度为ag/cm3 , NA代表阿伏加德罗常数的数值。该晶胞边长为pm。 -
11. A,B,C,D,E,F 为前四周期元素且原子序数依次增大,其中基态 A 原子的电子分布在 3 个能级,且每个能级所含的电子数相同; C 的原子核外最外层有 6 个运动状态不同的电子; D 是短周期元素中电负性最小的元素; E 的最高价氧化物的水化物酸性最强; 基态 F 原子核外最外层只有一个电子, 其余能层均充满电子。 G 元素与 D 元素同主族,且相差 3 个周期。(1)、元素 A, B, C 的第一电离能由小到大的是(用元素符号表示)。(2)、E的最高价含氧酸中 E 原子的杂化方式为。 基态 E 原子中,核外电子占据最高能级的电子云轮廓形状为。(3)、F原子的外围电子排布式为 , F 单质晶体中原子的堆积方式是下图中的(填写“甲”、 “乙”或“丙”) ,该晶体的空间利用率为。
 (4)、已知元素 A、B形成的(AB)2分子中所有原子都满足 8电子稳定结构,则其分子中 σ键与 π键数目之比为。(5)、通常情况下, D 单质的熔沸点比 G 单质高,原因是。(6)、已知 DE 晶体的晶胞如下图所示:
(4)、已知元素 A、B形成的(AB)2分子中所有原子都满足 8电子稳定结构,则其分子中 σ键与 π键数目之比为。(5)、通常情况下, D 单质的熔沸点比 G 单质高,原因是。(6)、已知 DE 晶体的晶胞如下图所示: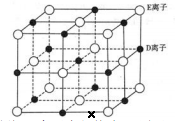
若将 DE 晶胞中的所有 E 离子去掉,并将 D 离子全部换为 A 原子,再在其中的 4 个“小立方体”中心各放置一个A 原子,且这 4 个“小立方体”不相邻。位于“小立方体”中的 A 原子与最近的 4 个 A 原子以单键相连,由此表示 A的一种晶体的晶胞(已知 A—A 键的键长为a cm, NA表示阿伏加德罗常数),则该晶胞中含有个 A 原子,该晶体的密度是g·cm-3(列式表示) 。
-
12. 微量元素硼对植物生长及人体健康有着十分重要的作用,也广泛应用于新型材料的制备。(1)、基态硼原子的价电子轨道表达式是。与硼处于同周期且相邻的两种元素和硼的第一电离能由大到小的顺序为。(2)、晶体硼单质的基本结构单元为正二十面体,其能自发地呈现多面体外形,这种性质称为晶体的。(3)、B的简单氢化物BH3不能游离存在,常倾向于形成较稳定的B2H6或与其他分子结合。

①B2H6分子结构如图,则B原子的杂化方式为
②氨硼烷(NH3BH3)被认为是最具潜力的新型储氢材料之一,分子中存在配位键,提供孤电子对的成键原子是 , 写出一种与氨硼烷互为等电子体的分子(填化学式)。
(4)、以硼酸(H3BO3)为原料可制得硼氢化钠(NaBH4),它是有机合成中的重要还原剂。BH4-的立体构型为。(5)、磷化硼(BP)是受高度关注的耐磨材料,可作为金属表面的保护层,其结构与金刚石类似,晶胞结构如图所示。
磷化硼晶胞沿z轴在平面的投影图中,B原子构成的几何形状是。
-
13. 黄铜矿是主要的炼铜原料,CuFeS2是其中铜的主要存在形式。回答下列问题:(1)、CuFeS2中存在的化学键类型是。其组成的三种元素中电负性较强的是 。(2)、下列基态原子或离子的价层电子排布图正确的。
 (3)、在较低温度下CuFeS2与浓硫酸作用时,有少量臭鸡蛋气味的气体X产生。
(3)、在较低温度下CuFeS2与浓硫酸作用时,有少量臭鸡蛋气味的气体X产生。①X分子的立体构型是 , 中心原子杂化类型为 , 属于(填“极性”或“非极性”)分子。
②X的沸点比水低的主要原因是。
(4)、CuFeS2与氧气反应生成SO2 , 其结构式为 ,则SO2中共价键类型有。 (5)、四方晶系CuFeS2晶胞结构如图所示。
,则SO2中共价键类型有。 (5)、四方晶系CuFeS2晶胞结构如图所示。
①Cu+的配位数为 ,
②已知:a=b=0.524 nm,c=1.032 nm,NA为阿伏加德罗常数的值,CuFeS2晶体的密度是g•cm3(列出计算式)。
