广东、河南、湖南、湖北四省2020年高三联考模拟试卷
试卷更新日期:2020-05-29 类型:高考模拟
一、选择题
-
1. 在抗击“2019新型冠状病毒”的过程中,大量防护和消毒用品投入使用。下列有关说法正确的是( )A、二氧化氯泡腾片和酒精均可杀灭新型冠状病毒,二者的消毒原理相同 B、聚丙烯和聚四氟乙烯为生产防护服的主要原料,二者均属于有机高分子材料 C、真丝织品和棉纺织品可代替无纺布生产防护口罩,二者均可防止病毒渗透 D、保持空气湿度和适当降温可减少新型冠状病毒传染,二者均可防止病毒滋生2. 化合物M(
 )是合成一种抗癌药物的重要中间体,下列关于M的说法正确的是( ) A、所有原子不可能处于同一平面 B、可以发生加聚反应和缩聚反应 C、与
)是合成一种抗癌药物的重要中间体,下列关于M的说法正确的是( ) A、所有原子不可能处于同一平面 B、可以发生加聚反应和缩聚反应 C、与 互为同分异构体.
D、1 mol M最多能与1mol Na2CO3反应
3. 短周期主族元素W、X、Y 、Z的原子序数依次增大,W、X同主族,Y原子的最外层电子数等于X原子的电子总数,Z原子的电子总数等于W、X、Y三种原子的电子数之和,Z的最高价氧化物对应水化物的化学式为HnZO2n+2。W、X、Y三种元素形成的一种化合物的结构如下图所示。下列说法不正确的是( )
互为同分异构体.
D、1 mol M最多能与1mol Na2CO3反应
3. 短周期主族元素W、X、Y 、Z的原子序数依次增大,W、X同主族,Y原子的最外层电子数等于X原子的电子总数,Z原子的电子总数等于W、X、Y三种原子的电子数之和,Z的最高价氧化物对应水化物的化学式为HnZO2n+2。W、X、Y三种元素形成的一种化合物的结构如下图所示。下列说法不正确的是( )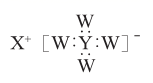 A、W的最高正价和最低负价的代数和为0 B、W的简单离子半径可能大于X的简单离子半径 C、Y的最高价氧化物对应的水化物属于弱碱 D、Z的单质的水溶液需保存在棕色试剂瓶中4. 天然气是一种重要的化工原料和燃料,常含有少量H2S。一种在酸性介质中进行天然气脱硫的原理示意图如图所示。下列说法正确的是( )
A、W的最高正价和最低负价的代数和为0 B、W的简单离子半径可能大于X的简单离子半径 C、Y的最高价氧化物对应的水化物属于弱碱 D、Z的单质的水溶液需保存在棕色试剂瓶中4. 天然气是一种重要的化工原料和燃料,常含有少量H2S。一种在酸性介质中进行天然气脱硫的原理示意图如图所示。下列说法正确的是( ) A、脱硫过程中Fe2(SO4)3溶液的pH逐渐减小 B、CH4是天然气脱硫过程的催化剂 C、脱硫过程需不断补充FeSO4 D、整个脱硫过程中参加反应的n(H2S):n(O2)=2:15. 近年来,有科研工作者提出可用如图所示装置进行水产养殖用水的净化处理。该装置工作时,下列说法不正确的是( )
A、脱硫过程中Fe2(SO4)3溶液的pH逐渐减小 B、CH4是天然气脱硫过程的催化剂 C、脱硫过程需不断补充FeSO4 D、整个脱硫过程中参加反应的n(H2S):n(O2)=2:15. 近年来,有科研工作者提出可用如图所示装置进行水产养殖用水的净化处理。该装置工作时,下列说法不正确的是( ) A、导线中电子由M电极流向a极 B、N极的电极反应式为2NO3-+10e-+12H+=N2↑+6H2O C、当电路中通过24 mol电子的电量时,理论上有1 mol (C6H10O5)n参加反应 D、当生成1 mol N2时,理论上有10 mol H+通过质子交换膜6. 实验小组从富含NaBr的工业废水中提取Br2的过程主要包括:氧化、萃取、分液、蒸馏等步骤。已知:可能用到的数据信息和装置如下。
A、导线中电子由M电极流向a极 B、N极的电极反应式为2NO3-+10e-+12H+=N2↑+6H2O C、当电路中通过24 mol电子的电量时,理论上有1 mol (C6H10O5)n参加反应 D、当生成1 mol N2时,理论上有10 mol H+通过质子交换膜6. 实验小组从富含NaBr的工业废水中提取Br2的过程主要包括:氧化、萃取、分液、蒸馏等步骤。已知:可能用到的数据信息和装置如下。
下列说法不正确的是( )
A、实验时,①的废水中出现红色 B、②的作用是吸收尾气,防止空气污染 C、用③进行萃取时,选择CCl4比乙苯更合理 D、④中温度计水银球低于支管过多,导致Br2的产率低7. 已知:25 ℃时,MOH的Kb=10-7。该温度下,在20.00 mL0.1 mol· L-1 MCl溶液中滴入0.1 mol·L-1NaOH溶液,溶液的pH与所加NaOH溶液的体积关系如图所示。下列说法不正确的是( ) A、a=4 B、V1=10 C、溶液中水的电离程度:P>Q D、Q点溶液中c(Na+)<2c(M+)
A、a=4 B、V1=10 C、溶液中水的电离程度:P>Q D、Q点溶液中c(Na+)<2c(M+)二、非选择题
-
8. 硫酸锰是一.种重要的化工原料,在农业、电化学和建筑等领域均有广泛应用。以含锰废料(含有MnO2 、CuO、Fe和少量CaO)为原料制备MnSO4的一种流程如下:
 已知:
已知:I .烧渣中含有MnO、CuO、Cu、Fe、CaO。
II.难溶电解质的溶度积常数如下表所示:

回答下列问题:
(1)、“焙烧”过程加入煤粉的主要作用为。(2)、“酸浸”时所加稀H2SO4不宜过量太多的原因为.滤渣1的主要成分为(填化学式)。(3)、“氧化”过程中主要反应的离子方程式为。(4)、“调pH为4”的目的为;若“溶液”中c(Cu2+ )=0.022 mol/L,“滤液2”的体积是“溶液”体积的2倍,则“调pH为4”时Cu2+是否开始沉淀(通过计算说明)。(5)、(NH4)2S的电子式为。(6)、已知:(NH4)2SO4与MnSO4的溶解度曲线如图所示。“操作”主要包括蒸发浓缩、过滤 、洗涤、干燥;其中用乙醇代替水洗涤的原因为 , 需控制温度为( 填选项字母)得到产品最多。A.10℃ B.40 ℃ C.60 ℃ D.100℃
 9. 氢氧化铈[Ce(OH)4]被广泛用于气敏传感器、燃料电池、催化剂等领域。实验室以精选的氟碳铈矿(主要成分为CeFCO3 )为原料制备氢氧化铈的一种工艺流程如下:
9. 氢氧化铈[Ce(OH)4]被广泛用于气敏传感器、燃料电池、催化剂等领域。实验室以精选的氟碳铈矿(主要成分为CeFCO3 )为原料制备氢氧化铈的一种工艺流程如下:
回答下列问题:
(1)、“煅烧”可在(填仪器名称)中进行,主要反应的化学方程式为;除“粉碎”外,还可以加快“煅烧”速率的措施有(只答一点即可)。(2)、实验室制取氧气。
①氧气的发生装置可以选择上图中的(填大写字母)。
②欲收集一瓶干燥的氧气,选择上图中的装置,按气流方向的连接顺序为:氧气的发生装置→(填小写字母);检验氧气已收集满的操作和现象为。
(3)、“酸浸”时,温度不能过高的原因为;若用盐酸代替双氧水、H2SO4的不足之处为;该步骤不能使用陶瓷容器的原因为。(4)、“氧化”反应的化学方程式为。10. 肼(N2H4)和氨均为重要的化工原料。回答下列问题:已知:I.N2H4(l)+O2(g) N2(g)+2H2O(l) △H=-624.0 kJ/mol
II.N2(g)+3H2(g) 2NH3(g) △H=-92.4 kJ/mol
III.2NH3(g) N2H4(l)+H2(g) △H=+144.8 kJ/mol
(1)、H2的燃烧热△H=。(2)、T1 ℃时,向恒容的密闭容器中加入1 mol N2H4和1 mol O2 , 发生反应I。达到平衡后,只改变下列条件,能使N2的平衡体积分数增大的是_______( 填选项字母)。A、增大压强 B、再通入一定量O2 C、分离出部分水 D、降低温度(3)、在恒压绝热的密闭容器中通入一定量的N2和H2 , 发生反应II和反应III。反应III对N2的平衡转化率的影响为(填“增大”“减小”或“无影响”),理由为。(4)、t2℃时,向刚性容器中充入NH3 , 发生反应III。NH3和H2的分压(p)与时间(t)的关系如图所示。
①0~t1min内,反应的平均速率v(NH3)=kPa/min
②反应的平衡常数Kp=kPa-1 (Kp为用分压表示的平衡常数)。
③反应物分子的有效碰撞几率:MN(填“>”“<”或“=”)。
④t2 min时升高温度,再次达到平衡后,H2的分压增大的原因为。
11. Li、Fe、As均为重要的合金材料,NA为阿伏加德罗常数的值。回答下列问题:(1)、基态Li原子核外电子占据的空间运动状态有个,占据最高能层电子的电子云轮廓图形状为。(2)、Li的焰色反应为紫红色,很多金属元素能产生焰色反应的原因为。(3)、基态Fe3+比基态Fe2+稳定的原因为。(4)、KSCN和K4[Fe(CN)6]均可用于检验Fe3+。①SCN-的立体构型为 , 碳原子的杂化方式为。
②K4[Fe(CN)6]中所含元素的第一电离能由大到小的顺序为(用元素符号表示);1 mol [Fe(CN)6]4-中含有σ键的数目为。
(5)、H3AsO3的酸性弱于H3AsO4的原因为。(6)、Li、Fe和As可组成一种新型材料,其立方晶胞结构如图所示。若晶胞参数为a nm,阿伏加德罗常数的值为NA , 则该晶体的密度可表示为g●cm-3。(列式即可) 12. 化合物M是制备一种抗菌药的中间体,实验室以芳香化合物A为原料制备M的一种合成路线如下:
12. 化合物M是制备一种抗菌药的中间体,实验室以芳香化合物A为原料制备M的一种合成路线如下:
已知:R1CH2Br
 R1CH=CHR2
R1CH=CHR2 
回答下列问题:
(1)、A的结构简式为;B中官能团的名称为;C的化学名称为。(2)、由C生成D所需的试剂和条件为 , 该反应类型为.(3)、由F生成M的化学方程式为。(4)、Q为M的同分异构体,满足下列条件的Q的结构有种(不含立体异构),任写出其中一.种核磁共振氢谱中有4组吸收峰的结构简式。①除苯环外无其他环状结构
②能发生水解反应和银镜反应
(5)、参照上述合成路线和信息,以乙烯和乙醛为原料(无机试剂任选),设计制备聚2-丁烯的合成路线。