吉林省2020年高考理综-化学二模试卷
试卷更新日期:2020-05-29 类型:高考模拟
一、选择题
-
1. 关于新型冠状病毒,下来说法不正确的是( )A、该病毒主要通过飞沫和接触传播 B、为减少传染性,出门应戴好口罩 C、该病毒属于双链的DNA病毒,不易变异 D、该病毒可用“84消毒液”进行消毒2. 实验室制备硝基苯的实验装置如图所示(夹持装置已略去)。下列说法不正确的是( )
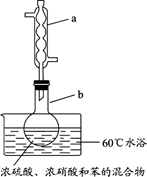 A、水浴加热的优点为使反应物受热均匀、容易控制温度 B、浓硫酸、浓硝酸和苯混合时,应先向浓硝酸中缓缓加入浓硫酸,待冷却至室温后,再将苯逐滴滴入 C、仪器a的作用是冷凝回流,提高原料的利用率 D、反应完全后,可用仪器a、b蒸馏得到产品3. 萜类化合物广泛存在于动植物体内,某萜类化合物如下图所示,下列说法正确的是( )
A、水浴加热的优点为使反应物受热均匀、容易控制温度 B、浓硫酸、浓硝酸和苯混合时,应先向浓硝酸中缓缓加入浓硫酸,待冷却至室温后,再将苯逐滴滴入 C、仪器a的作用是冷凝回流,提高原料的利用率 D、反应完全后,可用仪器a、b蒸馏得到产品3. 萜类化合物广泛存在于动植物体内,某萜类化合物如下图所示,下列说法正确的是( ) A、此萜类化合物的化学式为C10H14O B、该有机物属于芳香烃 C、分子中所有碳原子均处于同一平面上 D、在浓硫酸、加热条件下,可生成两种芳香烯烃4. W、X、Y、Z是原子序数依次增大的短周期元素,X、Y是金属元素,X的焰色呈黄色。W、Z最外层电子数相同,Z的核电荷数是W的2倍。工业上一般通过电解氧化物的方法获得Y的单质,则下列说法不正确的是( )A、W、X、Y形成的简单离子核外电子数相同 B、Y和Z形成的化合物可以通过复分解反应制得 C、Z和W可形成原子个数比为1∶2和1∶3的共价化合物 D、X、Y和Z三种元素形成的最高价氧化物对应的水化物能两两反应5. 热催化合成氨面临的两难问题是:采用高温增大反应速率的同时会因平衡限制导致NH3产率降低。我国科研人员研制了Ti-H-Fe双温区催化剂(Ti-H区域和Fe区域的温度差可超过100℃)。Ti-H-Fe双温区催化合成氨的反应历程如图所示,其中吸附在催化剂表面上的物种用*标注。下列说法正确的是( )
A、此萜类化合物的化学式为C10H14O B、该有机物属于芳香烃 C、分子中所有碳原子均处于同一平面上 D、在浓硫酸、加热条件下,可生成两种芳香烯烃4. W、X、Y、Z是原子序数依次增大的短周期元素,X、Y是金属元素,X的焰色呈黄色。W、Z最外层电子数相同,Z的核电荷数是W的2倍。工业上一般通过电解氧化物的方法获得Y的单质,则下列说法不正确的是( )A、W、X、Y形成的简单离子核外电子数相同 B、Y和Z形成的化合物可以通过复分解反应制得 C、Z和W可形成原子个数比为1∶2和1∶3的共价化合物 D、X、Y和Z三种元素形成的最高价氧化物对应的水化物能两两反应5. 热催化合成氨面临的两难问题是:采用高温增大反应速率的同时会因平衡限制导致NH3产率降低。我国科研人员研制了Ti-H-Fe双温区催化剂(Ti-H区域和Fe区域的温度差可超过100℃)。Ti-H-Fe双温区催化合成氨的反应历程如图所示,其中吸附在催化剂表面上的物种用*标注。下列说法正确的是( ) A、①为N N的断裂过程 B、① ③在高温区发生,②④⑤在低温区发生 C、④为N原子由Fe区域向Ti-H区域的传递过程 D、使用Ti-H-Fe双温区催化剂使合成氨反应转变为吸热反应6. pC类似pH,如图为CO2的水溶液中加入强酸或强碱溶液后,平衡时溶液中各种组分的pC - pH图。依据图中信息,下列说法不正确的是( )
A、①为N N的断裂过程 B、① ③在高温区发生,②④⑤在低温区发生 C、④为N原子由Fe区域向Ti-H区域的传递过程 D、使用Ti-H-Fe双温区催化剂使合成氨反应转变为吸热反应6. pC类似pH,如图为CO2的水溶液中加入强酸或强碱溶液后,平衡时溶液中各种组分的pC - pH图。依据图中信息,下列说法不正确的是( ) A、 不能在同一溶液中大量共存 B、H2CO3电离平衡常数 C、人体血液里主要通过碳酸氢盐缓冲体系( )可以抵消少量酸或碱,维持pH =7.4,但当过量的酸进入血液中时,血液缓冲体系中的 最终将变大 D、pH =9时,溶液中存在关系7. 如图所示是一种以液态肼(N2H4)为燃料氧气为氧化剂,某固体氧化物为电解质的新型燃料电池。该固体氧化物电解质的工作温度高达700—900℃时,O2—可在该固体氧化物电解质中自由移动,反应生成物均为无毒无害的物质。下列说法正确的是( )
A、 不能在同一溶液中大量共存 B、H2CO3电离平衡常数 C、人体血液里主要通过碳酸氢盐缓冲体系( )可以抵消少量酸或碱,维持pH =7.4,但当过量的酸进入血液中时,血液缓冲体系中的 最终将变大 D、pH =9时,溶液中存在关系7. 如图所示是一种以液态肼(N2H4)为燃料氧气为氧化剂,某固体氧化物为电解质的新型燃料电池。该固体氧化物电解质的工作温度高达700—900℃时,O2—可在该固体氧化物电解质中自由移动,反应生成物均为无毒无害的物质。下列说法正确的是( ) A、电池内的O2—由电极甲移向电极乙 B、电池总反应为N2H4+2O2=2NO+2H2O C、当甲电极上有1molN2H4消耗时,标况下乙电极上有22.4LO2参与反应 D、电池外电路的电子由电极乙移向电极甲
A、电池内的O2—由电极甲移向电极乙 B、电池总反应为N2H4+2O2=2NO+2H2O C、当甲电极上有1molN2H4消耗时,标况下乙电极上有22.4LO2参与反应 D、电池外电路的电子由电极乙移向电极甲二、非选择题
-
8. 某混合物浆液含Al(OH)3、MnO2和少量Na2CrO4。考虑到胶体的吸附作用使Na2CrO4不易完全被水浸出,某研究小组利用设计的电解分离装置(见图2),使浆液分离成固体混合物和含铬元素溶液,并回收利用。回答Ⅰ和Ⅱ中的问题。
 (1)、Ⅰ.固体混合物的分离和利用(流程图中的部分分离操作和反应条件未标明)
(1)、Ⅰ.固体混合物的分离和利用(流程图中的部分分离操作和反应条件未标明)反应①所加试剂NaOH的电子式为 , B→C的反应条件为 , C→Al的制备方法称为。
(2)、该小组探究反应②发生的条件。D与浓盐酸混合,不加热,无变化;加热有Cl2生成,当反应停止后,固体有剩余,此时滴加硫酸,又产生Cl2。由此判断影响该反应有效进行的因素有(填序号)。a.温度 b.Cl-的浓度 c.溶液的酸度
(3)、0.1 mol Cl2与焦炭、TiO2完全反应,生成一种还原性气体和一种易水解成TiO2·xH2O的液态化合物,放热4.28 kJ,该反应的热化学方程式为。(4)、Ⅱ.含铬元素溶液的分离和利用用惰性电极电解时,CrO42-能从浆液中分离出来的原因是 , 分离后含铬元素的粒子是;阴极室生成的物质为(写化学式)。
9. 氮的化合物是重要的工业原料,也是主要的大气污染来源,研究氮的化合物的反应具有重要意义。回答下列问题:(1)、肼(N2H4)与四氧化二氮分别是火箭发射器中最常用的燃料与氧化剂。已知3.2g液态肼与足量液态四氧化二氮完全反应,生成氮气和液态水放出热量61. 25 kJ,则该反应的热化学方程式为。(2)、尾气中的NO2可以用烧碱溶液吸收的方法来处理,其中能生成NaNO2等物质,该反应的离子方程式为。(3)、在773 K时,分别将2.00 mol N2和6.00 mol H2充入一个固定容积为1 L的密闭容器中发生反应生成NH3 , 气体混合物中c(N2)、c(H2)、c(NH3)与反应时间(t)的关系如图所示。
①下列能说明反应达到平衡状态的是(选填字母)。
a.v正(N2)=3v逆(H2) b.体系压强不变
c.气体平均相对分子质量不变 d.气体密度不变
②在此温度下,若起始充入4. 00 mol N2和12. 00 mol H2 , 则反应刚达到平衡时,表示 c(H2)~t的曲线上相应的点为 (选填字母)。
(4)、在373 K时,向体积为2L的恒容真空容器中充入0.40mol NO2 , 发生如下反应:测得NO2的体积分数[φ(NO2)]与反应时间(t)的关系如下表:
t/min
0
20
40
60
80
φ(NO2)
1.0
0.75
0.52
0.40
0.40
①计算0~20min时,v(N2O4)=。
②已知该反应 ,其中k1、k2为速率常数,则373K时, =;改变温度至T1时,k1=k2 , 则T1 373 K(填“>”“<”或“=”)。
10. 是一种绿色易溶于水的晶体,广泛用于化学镀镍、生产电泡等。可由电镀废渣(除镍元素外,还含有Cu、Zn、Fe、Cr等元素杂质)为原料获得。工艺流程如下:
已知:① 是一种不溶于水易溶于强酸的沉淀;②已知 , 的 。
(1)、Ni的原子序数为28,则它在周期表中的位置为 , 写出H2O2的结构式。(2)、步骤②,向滤液I中加入适量 溶液的目的是除去Cu2+和 ,其中除去Cu2+的离子方程式为;加 之前需控制pH不能太低的目的是。(3)、步骤③的目的是除去Fe和Cr,温度不能太高的原因是。若在 时,调pH=4除去铁,此时溶液中 。(4)、粗镍中含有少量Fe、Zn、Cu、Pt等杂质,可用电解法制备高纯度镍,下列叙述正确的是___(已知:氧化性Fe2+<Ni2+<Cu2+)A、粗镍作阳极,纯镍作阴极 B、阳极发生还原反应,其电极反应式: C、电解过程中,阳极质量的减少与阴极质量的增加相等 D、电解后,溶液中存在的金属阳离子只有Cu2+和 E、电解后,电解槽底部的阳极泥中只有Cu和Pt11.(1)、已知A和B均为第3周期元素,其原子的第一至第四电离能如下表所示:
A通常显价,A的电负性B的电负性(填“>”“<”或“=”)。
(2)、紫外光的光子所具有的能量约为399kJ·mol-1。根据下表有关蛋白质分子中重要化学键的信息,说明人体长时间照射紫外光后皮肤易受伤害的原因。
组成蛋白质的最简单的氨基酸中的碳原子杂化类型是。
(3)、实验证明:KCl、MgO、CaO、TiN这4种晶体的结构与NaCl晶体结构相似(如图所示),其中3种离子晶体的晶格能数据如下表:

则该4种离子晶体(不包括NaCl)熔点从高到低的顺序是:。其中MgO晶体中一个Mg2+周围和它最邻近且等距离的Mg2+有个。
(4)、金属阳离子含有的未成对电子越多,则磁性越大,磁记录性能越好。离子型氧化物V2O5和CrO2中,适合作录音带磁粉原料的是。(5)、某配合物的分子结构如图所示,其分子内不含有___(填序号)。 A、离子键 B、极性键 C、金属键 D、配位键 E、氢键 F、非极性键(6)、科学家设计反应:CO2+4H2→CH4+2H2O以减小空气中的CO2。若有1molCH4生成,则有molσ键和molπ键断裂。12. 含氧有机物甲可用来制取多种有用的化工产品,合成路线如图:
A、离子键 B、极性键 C、金属键 D、配位键 E、氢键 F、非极性键(6)、科学家设计反应:CO2+4H2→CH4+2H2O以减小空气中的CO2。若有1molCH4生成,则有molσ键和molπ键断裂。12. 含氧有机物甲可用来制取多种有用的化工产品,合成路线如图:
已知:Ⅰ.RCHO

Ⅱ.RCOOH
 RCOCl
RCOCl  RCOOR’(R、R’代表烃基)(1)、甲的含氧官能团的名称是。写出检验该官能团常用的一种化学试剂的名称。(2)、写出己和丁的结构简式:己 , 丁。(3)、乙有多种同分异构体,属于甲酸酯,含酚羟基,且酚羟基与酯的结构在苯环邻位的同分异构体共有种。(4)、在NaOH溶液中发生水解反应时,丁与辛消耗NaOH的物质的量之比为。(5)、庚与M合成高分子树脂的化学方程式为。
RCOOR’(R、R’代表烃基)(1)、甲的含氧官能团的名称是。写出检验该官能团常用的一种化学试剂的名称。(2)、写出己和丁的结构简式:己 , 丁。(3)、乙有多种同分异构体,属于甲酸酯,含酚羟基,且酚羟基与酯的结构在苯环邻位的同分异构体共有种。(4)、在NaOH溶液中发生水解反应时,丁与辛消耗NaOH的物质的量之比为。(5)、庚与M合成高分子树脂的化学方程式为。