河北省邯郸市2020年中考化学模拟试卷
试卷更新日期:2020-05-27 类型:中考模拟
一、选择题
-
1. 化学与健康生活息息相关。下列做法不正确的是( )A、学生营养餐提供牛奶、馒头、蔬菜和水果等 B、为使海产品长期保鲜,用甲醛溶液浸泡 C、误食重金属盐,可以喝些牛奶或蛋清应急解毒 D、适量食用加碘盐可以补充微量元素碘,预防甲状腺肿大2. 下列有关空气的说法中,不正确的是( )A、空气的成分按体积计算,含量最高的氮气 B、稀有气体可制成多种用途的电光源 C、二氧化碳是一种空气污染物 D、植树造林有利于保护空气3. 如图所示的实验操作符合题意且能达到目的的是( )A、
 稀释浓硫酸
B、
稀释浓硫酸
B、 除去氢气中的水蒸气
C、
除去氢气中的水蒸气
C、 加热高锰酸钾制氧气
D、
加热高锰酸钾制氧气
D、 量取液体
4. 下列宏观事实对应的微观解释正确的是( )A、金刚石和石墨的物理性质差异大—原子的种类不同 B、H2O和H2O2的化学性质不同—分子间的间隔不同 C、公园里闻到花的香味—分子在不断运动 D、把液化石油气压缩进钢瓶—分子体积变大5. 下列关于氧气的说法正确的是( )A、氧气具有可燃性,可以支持燃烧 B、水生动物能在水中生存是因为氧气易溶于水 C、工业上利用分离液态空气的方法制取氧气 D、氧气的化学性质很活泼,常温下能与所有物质发生化学反应6. 如图某反应的微观示意图,不同的球代表不同元素的原子,下列说法正确的是()
量取液体
4. 下列宏观事实对应的微观解释正确的是( )A、金刚石和石墨的物理性质差异大—原子的种类不同 B、H2O和H2O2的化学性质不同—分子间的间隔不同 C、公园里闻到花的香味—分子在不断运动 D、把液化石油气压缩进钢瓶—分子体积变大5. 下列关于氧气的说法正确的是( )A、氧气具有可燃性,可以支持燃烧 B、水生动物能在水中生存是因为氧气易溶于水 C、工业上利用分离液态空气的方法制取氧气 D、氧气的化学性质很活泼,常温下能与所有物质发生化学反应6. 如图某反应的微观示意图,不同的球代表不同元素的原子,下列说法正确的是() A、化学反应前后,分子种类不变 B、参加反应的
A、化学反应前后,分子种类不变 B、参加反应的 和
和  的微粒个数比是1:1
C、反应涉及的物质中,只有
的微粒个数比是1:1
C、反应涉及的物质中,只有  属于氧化物
D、在化学变化中,分子可分,原子不可分
7. 如图是a、b、c三种固体物质(不含结晶水)的溶解度曲线。下列叙述正确的是( )
属于氧化物
D、在化学变化中,分子可分,原子不可分
7. 如图是a、b、c三种固体物质(不含结晶水)的溶解度曲线。下列叙述正确的是( )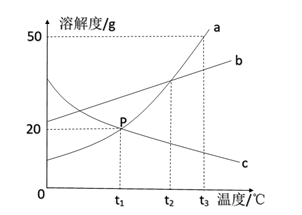 A、t1℃时,a、c两种物质饱和溶液的溶质质量分数为20% B、将接近饱和的c物质的溶液变成饱和溶液,可采用加溶质、降温等方法 C、将a、b、c三种物质的饱和溶液从t2℃降温至t1℃,所得溶液中溶质质量分数的大小关系为b>a=c D、将150g a物质的饱和溶液从t3℃降温至t1℃,可析出30g a物质8. 为达到实验目的,下列实验方案设计合理的是( )
A、t1℃时,a、c两种物质饱和溶液的溶质质量分数为20% B、将接近饱和的c物质的溶液变成饱和溶液,可采用加溶质、降温等方法 C、将a、b、c三种物质的饱和溶液从t2℃降温至t1℃,所得溶液中溶质质量分数的大小关系为b>a=c D、将150g a物质的饱和溶液从t3℃降温至t1℃,可析出30g a物质8. 为达到实验目的,下列实验方案设计合理的是( )选项
实验目的
实验方案
A
除去CO中的HCl气体
将气体通过NaOH溶液,再通过浓硫酸
B
验证甲烷中含有碳、氢两种元素
点燃甲烷,在火焰上方罩一内壁附着石灰水的烧杯,观察现象
C
探究燃烧的条件之一是温度达到物质的着火点
用棉花分别蘸酒精和水,放在酒精灯火焰上加热片刻,观察现象
D
鉴别稀盐酸、NaOH 溶液、K2CO3溶液、(NH4)2CO3落液
取样,相互滴加,观察现象
A、A B、B C、C D、D9. 推理是学习化学的一种重要方法,下列推理合理的是( )A、中和反应生成盐和水,生成盐和水的反应都是中和反应 B、有机化合物都含有碳元素,含有碳元素的化合物都属于有机化合物 C、单质中只含有一种元素,只含有一种元素的纯净物物一定是单质 D、同种元素的微粒质子数相同,质子数相同的微粒一定属于同种元素10. 下列图像能正确反映其对应变化关系的是( )A、 某温度下,将一定量饱和的氯化钠溶液恒温蒸发
B、
某温度下,将一定量饱和的氯化钠溶液恒温蒸发
B、 相同质量的等质量分数的盐酸分别与足量的固体反应
C、
相同质量的等质量分数的盐酸分别与足量的固体反应
C、 向一定量氯化铜和稀盐酸的混合溶液中逐滴加入氢氧化钠溶液
D、
向一定量氯化铜和稀盐酸的混合溶液中逐滴加入氢氧化钠溶液
D、 往盛有硫酸铜溶液的烧杯中加入铁粉至过量
往盛有硫酸铜溶液的烧杯中加入铁粉至过量
二、非选择题
-
11. 化学与生活、生产密切相关。请回答下列问题:(1)、生活中可用比较自来水煮沸前后的硬度。(2)、写出用作蒸馒头的发酵粉的主要成分的化学式。(3)、清洗油盘子和碗时通常要用到洗涤灵,是利用原理将油污除去的。(4)、铵态氮肥不能与混合施用,否则会降低肥效。(5)、少吃腌制食品,这些食品中含有亚硝酸钠(NaNO2),亚硝酸钠中氮元素的化合价为。(6)、下列生活中的物品属于有机合成材料的是(填字母)
A 棉花 B 木筷子 C 铝合金窗框 D 塑料薄膜
(7)、酒精是我们实验是中常见的燃料,写出燃烧的化学方程式。12. 化学实验是学习化学的基础,请根据下列教材基本实验装置图回答问题。 (1)、图甲是硫燃烧的实验。硫在瓶内、外燃烧现象不同,说明燃烧的剧烈程度与有关;瓶中水的作用是。(2)、图乙是验证质量守恒定律的实验。若实验中红磷用量太少,对实验结果(选填“有”或“无”)影响。(3)、图丙是“探究铁的锈蚀条件”中的一组对比实验,实验的目的是探究铁生锈的条件之一是 , 其中试管②中的水要事先煮沸,目的是。13. A~H是初中化学常见的物质,其中A是大理石的主要成分,反应①为中和反应,反应中部分生成物已略去。请回答下列问题:
(1)、图甲是硫燃烧的实验。硫在瓶内、外燃烧现象不同,说明燃烧的剧烈程度与有关;瓶中水的作用是。(2)、图乙是验证质量守恒定律的实验。若实验中红磷用量太少,对实验结果(选填“有”或“无”)影响。(3)、图丙是“探究铁的锈蚀条件”中的一组对比实验,实验的目的是探究铁生锈的条件之一是 , 其中试管②中的水要事先煮沸,目的是。13. A~H是初中化学常见的物质,其中A是大理石的主要成分,反应①为中和反应,反应中部分生成物已略去。请回答下列问题: (1)、物质C的化学式为。(2)、反应③(填“是”或“否”)基本反应类型。(3)、物质E在生活中常见的用途是。(4)、写出反应④的化学方程式。14. 某兴趣小组为探究金属活动性强弱,分别做了镁、铝、铜与稀盐酸反应的实验。(1)、比较金属活动性强弱:铝比铜(填“强”或“弱”)。写出镁与稀盐酸反应的化学方程式:(2)、小芳同学做镁与稀盐酸反应的实验时,发现试管中出现灰白色沉淀,该小组同学对灰白色沉淀的成分进行如下探究:
(1)、物质C的化学式为。(2)、反应③(填“是”或“否”)基本反应类型。(3)、物质E在生活中常见的用途是。(4)、写出反应④的化学方程式。14. 某兴趣小组为探究金属活动性强弱,分别做了镁、铝、铜与稀盐酸反应的实验。(1)、比较金属活动性强弱:铝比铜(填“强”或“弱”)。写出镁与稀盐酸反应的化学方程式:(2)、小芳同学做镁与稀盐酸反应的实验时,发现试管中出现灰白色沉淀,该小组同学对灰白色沉淀的成分进行如下探究:[提出假设]假设一:含有氯化镁
假设二:含有镁粉
假设三:含有氢氧化镁
……
[查阅资料]①氯化镁易溶于水:
②在一定条件下镁可与冷水缓慢反应。
[设计并进行实验]各取少量灰白色沉淀加入2支试管中进行如下实验:
编号
实验操作
实验现象
实验1
加入适量蒸馏水、搅拌
沉淀未见减少
实验2
加入适量稀盐酸
沉淀全部溶解,没有气泡产生
[得出结论]由实验1可知,假设不成立;由实验2可知,沉淀中不含。
(3)、假设三(填“成立”或“可能成立”或“不成立”)。(4)、[实验反思]实验后同学们请教老师得知,灰白色沉淀的主要成分是碱式氯化镁,碱式氯化镁受热易分解产生氯化氢气体。于是小芳再取少量灰白色沉淀于试管中加热,并将蘸有紫色石蕊溶液的滤纸条悬于试管口,预期的实验现象是(5)、为探究镁与稀盐酸反应生成碱式氯化镁的条件.该小组同学进行了如下实验:在小烧杯中加入一定量的盐酸和去除氧化膜的镁带,观察实验现象,并测量溶液pH的变化。结果见下表:时间/min
0
2
4
8
12
16
20
24
溶液pH
2.0
5.3
7.0
8.6
9.3
9.8
10.0
10.0
实验现象
-
镁带溶解较快,产生大量气泡,无沉淀生成
镁带缓慢溶解,产生气泡速率减慢,溶液变浑浊,烧杯底部有灰白色沉淀
根据表中信息回答下列问题:
①请描述溶液pH变化的规律并解释原因:
②请对生成碱式氯化镁的条件提出猜想,并设计实验证明猜想:
15. 今年“五·一”假期,小丽随爸爸到乡下省亲,期间看到许多漂亮的大理石。于是她带了一些回来,想去学校实验室测定这些大理石中碳酸钙的含量。她称取了20克大理石样品置于烧杯中,然后将250g稀盐酸分成五等份,依次加入烧杯充分反应,记录有关实验数据如下表所示(大理石中其他成分均不溶于水,也不参与化学反应)。加入次数
一
二
三
四
五
加入稀盐酸的质量/g
50
50
50
50
50
烧杯中剩余固体的质量/g
15
10
5
5
m
试求:
(1)、m的值应为;(2)、实验中大理石样品所含碳酸钙的质量分数?(3)、实验中所用稀盐酸的溶质质量分数?