北京市海淀区首都师大二附中2020年中考化学零模试卷
试卷更新日期:2020-05-27 类型:中考模拟
一、选择题
-
1. 空气中体积分数为 21%的气体是( )A、N2 B、O2 C、CO2 D、稀有气体2. 下列物质中,属于氧化物的是( )A、NO2 B、O2 C、NH3 D、BaSO43. 下列物质中,属于纯净物的是( )A、果醋饮料 B、矿泉水 C、加碘的食盐 D、氮气4. 下列金属中,活动性最强的是( )A、铜 B、镁 C、铁 D、银5. 纯碱是指( )A、NaOH B、NaHCO3 C、NaCl D、Na2CO36. 下列数据是一些食物的近似pH(常温),其中呈碱性的是( )
pH
3.5~4.5
2.9~3.3
6.3~6.6
7.6~8.0
食物
A.葡萄汁
B.苹果汁
C.牛奶
D.鸡蛋清
A、A B、B C、C D、D7. 下列有关物质用途的叙述中,不正确的是( )A、食盐可用作调味品 B、熟石灰用于改良酸性土壤 C、盐酸可用作金属除锈 D、甲醛用于泡发鱿鱼等水产品8. 下列实验操作中,正确的是( )A、 滴加液体
B、
滴加液体
B、 过滤
C、
过滤
C、 取用粉末药品
D、
取用粉末药品
D、 点燃酒精灯
9. 下列物质露置于空气中,一段时间后,质量减小的是( )
点燃酒精灯
9. 下列物质露置于空气中,一段时间后,质量减小的是( )
A、浓盐酸 B、浓硫酸 C、氢氧化钠 D、碳酸钙10. 下列化学用语与含义相符的是( )A、FeCl3——氯化铁 B、 ——1 个钠离子 C、O2——2 个氧原子 D、2H——2 个氢元素11. 甲和乙在点燃条件下生成丙和丁,结合微观示意图分析,下列结论不正确的是( ) A、1个甲分子由5个原子构成 B、生成丙和丁的分子个数比为1:2 C、该化学反应前后,原子种类保持不变 D、丁物质中氢和氧元素质量比为2:112. 20℃时,将等质量的a、b两种固体,分别加入到盛有l00g水的烧杯中,充分搅拌后,现象如图甲,升温到50℃时,现象如图乙,a、b两种固体的溶解度曲线如图丙。下列说法正确的是( )
A、1个甲分子由5个原子构成 B、生成丙和丁的分子个数比为1:2 C、该化学反应前后,原子种类保持不变 D、丁物质中氢和氧元素质量比为2:112. 20℃时,将等质量的a、b两种固体,分别加入到盛有l00g水的烧杯中,充分搅拌后,现象如图甲,升温到50℃时,现象如图乙,a、b两种固体的溶解度曲线如图丙。下列说法正确的是( ) A、图甲溶液中溶质的质量分数a大于b B、图乙中a、b溶液一定都是饱和溶液 C、图丙中M表示a的溶解度曲线 D、30℃时a、b溶液溶质质量分数不相等
A、图甲溶液中溶质的质量分数a大于b B、图乙中a、b溶液一定都是饱和溶液 C、图丙中M表示a的溶解度曲线 D、30℃时a、b溶液溶质质量分数不相等二、非选择题
-
13. 春暖花开,老师组织同学们到郊外野炊。活动中,同学们携带了铁锅、户外便携式煤气灶、鸡蛋、面条、西红柿、食用油、食盐、味精、食醋、去污粉(有效成分为碳酸钠)等物品。请根据以上情景回答 以下两个小 题。(1)、化学与生活息息相关。
从同学们所带的食物中挑选出能为人体提供较多维生素的一种食物是(填写所选食物的名称),富含糖类的一种食物是。(填写所选食物的名称)
(2)、携带过程中,某同学不慎将装食盐、去污粉的瓶子混淆了。有的同学建议,用所带物品中的(填所携带的物品名称)就可以将它们区分开来。(3)、化学反应能提供能量。野炊时,小明点火后,小心调节野炊锅到合适的高度(如图)。这样做的主要目的是。(填序号,下同)

A 避免铁锅被烤坏 B 避免食物烤糊了 C 使用外焰加热
(4)、若加热过程中不慎失火,移走“煤气罐”,这是利用了原理灭火。A 清除可燃物 B 使可燃物与氧气隔绝 C 降低可燃物的着火点
14. 金属在生产、生活中应用广泛。(1)、一氧化碳还原氧化铁的方程式为。冶炼 16t 氧化铁,可得到铁t。(2)、铝抗腐蚀性能好,是因为铝与氧气反应,在其表面生成一层致密的氧化铝薄膜,氧化铝的化学式为。(3)、黄铜是铜锌合金,将纯铜片和黄铜片相互刻画(如图所示),纯铜片上留下明显的划痕,该实验的目的是。 15. 阅读下面科普短文。
15. 阅读下面科普短文。酸奶是以新鲜的牛奶为原料,经过杀菌后再向牛奶中添加有益菌,发酵后,再冷却灌装的一种牛奶制品。酸奶不但保留了牛奶的营养,而且某些方面更优于牛奶。
酸奶比牛奶更容易被人体消化吸收,因为在发酵过程中,牛奶中约20%的糖、蛋白质被分解成为小分子,同时产生人体所必需的多种维生素。发酵后产生的乳酸可有效提高钙、磷在人体中的吸收。
酸奶中含有大量乳酸菌,乳酸菌把乳糖转化成乳酸,使得牛奶的酸度升高。酸度可以影响酸奶的口感和营养。研究者选取某种市面常见的酸奶进行实验,数据如下图所示:

酸奶喝得过多会导致胃酸过多,影响胃黏膜及消化酶的分泌,对于健康的人来说,每天250克左右是比较合适的。而且最好不要在空腹时喝含有乳酸菌的酸奶,一般选择饭后喝效果比较好。
近年来,常温酸奶逐渐流行起来。常温酸奶和低温酸奶的加工工艺不同。低温酸奶仅在生牛乳状态时经过一道灭菌处理,乳酸菌可以存活其中,但保存条件苛刻,需低温存储,且保质期较短。而常温酸奶需要进行“巴氏灭菌热处理”,该处理方式会杀灭一切细菌,所以可以常温保存较长时间。
酸奶营养美味,建议在购买的时候,仔细看配料表,根据需求去选择。
依据文章内容回答下列问题。
(1)、新鲜牛奶制作酸奶的过程属于变化(填“物理”或“化学”)。(2)、酸奶是补钙佳品,这里的“钙”指的是_________(填字母序号)。A、钙元素 B、钙原子 C、钙单质(3)、酸奶中的蛋白质更易消化和吸收,原因是。(4)、由图中数据可知,影响酸奶酸度的因素有。(5)、下列说法中,不合理的是____________(填字母序号)。A、酸奶营养丰富,但要注意适量饮用 B、酸奶适宜在饭前饮用 C、常温酸奶中含有丰富乳酸菌 D、酸奶更有利于人体对钙的吸收16. 氯化钙应用广泛,以石灰石(杂质主要是Fe2O3、MgSO4)为原料生产氯化钙的流程如下。
已知:BaCl2 + MgSO4 = BaSO4↓+ MgCl2
Ca(OH)2 + MgCl2 = Mg(OH)2↓+ CaCl2
Ca(OH)2 + FeCl3 = Fe(OH)3↓+ CaCl2
(1)、氧化铁与盐酸反应的化学方程式为。(2)、滤液1中的溶质有HCl、FeCl3、MgSO4和。(3)、滤液2中加入Ca(OH)2是为了除去______(填序号,下同)。A、MgCl2 B、FeCl3 C、HCl(4)、滤液3呈碱性,为使溶液pH降低,可加入适量的______。A、NaCl B、NaOH C、盐酸17. 请从A或B两题中任选一个作答,若两题均作答,按A计分。
A
B
⑴图A探究二氧化碳与水反应的实验操作为。
⑵二氧化碳与水反应的化学方程式为。
⑴图 B 中,若X溶液为稀盐酸,则观察到的现象为。
⑵若 X 溶液为硫酸铜溶液,则反应的化学方程式为。
18. 下图是实验室中用于制取和收集气体的装置图,请回答以下问题: (1)、写出上图中标号①仪器的名称:。(2)、用高锰酸钾制取氧气,发生装置选择 (填字母序号,下同),反应的化学方程式为。收集装置为(3)、实验室制取二氧化碳的发生装置是。19. 利用下图装置测定空气中氧气含量。
(1)、写出上图中标号①仪器的名称:。(2)、用高锰酸钾制取氧气,发生装置选择 (填字母序号,下同),反应的化学方程式为。收集装置为(3)、实验室制取二氧化碳的发生装置是。19. 利用下图装置测定空气中氧气含量。
已知:Y型管体积(已去除胶塞占的体积)为a mL,注射器中水的体积为b mL。
实验步骤:检查气密性;用酒精灯加热红磷至燃烧;反应结束并冷却后,读取注射器中水体积为c mL。
(1)、实验中红磷和水要足量,目的是。(2)、根据实验数据,求算空气中氧气体积分数的计算式为。20. 碘化钾(KI)保存不当会变质。实验小组进行以下实验探究KI变质的因素。(提出问题) KI变质的条件是什么?
(查阅资料)
① KI为白色粉末,暴露在空气中或久置会被氧化为碘(I2)而泛黄变质。
② 碘水中含较多KI时,滴加淀粉溶液显紫色或蓝紫色
(进行实验)分别取适量KI于燃烧匙中,再分别放入盛有不同物质的集气瓶中,塞紧胶塞,若干天后观察。
实验1
实验2
实验3
实验4



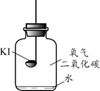
固体变潮、表面变微黄
固体无明显现象
固体变潮、无其他明显现象
固体变潮、表面变黄
继续实验:取实验1中少量微黄固体溶解,加入淀粉溶液,溶液变紫色。
取实验4中少量黄色固体溶解,加入淀粉溶液,溶液变紫色。
(解释与结论)
(1)、实验3的目的是。(2)、对比实验 , 可以得出KI变质一定与水有关。(3)、从上述实验可推知,KI变质的条件是。(4)、(提出问题2)CO2的作用是什么?(进行实验)分别取10 mL同浓度的KI溶液于3支试管中,再向试管2中通入CO2 , 向试管3中滴加几滴盐酸;分别测溶液的pH;几分钟后,观察溶液的颜色;再向试管中滴入淀粉溶液,观察溶液的颜色。实验现象记录如下:
试管序号
1
2
3
溶液pH
pH=8.5
pH=6.5
pH=4.5
溶液颜色
无色
浅黄色
黄色
滴加淀粉溶液后的颜色
无色
紫色
深紫色
较长时间后,观察到试管1中溶液变为紫色。
(解释与结论)
试管1实验的目的是。
(5)、CO2在KI变质过程中的作用是。(6)、(反思与评价)探究KI变质条件时,同学们排除了氮气和稀有气体的影响,其原因是。