江苏省宿迁市2016-2017学年高一上学期化学期末考试试卷
试卷更新日期:2017-09-16 类型:期末考试
一、单项选择题
-
1. 宿迁市城市绿地保护条例经江苏省第十二届人民代表大会常务委员会第二十五次会议,2016年9月30日批准,自2016年12月1日起施行,下列关于绿地作用和保护说法中错误的是( )A、绿地可以保持水土,减少水土流失 B、绿地可以调节气候,减少空气中PM2.5含量 C、绿地可以吸收二氧化碳,转化生成氧气 D、为减少园林绿地中病虫害,大量使用杀虫剂解决问题2. 下列化学用语的表达正确的是( )A、硫酸的电离方程式:H2SO4=H2++SO42﹣ B、光导纤维主要成分的化学式:Si C、质子数为53,中子数为78的碘原子: I D、钠离子的结构示意图:
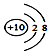 3. 下列关于物质的分类中,正确的是( )
3. 下列关于物质的分类中,正确的是( )酸性氧化物
酸
盐
混合物
电解质
A
SiO2
HClO
烧碱
KAl(SO4)2•12H2O
C2H5OH
B
Na2O2
HNO3
NaHSO4
漂白粉
Mg
C
SO3
H2SiO3
纯碱
水玻璃
NaCl
D
NO
Al(OH)3
BaCO3
铝热剂
NH3
A、A B、B C、C D、D4. 下列氯化物中,既能由金属和氯气直接化合制得,又能由金属和盐酸反应制得的是( )A、CuCl2 B、FeCl2 C、FeCl3 D、NaCl5. 下列各个反应,不能用于工业生产的是( )A、二氧化锰和浓盐酸共热制氯气 B、煅烧黄铁矿(FeS2)制SO2 C、氯气与石灰乳反应制漂白粉 D、电解熔融氯化镁制金属镁6. 图所示的实验装置图正确且能达到相应实验目的是( )A、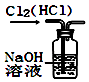 用图所示装置除去Cl2中的HCl
B、
用图所示装置除去Cl2中的HCl
B、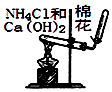 用图所示装置实验室制NH3
C、
用图所示装置实验室制NH3
C、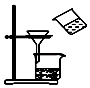 用图所示装置分离MnO2和KCl
D、
用图所示装置分离MnO2和KCl
D、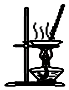 用图所示装置蒸干NH4Cl饱和溶液制备NH4Cl晶体
7. 下列说法正确的是( )A、常温下可用铁制或铝制容器盛装浓硝酸 B、高炉炼铁的主要反应原理是碳在高温下直接将氧化铁还原成铁 C、SO2气体可使酸性高锰酸钾溶液褪色,体现了SO2的漂白性 D、二氧化碳和二氧化硅都是酸性氧化物,都能与水反应生成相应的酸8. 与100mL 0.4mol•L﹣1NH4NO3溶液中的NO3﹣浓度相同的是( )A、400 mL 0.1 mol•L﹣1的KNO3溶液 B、100 mL 0.4 mol•L﹣1的Ba(NO3)2溶液 C、100 mL 0.2 mol•L﹣1的Mg(NO3)2溶液 D、200 mL 0.1mol•L﹣1的Fe(NO3)3溶液9. 下列关于物质用途的叙述中不正确的是( )A、钠和钾的合金可用于快中子反应堆作热交换剂 B、FeCl3溶液能与Cu反应,可用于蚀刻印刷电路板 C、明矾溶于水后能产生Al(OH)3胶体,可用作净水剂 D、在医疗上,可用碳酸钠治疗胃酸过多10. 一定量CO2通入某浓度的NaOH溶液中,反应后得到溶液A,向A溶液中逐滴滴入某浓度稀盐酸,加入V(HCl)与生成n(CO2)的关系如图所示.下列有关叙述正确的是( )
用图所示装置蒸干NH4Cl饱和溶液制备NH4Cl晶体
7. 下列说法正确的是( )A、常温下可用铁制或铝制容器盛装浓硝酸 B、高炉炼铁的主要反应原理是碳在高温下直接将氧化铁还原成铁 C、SO2气体可使酸性高锰酸钾溶液褪色,体现了SO2的漂白性 D、二氧化碳和二氧化硅都是酸性氧化物,都能与水反应生成相应的酸8. 与100mL 0.4mol•L﹣1NH4NO3溶液中的NO3﹣浓度相同的是( )A、400 mL 0.1 mol•L﹣1的KNO3溶液 B、100 mL 0.4 mol•L﹣1的Ba(NO3)2溶液 C、100 mL 0.2 mol•L﹣1的Mg(NO3)2溶液 D、200 mL 0.1mol•L﹣1的Fe(NO3)3溶液9. 下列关于物质用途的叙述中不正确的是( )A、钠和钾的合金可用于快中子反应堆作热交换剂 B、FeCl3溶液能与Cu反应,可用于蚀刻印刷电路板 C、明矾溶于水后能产生Al(OH)3胶体,可用作净水剂 D、在医疗上,可用碳酸钠治疗胃酸过多10. 一定量CO2通入某浓度的NaOH溶液中,反应后得到溶液A,向A溶液中逐滴滴入某浓度稀盐酸,加入V(HCl)与生成n(CO2)的关系如图所示.下列有关叙述正确的是( )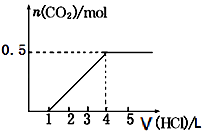 A、通入的CO2气体为11.2 L B、A溶液中n(NaHCO3)=2n(Na2CO3) C、A溶液中既含NaOH,又含Na2CO3 D、A溶液中一定只有Na2CO3
A、通入的CO2气体为11.2 L B、A溶液中n(NaHCO3)=2n(Na2CO3) C、A溶液中既含NaOH,又含Na2CO3 D、A溶液中一定只有Na2CO3二、不定项选择题
-
11. 常温下,下列各组离子在指定溶液中一定能大量共存的是( )A、FeCl3溶液中:K+、Na+、SO42﹣、SCN﹣ B、在强碱性溶液中:K+、Na+、CO3﹣、AlO2﹣ C、在盐酸溶液中:K+、Fe2+、SO32﹣、NO3﹣ D、与铝反应产生氢气的溶液中:Na+、K+、HCO3﹣、Cl﹣12. 下列离子方程式中正确的是( )A、氢氧化钡溶液与硫酸溶液反应:Ba2++SO42﹣═BaSO4↓ B、向NaAlO2溶液中通入过量二氧化碳:AlO2﹣+H2O+CO2═Al(OH)3↓+HCO3﹣ C、氯气通入水中:Cl2+H2O⇌2H++Cl﹣+ClO﹣ D、NH4Cl溶液和稀NaOH溶液反应:NH4++OH﹣═NH3•H2O13. 下列实验操作、现象和结论描述均正确的是( )
序号
实验操作
实验现象
实验结论
A
向某无色溶液中滴加盐酸
产生能使澄清石灰水变浑浊气体
说明溶液中一定含有CO32﹣
B
向某无色溶液中滴加盐酸酸化的BaCl2溶液
产生白色沉淀
说明溶液中一定含有SO42﹣
C
向某溶液中先滴加KSCN溶液,再滴加氯水
先无明显现象,后出现血红色溶液
说明溶液中一定含有Fe2+
D
向一定浓度的Na2SiO3溶液中通入适量的CO2
出现白色沉淀
说明H2CO3的酸性比H2SiO3强
A、A B、B C、C D、D14. 表所列各组物质中,物质之间通过一步反应就能实现如图所示转化且所给反应条件正确的是( )选项
X
Y
Z
箭头上所标数字的反应条件
A
SiO2
Na2SiO3
H2SiO3
①与Na2CO3熔融
B
Na
Na2O2
NaCl
②加H2O
C
NO
NO2
HNO3
③与C加热
D
Al2O3
NaAlO2
Al(OH)3
④与NaOH
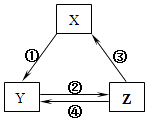 A、A B、B C、C D、D15. 已知某盐酸、氯化铜、氯化铁的混合溶液100mL,已知溶液中各阳离子物质的量浓度相等,氯离子总物质的量浓度为6mol•L﹣1 , 此溶液中最多可以溶解铁粉的质量为( )A、5.6g B、16.8g C、11.2g D、33.6g
A、A B、B C、C D、D15. 已知某盐酸、氯化铜、氯化铁的混合溶液100mL,已知溶液中各阳离子物质的量浓度相等,氯离子总物质的量浓度为6mol•L﹣1 , 此溶液中最多可以溶解铁粉的质量为( )A、5.6g B、16.8g C、11.2g D、33.6g三、解答题
-
16. 15g某气体化合物甲在标准状况下的体积为11.2L,则甲的相对分子质量为 .17. 高岭石化学式为Al2Si2O5(OH)4 , 将其改写成氧化物形式的化学式为 .18. 选择适当的实验操作分离下列混合物:
①分离四氯化碳(沸点为76.75℃)和甲苯(沸点为110.6℃)的混合物 .
②从溴水中的提取溴单质;
③分离汽油和水 .
19. 某反应为: NaClO+ Cr2(SO4)3+ NaOH═ Na2CrO4+ Na2SO4+ NaCl+ H2O(1)、配平上述方程式;用双线桥标出该反应中电子转移的方向和数目.(2)、反应中还原剂是(填化学式),被还原的元素是(填元素符号).20. 现有金属单质A、B、C、I和气体甲、乙、丙及物质D、E、F、G、H.其中B是地壳中含量最多的金属元素.它们之间能发生如下反应(图中部分反应产物和反应条件没有全部标出).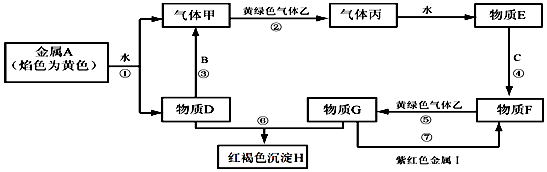
请根据以上信息回答下列问题:
(1)、写出下列物质的化学式:H、I;(2)、写出反应③的化学方程式:;写出反应⑤的离子方程式:;写出反应⑦的离子方程式: .
21. 某兴趣小组为探究铁和浓硫酸反应的产物及性质,用如图所示装置进行实验(夹持装置和A中加热装置已略,气密性已检验).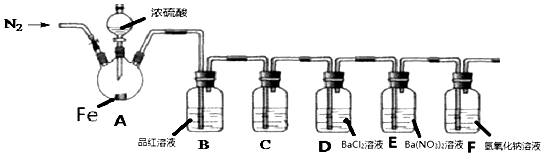
实验开始前,先打开弹簧夹通一段时间N2 , 关闭弹簧夹后,在A中滴加一定量的浓硫酸,观察实验现象,然后加热,观察到A中有白雾生成,铁片上有气泡产生.已知A中白雾是硫酸与水形成的酸雾.请回答下列问题:
(1)、铁片上滴入浓硫酸未加热前没有明显现象的原因是 .(2)、加热一段时间后发现B装置中溶液褪色,取出A中的溶液少许,加入KSCN溶液未出现血红色,写出此时A中反应的化学方程式: .(3)、C装置的作用是除去二氧化硫气体中硫酸蒸汽,则盛放的溶液是 .A、水 B、NaOH溶液 C、Na2SO3 D、NaHSO3溶液(4)、实验开始前,先通一段时间N2的目的是 .(5)、可以证明H2SO3是弱酸的实验装置是 .(6)、E中的白色沉淀是 , 该沉淀的生成表明SO2具有性.(7)、装置F的作用是 , 写出该装置中反应的化学方程式 .22. 如图是某学校实验室从化学试剂商店买回的硫酸试剂瓶标签上的部分内容.现用该浓硫酸配制500mL浓度为1mol•L﹣1的稀硫酸.可供选用的仪器有:
①玻璃棒 ②烧杯 ③托盘天平 ④量筒 ⑤药匙 ⑥胶头滴管 ⑦500mL容量瓶 ⑧细口试剂瓶
请回答下列问题:
(1)、配制500mL浓度为1mol•L﹣1的稀硫酸,需用量筒量取上述浓硫酸体积为mL.
(2)、配制时,一般可分为以下几个步骤:①量取 ②计算 ③稀释 ④摇匀 ⑤转移⑥洗涤 ⑦定容 ⑧冷却.其正确的操作顺序为 , 从上述所给仪器中选取
所需要的仪器有 .
(3)、实验中两次用到玻璃棒,其操作分别: , .(4)、在配制过程中,下列操作可引起所配溶液浓度偏高有 (填序号)A、洗涤量取浓硫酸的量筒,并将洗涤液转移到容量瓶中 B、未等稀释后的硫酸溶液冷却至室温就转移到容量瓶中 C、转移前,容量瓶中含有少量蒸馏水 D、未洗涤稀释浓硫酸时用过的烧杯和玻璃棒 E、定容时,俯视刻度线 F、定容时加水超过了刻度线,马上用胶头滴管吸去多余的水.23. 将镁、铝的混合物共0.1mol,溶于200mL 2.5mol•L﹣1的盐酸溶液中,然后再滴加2mol•L﹣1的NaOH溶液.请回答下列问题:(1)、若在滴加NaOH溶液的过程中,沉淀质量m 随加入NaOH溶液的体积V变化情况如图所示.当V1=120mL时,则金属粉末中n(Al)=mol.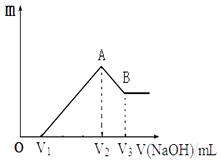 (2)、V2~V3段发生反应的离子方程式为 .(3)、若在滴加NaOH溶液的过程中,欲使Mg2+、Al3+刚好沉淀完全,则滴入NaOH溶液的体积V(NaOH)=mL.
(2)、V2~V3段发生反应的离子方程式为 .(3)、若在滴加NaOH溶液的过程中,欲使Mg2+、Al3+刚好沉淀完全,则滴入NaOH溶液的体积V(NaOH)=mL.