湖北省荆门市2016-2017学年化学高一上学期期末考试试卷
试卷更新日期:2017-09-16 类型:期末考试
一、选择题
-
1. 今年入冬以来,我市大部分地区雾霾严重,严重影响人们的日常生活.“改善环境条件,提高空气质量:人人有责!下列措施对控制雾霾无影响的是( )A、机动车限号行驶,鼓励乘公交出行 B、不焚烧农作物秸秆 C、局部地区实行人工降雨、降雪 D、家庭安装空气净化器2. 下列分类正确的是( )A、酸:CH3COOH、H2SO3、NaHCO3、HF B、碱:Cu2(OH)2CO3、NaOH、Fe(OH)2、Mg(OH)2 C、盐:AgCl、BaSO4、NaH2PO4、Mg(NO3)2 D、酸性氧化物:CO、CO2、SO2 SO33. 下列说法中不正确的是( )A、Al2O3可用作耐火材料,用小苏打发酵面团制作馒头 B、碳素钢的熔点比纯铁低、司母戊鼎的主要成分是铜合金 C、“海水淡化”可以解决“淡水供应危机”,向海水中加入净水剂明矾可以使海水淡化 D、绚丽缤纷的烟花中添加了含钾,钙,钠,铜等金属元素化合物4. NA为阿伏加德罗常数的值,下列说法不正确的是( )A、过氧化钠与水反应时,生成0.1mol氧气转移的电子数为0.2NA B、常温常压下的67.2L氯气与27g铝充分反应,转移电子数为3NA C、1L 1mol/L的稀硝酸中,含氧原子数为3NA D、1molCO和CO2混合气体中含C原子数为NA5. 常温下,在溶液中可发生以下反应:①2Fe2++Br2=2Fe3++2Br﹣ ②2Br﹣+Cl2=Br2+2Cl﹣ ③2Fe3++2I﹣=2Fe2++I2 . 由此判断下列说法正确的是( )A、铁元素在反应①中被还原,在③中被氧化 B、反应②中当有1mol Cl2被氧化时,有2mol Br﹣被还原 C、氧化性强弱顺序为:Cl2>I2>Br2>Fe3+ D、还原性强弱顺序为:I﹣>Fe2+>Br﹣>Cl﹣6. 某课外实验小组的同学们采取的下列实验操作中,正确的是( )
①甲同学将用剩的钠或钾应及时放回原试剂瓶;
②乙同学用灯帽盖灭酒精灯;
③丙同学给容量为30mL的试管中加入20mL液体加热;
④丁同学用酒精萃取碘水中的碘;
⑤戊同学将浓硫酸倒入装有适量水的量筒中稀释;
⑥己同学配制NaOH溶液时,将NaOH固体在烧杯中溶解后,立即注入容量瓶中.
A、只有②③ B、①② C、只有②③④ D、全部正确7. 下列离子方程式书写正确的是( )①将金属Na投入水中:2Na+2H2O=2Na++2OH﹣+H2↑
②在硫酸溶液中加入氢氧化钡溶液至中性:Ba2++OH﹣+H++SO42﹣=BaSO4↓+H2O
③碳酸氢钙溶液中滴加盐酸:HCO3﹣+H+=CO2↑+H2O
④碳酸钙中滴加盐酸:CO32﹣+2H+=CO2↑+H2O.
A、①③④ B、①③ C、②④ D、①②③8. 下列化合物与小苏打溶液反应,没有气体或沉淀生成的是( )A、烧碱 B、硫酸氢钠 C、氢氧化钡 D、过氧化钠9. 下列除去杂质(括号内的物质为杂质)的方法中错误的是( )A、FeSO4 (CuSO4):加足量铁粉后,过滤 B、CO (CO2):用NaOH溶液洗气后干燥 C、CO2 (HCl):用NaOH溶液洗气后干燥 D、MnO2 (KCl):加水溶解后,过滤、洗涤、烘干10. 把14.8g Na2CO3•10H2O和NaHCO3组成的固体混合物溶于水配成100mL溶液,其中c(Na+)=1.2mol•L﹣1 , 若把等质量的固体混合物加热至恒重,残留固体质量是( )A、3.18g B、6.36g C、4.22g D、5.28g11. 三种正盐的混合溶液中含有0.2molNa+ , 0.25molMg2+ , 0.4molCl﹣ , 则SO42﹣的物质的量为( )A、0.1 mol B、0.3 mol C、0.5 mol D、0.15 mol12. 在标准状况下,m g A气体与n g B气体分子数相等,下列说法不正确的是( )A、标准状况下,同体积的气体A和气体B的质量比m:n B、25℃时,1kg气体A与1kg气体B的分子数之比为n:m C、同温同压下,气体A与气体B的密度之比为m:n D、标准状况下,等质量的A与B的体积比为m:n13. 一江清水送北京是十堰人民对首都人民的承诺,水质问题很重要,十堰某地有两个工厂的污水中各含有下列8种离子中的4种(两厂不含相同离子):Ag+、Ba2+、Fe3+、Na+、Cl﹣、SO42﹣、NO3﹣、OH﹣ . 两厂单独处理成本很高,如果将两厂的污水按一定比例混合,过滤沉淀后污水就变为无色澄清且只含NaNO3 , 污染程度大大降低.关于污染源的分析,你认为正确的是( )A、Cl﹣ 和NO3﹣一定来自不同的工厂 B、SO42﹣ 和NO3﹣可能来自同一工厂 C、Ag+ 和Na+ 可能来自同一工厂 D、Na+ 和NO3﹣一定来自同一工厂14. 在2KMnO4+16HCl═2KCl+2MnCl2+5Cl2↑+8H2O反应中氧化剂与还原剂物质的量之比为( )
A、1:8 B、8:1 C、1:5 D、5:115. 1L某混合溶液中,溶质X、Y的浓度都为0.1mol/L,向混合溶液中滴加某溶液Z(0.1mol/L的氢氧化钠或硫酸溶液),所得沉淀的物质的量随着Z溶液的体积变化关系如图所示,则X、Y、Z分别是( ) A、AlCl3、FeCl3、NaOH B、AlCl3、MgCl2、NaOH C、NaAlO2、Ba(OH)2、H2SO4 D、NaAlO2、BaCl2、H2SO4
A、AlCl3、FeCl3、NaOH B、AlCl3、MgCl2、NaOH C、NaAlO2、Ba(OH)2、H2SO4 D、NaAlO2、BaCl2、H2SO4二、实验题
-
16. 某校化学小组学生利用如图1所列装置进行“铁与水蒸气反应”的实验,并利用产物进一步制取FeCl3•6H2O 晶体.(图中夹持及尾气处理装置均已略去)
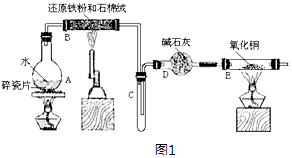 (1)、装置B中发生反应的化学方程式是(2)、装置E中的现象是(3)、停止反应,待B管冷却后,取其中的固体,加入过量稀盐酸充分反应,过滤.写出可能发生的有关反应化学方程式:(4)、该小组学生利用上述滤液制取FeCl3•6H2O晶体,设计流程如图2:
(1)、装置B中发生反应的化学方程式是(2)、装置E中的现象是(3)、停止反应,待B管冷却后,取其中的固体,加入过量稀盐酸充分反应,过滤.写出可能发生的有关反应化学方程式:(4)、该小组学生利用上述滤液制取FeCl3•6H2O晶体,设计流程如图2:
①步骤I中通入Cl2的作用是 .
②简述检验滤液中Fe3+的操作方法
③步骤II从FeCl3稀溶液中得到FeCl3•6H2O晶体的主要操作包括: .
17. 掌握仪器的名称、组装及使用方法是中学化学实验的基础,根据如图实验装置回答问题.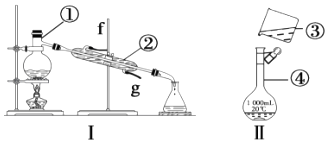 (1)、仪器①~④中,使用时必须检查是否漏水的是(填序号).(2)、若利用装置Ⅰ分离酒精和水的混合物,还缺少的仪器 , ②的进水口是(填“f”或“g”).(3)、某小组同学欲配制230mL 0.4mol/L 盐酸,则需取用4mol/L盐酸mL.(4)、装置Ⅱ是该小组某同学转移溶液的示意图,指出图中的错误之处:
(1)、仪器①~④中,使用时必须检查是否漏水的是(填序号).(2)、若利用装置Ⅰ分离酒精和水的混合物,还缺少的仪器 , ②的进水口是(填“f”或“g”).(3)、某小组同学欲配制230mL 0.4mol/L 盐酸,则需取用4mol/L盐酸mL.(4)、装置Ⅱ是该小组某同学转移溶液的示意图,指出图中的错误之处:①;② .
(5)、下列实验操作使配制的溶液浓度偏低的是 .A、容量瓶洗涤后未干燥 B、移液时,有少量溶液溅出 C、定容时,加水不慎超过刻度线,又倒出一些 D、量筒量取溶液时,仰视刻度线 E、装入试剂瓶时,有少量溶液溅出.三、推断题
-
18. 某混合物A含有Al2(SO4)3、Al2O3和Fe2O3 , 在一定条件下可实现如图所示变化.
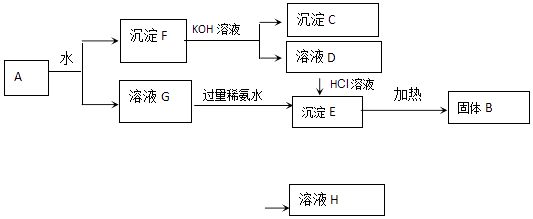
请回答下列问题.
(1)、、C、D、G、H 4种物质的化学式为:C、D、G、H .(2)、沉淀F与KOH溶液反应的离子方程式为沉淀E加热生成B的化学方程式为溶液G与过量稀氨水反应的化学方程式为 .四、解答题
-
19. 现有下列十种物质:①液态氯化氢 ②小苏打 ③固体纯碱 ④二氧化碳 ⑤葡萄糖 ⑥氢氧化钾 ⑦氢氧化铁胶体 ⑧氨水 ⑨Al ⑩硫酸铁溶液(1)、上述十种物质中,属于电解质的有 , 属于非电解质的有 .(2)、有两种物质在水溶液中可发生反应,离子方程式为:H++OH﹣=H2O,该反应的化学方程式为 .(3)、除去③中少量②的操作是 , ⑨在空气中能稳定存在的原因 .(4)、标准状况下,L ④中含有0.4mol 氧原子.(5)、现有100mL⑩溶液中含Fe3+5.6g,则溶液中SO42﹣的物质的量浓度是 .(6)、若在⑦中缓慢加入⑥的水溶液,产生的现象是 .(7)、将①加入到⑥的溶液中,⑥的溶液导电能力变化为(填“增强”、“减弱”或“基本不变”)20. 已知某一反应体系中有反应物和生成物共6种微粒:MnO4﹣、NO2﹣、H+、Mn2+、H2O和一种未知的离子X(简单锰离子在生成物中).完成下列问题:(1)、该反应中的X离子是 , 还原产物是 .(2)、该反应的离子方程式为: .(3)、如反应转移了0.2mol电子,则反应的NO2﹣的物质的量为 .(4)、实验室常用饱和NaNO2与NH4Cl溶液反应制取纯净氮气,该反应的化学方程式为: .21. 将有铜的印刷线路板浸入200mL氯化铁浓溶液中,有19.2g铜被腐蚀掉.取出印刷线路板,向溶液中加入16.8g铁粉,经充分反应,溶液中还存在9.6g不溶解的物质.(设溶液体积不变).请回答下列问题:(1)、充分反应后,溶液中存在9.6g不溶物的成分为 .(2)、充分反应后溶液中一定不存在的金属离子为 .(3)、比较Fe2+、Fe3+、Cu2+的氧化性大小: .(4)、试计算最后溶液中Fe2+离子的物质的量浓度mol/L.
-