广西桂林市2016-2017学年高一上学期化学期末考试试卷
试卷更新日期:2017-09-16 类型:期末考试
一、选择题
-
1. 2016年11月6日中国东北、华北和华东地区爆发空气重度污染,工业排放、机动车排放、冬季燃煤采暖是导致此轮大范围空气重度污染的“元凶”.治理大气污染,任重道远!下列做法与治理大气污染相违背的是( )A、燃煤电厂的废气随意排放 B、采暖燃煤锅炉安装脱硝等净化设施 C、尽量步行或骑自行车出行 D、重污染工业企业持续推进能源结构调整2. 2015年8月12日天津塘沽爆炸的主要原因系仓库内金属钠遇水发生反应引发爆炸.下列有关说法错误的是( )A、金属钠和水反应放热 B、金属钠和水反应产生可燃烧的氢气 C、可在现场使用干沙灭火 D、可在现场使用高压水枪灭火3. 氯元素在自然界的主要存在形式是( )A、Cl2 B、HCl C、NaCl D、KClO34. 下列物质中,不属于合金的是( )A、硬铝 B、青铜 C、钢铁 D、纯金5. 下列气体中,对人体无毒害作用的是( )A、NH3 B、NO2 C、Cl2 D、N26. 下列电离方程式中,正确的是( )A、FeCl3=Fe2++3Cl﹣ B、NaOH=Na++OH﹣ C、H2SO4=H2++SO42﹣ D、NaHCO3=Na++H++CO32﹣7. 下列有关“物质→类别”的对应关系正确的是( )A、纯碱→碱 B、氧化铁→碱性氧化物 C、次氯酸→强酸 D、氢氧化铁胶体→纯净物8. 下列实验操作中,不能用于物质分离的是( )A、
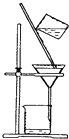 B、
B、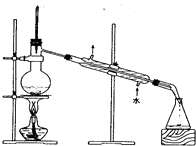 C、
C、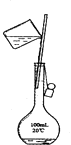 D、
D、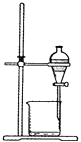 9. 下列各组物质有关性质关系的比较,正确的是( )A、硬度:SiO2<CO2 B、溶解性:SiO2>CO2 C、熔点:SiO2<CO2(干冰) D、酸性:H2CO3>H2SiO310. 下列物质不与NaOH溶液反应的是( )A、Na2CO3 B、SO3 C、Al(OH)3 D、NaHCO311. 下列物质不能使品红溶液褪色的是( )A、二氧化硫 B、过氧化钠 C、氯水 D、氯化钠溶液12. 下列对于氨气“喷泉实验”(如图所示)的现象或结论的描述正确的是( )
9. 下列各组物质有关性质关系的比较,正确的是( )A、硬度:SiO2<CO2 B、溶解性:SiO2>CO2 C、熔点:SiO2<CO2(干冰) D、酸性:H2CO3>H2SiO310. 下列物质不与NaOH溶液反应的是( )A、Na2CO3 B、SO3 C、Al(OH)3 D、NaHCO311. 下列物质不能使品红溶液褪色的是( )A、二氧化硫 B、过氧化钠 C、氯水 D、氯化钠溶液12. 下列对于氨气“喷泉实验”(如图所示)的现象或结论的描述正确的是( )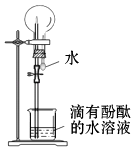 A、烧杯中的水面会缓缓上升 B、烧瓶内形成蓝色喷泉 C、实验证明氨气极易溶于水 D、实验证明氨气的密度大于空气的密度13. 下列离子方程式中,书写正确的是( )A、将少量铜屑溶解在浓硝酸中:Cu+4H++2NO3﹣═Cu2++2NO2↑+2H2O B、用氢氧化钠溶液吸收氯气:Cl2+2OH﹣═ClO﹣+H2O C、用足量氨水吸收二氧化硫:2OH﹣+SO2═SO42﹣+H2O D、将稀硫酸滴在铁片上:2Fe+6H+═2Fe3++3H2↑14. 下列反应中,不属于氧化还原反应的是( )A、Cl2+H2 2HCl B、2FeCl3+Cu═2FeCl2+CuCl2 C、CaO+H2O═Ca(OH)2 D、2Na2O2+2H2O═4NaOH+O2↑15. 高铁的快速发展方便了我们的出行.工业上用铝热反应 (2Al+Fe2O3 2Fe+Al2O3)焊接钢轨间的缝隙.在反应中,Fe2O3( )A、是氧化剂 B、是还原剂 C、既是氧化剂也是还原剂 D、既不是氧化剂也不是还原剂16. 0.6mol/LNaCl溶液和1mol/LCaCl2溶液的c (Cl﹣)之比为( )A、2:5 B、3:10 C、1:2 D、3:517. 设NA表示阿伏加德罗常数的值,下列叙述正确的是( )A、标准状况下,2.24LH2O含有的分子数目为0.1NA B、1mol/LCu(NO3)2溶液中NO3﹣的数目为2NA C、2.4gMg转变成Mg2+失电子的数目为0.2NA D、6.2gNa2O所含Na+的数目为0.1NA18. 欲除去碳酸钠固体中混有的少量碳酸氢钠,最好的方法是( )A、将固体加热至不再有气体产生 B、将固体配成溶液,再加入过量的澄清石灰水 C、将固体配成溶液,再加入过量的NaOH溶液 D、将固体配成溶液,再通入足量的CO2气体19. 下列选项中,陈述Ⅰ、陈述Ⅱ都正确,并且有因果关系的是( )
A、烧杯中的水面会缓缓上升 B、烧瓶内形成蓝色喷泉 C、实验证明氨气极易溶于水 D、实验证明氨气的密度大于空气的密度13. 下列离子方程式中,书写正确的是( )A、将少量铜屑溶解在浓硝酸中:Cu+4H++2NO3﹣═Cu2++2NO2↑+2H2O B、用氢氧化钠溶液吸收氯气:Cl2+2OH﹣═ClO﹣+H2O C、用足量氨水吸收二氧化硫:2OH﹣+SO2═SO42﹣+H2O D、将稀硫酸滴在铁片上:2Fe+6H+═2Fe3++3H2↑14. 下列反应中,不属于氧化还原反应的是( )A、Cl2+H2 2HCl B、2FeCl3+Cu═2FeCl2+CuCl2 C、CaO+H2O═Ca(OH)2 D、2Na2O2+2H2O═4NaOH+O2↑15. 高铁的快速发展方便了我们的出行.工业上用铝热反应 (2Al+Fe2O3 2Fe+Al2O3)焊接钢轨间的缝隙.在反应中,Fe2O3( )A、是氧化剂 B、是还原剂 C、既是氧化剂也是还原剂 D、既不是氧化剂也不是还原剂16. 0.6mol/LNaCl溶液和1mol/LCaCl2溶液的c (Cl﹣)之比为( )A、2:5 B、3:10 C、1:2 D、3:517. 设NA表示阿伏加德罗常数的值,下列叙述正确的是( )A、标准状况下,2.24LH2O含有的分子数目为0.1NA B、1mol/LCu(NO3)2溶液中NO3﹣的数目为2NA C、2.4gMg转变成Mg2+失电子的数目为0.2NA D、6.2gNa2O所含Na+的数目为0.1NA18. 欲除去碳酸钠固体中混有的少量碳酸氢钠,最好的方法是( )A、将固体加热至不再有气体产生 B、将固体配成溶液,再加入过量的澄清石灰水 C、将固体配成溶液,再加入过量的NaOH溶液 D、将固体配成溶液,再通入足量的CO2气体19. 下列选项中,陈述Ⅰ、陈述Ⅱ都正确,并且有因果关系的是( )选项
陈述Ⅰ
陈述Ⅱ
A
铝具有强还原性
可用铝与浓硫酸反应制备氢气
B
Fe(OH)2稳定
用FeCl2溶液和NaOH溶液反应可制取纯净的Fe(OH)2
C
Na2O2与CO2反应生成氧气
Na2O2可作供氧剂
D
二氧化硅不与任何酸反应
可用二氧化硅制造耐酸容器
A、A B、B C、C D、D20. 将足量的铁粉投入含FeCl3和CuCl2各0.1mol的混合液中,充分反应后,溶液中Fe2+的物质的量是( )A、0.2mol B、0.25mol C、0.3mol D、0.35mol二、填空题
-
21. 现有34gNH3 , 请通过计算填空:(1)、该气体物质的量为mol,所含H原子数目为 .(2)、该气体在标准状况下的体积为L.(3)、若将该气体溶于水配成VL溶液,所得溶液溶质的物质的量浓度为mol/L.(4)、若将该气体溶100mL水中,所得溶液溶质的质量分数约为%(小数点后保留一位小数).22. 用所给物质的序号回答:①K2SO4固体 ②铁 ③蔗糖 ④稀盐酸
在常温下能导电的是 , 属于电解质的是 .
23. 有下列物质:硅、漂白液、铝、浓硫酸,请回答:硅可用于制作电池;漂白液的有效成分是(填化学式);铝和烧碱溶液反应的离子方程式是;区别浓硫酸和稀硫酸的简单方法是(列举一种方法).
三、简答题
-
24. 2016年10月17日7时30分,我国“神舟十一号”载人飞船顺利升入太空.此次火箭的主要燃料是偏二甲肼(C2N2H8)和一种氮的氧化物(用R表示),当火箭发射时,这两种燃料会剧烈反应产生大量气体,并释放出大量的热,化学方程式如下(已配平):C2N2H8+2R=3N2↑+4H2O+2CO2↑(1)、R的化学式是; 已知偏二甲肼中N元素显﹣2价,H元素显+1价,由此推断,C元素的化合价是 .(2)、该反应的还原剂是 , 被还原的元素是 .(3)、若反应生成22.4LCO2(标准状况),则反应转移电子mol.(4)、火箭发射时,尾部向下喷出的气体会有明显的红棕色,该红棕色气体的化学式可能是 .25. 某固体混合物可能含有NaCl、K2SO4、Cu(NO3)2、CaCl2、Na2CO3中的一种或几种.为研究其组成,依次进行了下列实验:
⑴取少量混合物,加水,得到无色透明溶液;
⑵向⑴中溶液加过量BaCl2溶液,有白色沉淀生成,过滤,分别对沉淀和滤液进行下列实验;
⑶向上述白色沉淀中加足量稀盐酸,沉淀部分溶解,并产生气体;
⑷向上述滤液中加AgNO3溶液,有白色沉淀生成,再加稀硝酸沉淀不溶解.
根据以上实验现象判断,混合物中肯定有(填化学式,下同);肯定没有;可能有 .
26. 镁及其合金是一种用途很广的金属材料,目前世界上60%的镁是从海水中提取的.从海水制备金属镁的流程如图所示: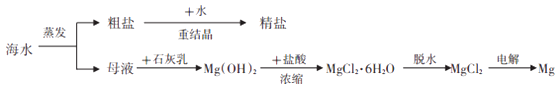
请回答:
(1)、母液中除含有大量MgCl2 , 还可能含有少量NaCl,检测其中含钠元素的实验方法是(填实验方法名称)(2)、由母液制得的Mg(OH)2中混有Ca(OH)2 , 向其中加入过量MgCl2溶液,经充分搅拌、静置、(填操作名称)、洗涤、干燥后可得较为纯净的Mg(OH)2 , 写出该反应的化学方程式: .(3)、已知:工业上用CaO和水反应获得石灰乳,用电解饱和食盐水获得NaOH.请说明,工业上制Mg(OH)2用石灰乳而不用NaOH的原因 .(4)、写出电解熔融MgCl2制金属镁的化学方程式 .四、实验题
-
27. 甲、乙、丙三位同学分别欲用图所示实验装置制取并收集氨气.
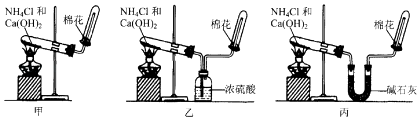 (1)、其中有一位同学没有收集到氨气,你认为没有收集到氨气的同学是(填“甲”或“乙”或“丙”),原因是 .(2)、要制取纯净的氨气,应该选用(填“甲”或“乙”或“丙”)同学的装置.为确定试管内是否已收集满氨气,可将蘸浓盐酸的玻璃棒置于收集气体的试管口处,若观察到 , 则说明氨气已收集满.28. Fe2+与I﹣都是具有还原性的离子.某研究性学习小组拟用FeI2与氯水反应比较Fe2+与I﹣的还原性强弱,实验如下:(1)、Ⅰ.实验需要配制250mL0.10mol/LFeI2溶液
(1)、其中有一位同学没有收集到氨气,你认为没有收集到氨气的同学是(填“甲”或“乙”或“丙”),原因是 .(2)、要制取纯净的氨气,应该选用(填“甲”或“乙”或“丙”)同学的装置.为确定试管内是否已收集满氨气,可将蘸浓盐酸的玻璃棒置于收集气体的试管口处,若观察到 , 则说明氨气已收集满.28. Fe2+与I﹣都是具有还原性的离子.某研究性学习小组拟用FeI2与氯水反应比较Fe2+与I﹣的还原性强弱,实验如下:(1)、Ⅰ.实验需要配制250mL0.10mol/LFeI2溶液配制FeI2溶液除烧杯、量筒、胶头滴管外,还需要的玻璃仪器是 .
(2)、如果定容时仰视刻度线,配制的FeI2溶液浓度将(填“偏高”、“偏低”或“无影响”).(3)、Ⅱ.探究Fe2+与I﹣的还原性强弱取10mL上述FeI2溶液,向其中滴加少量新制的氯水,振荡后发现溶液呈黄色.同学们对产生黄色的原因提出假设:
假设1:只有I﹣被少量Cl2氧化成I2溶解在溶液中,还原性:I﹣>Fe2+;
假设2:只有Fe2+被少量Cl2氧化成Fe3+ , 还原性:Fe2+>I﹣ .
设计方案,验证假设
实验方案
预期现象
结论
假设1正确
假设2正确
(4)、实验发现假设1正确,写出假设1涉及的离子方程式: .五、计算题