广东省揭阳市惠来一中2016-2017学年高一上学期期末考试试卷
试卷更新日期:2017-09-16 类型:期末考试
一、选择题
-
1. 化学与生产、生活、环境密切相关,下列说法中正确的是( )A、食盐、次氯酸钠溶液均可以将某些病毒氧化而达到消毒的目的 B、大力实施矿物燃料“脱硫、脱硝”技术,可减少酸雨的发生 C、光纤通信使用的光缆的主要成分是晶体Si,太阳能电池使用的材枓主要是SiO2 D、节日燃放的烟花,是碱金属、锶、铂、铁等金属化合物焰色反应所呈现的色彩2. 下列说法正确的是( )A、常温下,铁能被浓硝酸钝化,可用铁质容器贮运浓硝酸 B、包装食品里常有硅胶、石灰、还原铁粉三类小包,其作用相同 C、浓硫酸可用于干燥H2S和CO2 D、合金的物理性质一般与其各组分金属的物理性质相同3. 安全是顺利进行实验及避免伤害的保障.下列实验操作正确且不是从实验安全角度考虑的是( )
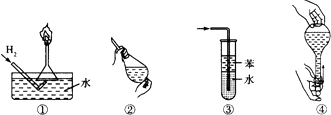 A、操作①:使用稍浸入液面下的倒扣漏斗检验氢气的纯度 B、操作②:使用CCl4萃取溴水中的溴时,振荡后需打开活塞使漏斗内气体放出 C、操作③:吸收氨气或氯化氢气体并防止倒吸 D、操作④:用食指顶住瓶塞,另一只手托住瓶底,把瓶倒立,检查容量瓶是否漏水4. 下列有关实验的叙述正确的是( )A、蒸发时将蒸发皿放置在铁架台的铁圈上,并加垫石棉网加热 B、萃取操作时,应选择有机萃取剂,且萃取剂的密度必须比水大 C、铝箔在酒精灯火焰上加热熔化但不滴落,说明铝箔表面氧化铝膜的熔点高于铝 D、向某溶液中加入NaOH溶液得白色沉淀,又观察到沉淀颜色逐渐变为红褐色,说明该溶液中只含有Fe2+ , 不含有Mg2+5. 下列判断合理的是
A、操作①:使用稍浸入液面下的倒扣漏斗检验氢气的纯度 B、操作②:使用CCl4萃取溴水中的溴时,振荡后需打开活塞使漏斗内气体放出 C、操作③:吸收氨气或氯化氢气体并防止倒吸 D、操作④:用食指顶住瓶塞,另一只手托住瓶底,把瓶倒立,检查容量瓶是否漏水4. 下列有关实验的叙述正确的是( )A、蒸发时将蒸发皿放置在铁架台的铁圈上,并加垫石棉网加热 B、萃取操作时,应选择有机萃取剂,且萃取剂的密度必须比水大 C、铝箔在酒精灯火焰上加热熔化但不滴落,说明铝箔表面氧化铝膜的熔点高于铝 D、向某溶液中加入NaOH溶液得白色沉淀,又观察到沉淀颜色逐渐变为红褐色,说明该溶液中只含有Fe2+ , 不含有Mg2+5. 下列判断合理的是①硫酸、烧碱、纯碱和生石灰分别属于酸、碱、盐和氧化物
②能电离出金属离子和酸根离子的化合物都是盐
③金属氧化物一定是碱性氧化物
④根据分散系是否具有丁达尔现象,将分散系分为溶液、胶体和浊液
⑤根据反应中是否有电子的转移,将化学反应分为氧化还原反应和非氧化还原反应
⑥稀释浓H2SO4时,将水慢慢倒入浓H2SO4中,并不断搅拌( )
A、只有②④⑥ B、只有③④⑥ C、只有①③⑤ D、只有①②⑤6. 下列离子方程式书写不正确的是( )A、显蓝色的淀粉溶液中通入足量的SO2后变成无色溶液:I2+SO2+2H2O═2I﹣+SO42﹣+4H+ B、向明矾溶液中逐滴加入Ba(OH)2溶液至SO42﹣恰好完全沉淀:2Al3++3SO42﹣+3Ba2++6OH﹣═2Al(OH)3↓+3BaSO4↓ C、碳酸氢钙溶液中滴加氢氧化钠溶液至Ca2+恰好完全沉淀:Ca2++HCO3﹣+OHˉ═CaCO3↓+H2O D、盛放烧碱溶液的试剂瓶不能用玻璃塞:SiO2+2OH﹣═SiO32﹣+H2O7. 设NA为阿伏加德罗常数的值,下列说法正确的是( )A、S2和S8的混合物共6.4 g,所含硫原子数一定为0.2NA B、将100 mL 0.1 mol•L﹣1的FeCl3溶液滴入沸水中可制得Fe(OH)3胶粒数目为0.01NA C、在反应KClO3+6HCl═KCl+3Cl2↑+3H2O中,每生成3 mol Cl2 , 转移的电子数为6NA D、将含有1 mol Na2CO3的溶液逐滴加入到含1.5 mol HCl的溶液中,产生气体的分子数目为0.5NA8. 固体单质A和气体单质B在容积一定的密闭容器中完全反应生成气体C,同温下测得容器内压强不变,且反应后气体C的密度是原气体密度的4倍.则下列判断正确的是( )A、两种单质的摩尔质量比为1:4 B、生成物C中A的质量分数为75% C、生成物C中A,B的原子个数比为3:1 D、反应前后气体分子数比为1:49. 已知常温下,在溶液中发生如下反应:①16H++10Z﹣+2XO4﹣═2X2++5Z2+8H2O;
②2A2++B2═2A3++2B﹣;
③2B﹣+Z2═B2+2Z﹣ .
由此推断下列说法错误的是( )
A、反应Z2+2A2+═2A3++2Z﹣可以进行 B、Z元素在反应③中被还原,在反应①中被氧化 C、Z2可以置换出X2+溶液中的X D、氧化性由强到弱的顺序是XO4﹣、Z2、B2、A3+10. 已知NH4CuSO3与足量的10mol/L硫酸混合微热,产生下列现象:①有红色金属生成 ②产生刺激性气味的气体 ③溶液呈现蓝色.据此判断下列说法正确的是( )A、刺激性气味的气体是氨气 B、NH4CuSO3中硫元素被氧化 C、1 mol NH4CuSO3完全反应转移0.5 mol电子 D、反应中硫酸作氧化剂11. 气体X可能由NH3、Cl2、HBr、CO2中的一种或几种组成,已知X通入AgNO3溶液时产生浅黄色沉淀,该沉淀不溶于稀HNO3 , 若将X通入澄清石灰水中,无沉淀产生,则有关气体X的成分的下列说法正确的是( )①一定含有HBr,可能含有CO2 ②一定不含CO2③一定不含NH3、Cl2 ④可能含有Cl2、CO2 .
A、只有① B、只有③ C、①和③ D、②和③12. CaCO3是一种化工原料,可以通过反应生成一系列物质,如图所示.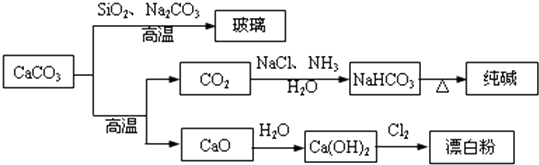
下列说法正确的是( )
A、Cl2和SO2均可以漂白有色物质,且漂白的原理相同 B、由SiO2+Na2CO3 Na2SiO3+CO2↑可知H2CO3的酸性强于H2SiO3 C、工业上,可先向饱和食盐水中通入NH3后再通入CO2制NaHCO3 D、制取玻璃、纯碱和漂白粉所涉及的反应都是非氧化还原反应13. 列操作或装置能达到实验目的是( )A
B
C
D
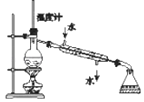

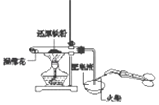
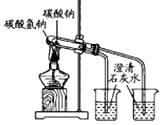
分离互溶但沸点相差较大的液体混合物
钠在空气中燃烧
检验铁粉与水蒸气反应产生的氢气
探究碳酸钠和碳酸氢钠的稳定性
A、A B、B C、C D、D14. 下列各组物质之间通过一步就能实现如图所示转化的是( )物质编号
物质转化关系
a
b
c
d
①
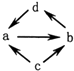
Na2O
Na2O2
Na
NaOH
②
Al2O3
NaAlO2
Al
Al(OH)3
③
FeCl2
FeCl3
Fe
CuCl2
④
NO
NO2
N2
HNO3
A、①② B、②③ C、②④ D、①③15. 标准状况下,将体积为V L充满氨气的圆底烧瓶倒扣在含有足量水的水槽中(如图所示),实验完毕后立即将烧瓶从水槽中取出,所得溶液的密度为ρg•cm﹣3 . 下列说法错误的是( )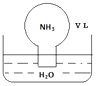 A、水最终会充满整个烧瓶 B、所得溶液的物质的量浓度为 mol•L﹣1 C、所得溶液的质量分数为 ρ D、将氨气换为二氧化氮,所得溶液的物质的量浓度也为 mol•L﹣116. Be(OH)2是两性的,跟强酸反应时生成Be2+ , 跟强碱反应时生成BeO22﹣ . 现有三份等物质的量浓度、等体积的BeCl2、MgCl2、AlCl3溶液(配制时均加入少量盐酸),现将一定浓度的NaOH溶液分别滴入三种溶液中至过量,NaOH溶液的体积x(mL)与生成沉淀的物质的量y(mol)的关系如图所示,则与BeCl2、MgCl2、AlCl3三种溶液对应的图象正确的是( )
A、水最终会充满整个烧瓶 B、所得溶液的物质的量浓度为 mol•L﹣1 C、所得溶液的质量分数为 ρ D、将氨气换为二氧化氮,所得溶液的物质的量浓度也为 mol•L﹣116. Be(OH)2是两性的,跟强酸反应时生成Be2+ , 跟强碱反应时生成BeO22﹣ . 现有三份等物质的量浓度、等体积的BeCl2、MgCl2、AlCl3溶液(配制时均加入少量盐酸),现将一定浓度的NaOH溶液分别滴入三种溶液中至过量,NaOH溶液的体积x(mL)与生成沉淀的物质的量y(mol)的关系如图所示,则与BeCl2、MgCl2、AlCl3三种溶液对应的图象正确的是( )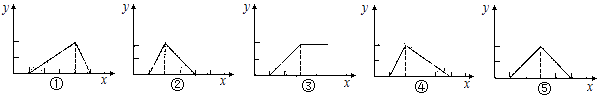 A、⑤③① B、②③④ C、③⑤④ D、③②①17. 利用如图所示装置进行下列实验,试管②中一定观察不到的现象是( )
A、⑤③① B、②③④ C、③⑤④ D、③②①17. 利用如图所示装置进行下列实验,试管②中一定观察不到的现象是( )选项
a
b
c
试管②中现象
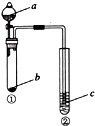
A
NaOH溶液
Al
肥皂水
肥皂泡可点燃
B
稀盐酸
碳酸钙
NaAlO2溶液
生成白色絮状沉淀生成
C
稀硫酸
NaHCO3
BaCl2溶液
溶液变浑浊
D
水
Na2O2
酸化的FeSO4溶液
溶液变黄
A、A B、B C、C D、D18. 某混合物X由Al2O3、Fe2O3、Cu、SiO2中的一种或几种物质组成.某校课外兴趣小组以两条途径分别对X进行如下实验探究.下列有关说法不正确的是( )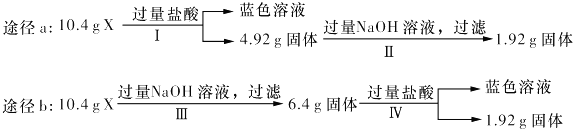 A、由工可知X中一定存在Fe2O3、Cu B、无法判断混合物中是否含有Al2O3 C、1.92 g固体成分为Cu D、原混合物中m( Fe2O3):m(Cu)=1:1
A、由工可知X中一定存在Fe2O3、Cu B、无法判断混合物中是否含有Al2O3 C、1.92 g固体成分为Cu D、原混合物中m( Fe2O3):m(Cu)=1:1二、推断题
-
19. A、B、C、D均为中学化学常见物质,且均含有同一种元素,它们之间有如图转化关系,其中A是单质.
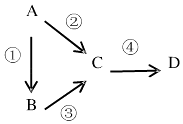 (1)、若A是一种淡黄色固体,B是气态氢化物,C、D为气态氧化物,C是形成酸雨的主要物质.请写出C与B 反应的化学方程式: .(2)、若B是气态氢化物,C、D为气态氧化物,且C、D是形成光化学烟雾的一个重要原因.请写出反应③的化学方程式: .(3)、若B、D既能溶于强酸溶液,又能溶于强碱溶液,反应②③均需要强碱性溶液,反应④可以通过滴加少
(1)、若A是一种淡黄色固体,B是气态氢化物,C、D为气态氧化物,C是形成酸雨的主要物质.请写出C与B 反应的化学方程式: .(2)、若B是气态氢化物,C、D为气态氧化物,且C、D是形成光化学烟雾的一个重要原因.请写出反应③的化学方程式: .(3)、若B、D既能溶于强酸溶液,又能溶于强碱溶液,反应②③均需要强碱性溶液,反应④可以通过滴加少量稀盐酸实现.请写出反应②的离子方程式: .
(4)、若C是一种淡黄色固体,常用于呼吸面具中的供氧剂,D是一种强碱.则C作供氧剂时氧化产物和还原产物的物质的量之比为 .
三、解答题
-
20. 已知某“84消毒液”瓶体部分标签如图所示,该“84消毒液”通常稀释100倍(体积之比)后使用.

请回答下列问题:
(1)、该“84消毒液”的物质的量浓度为mol•L﹣1 .(2)、某同学取100mL该“84消毒液”,稀释后用于消毒,稀释后的溶液中c(Na+)=mol•L﹣1 .(3)、“84消毒液”可用氯气和氢氧化钠溶液反应制得,写出该反应的化学方程式: .(4)、该同学参阅该“84消毒液”的配方,欲用NaClO固体配制480mL含NaClO质量分数37.25%的消毒液.需要称量NaClO固体的质量为g.
(5)、在溶液配制过程中,下列操作使溶液浓度偏小的是 (填选项字母).A、定容时仰视容量瓶刻度线 B、容量瓶在使用前未干燥,里面有少量蒸馏水 C、容量瓶在使用前刚刚配制完一定物质的量浓度的“84消毒液”而未洗净 D、定容摇匀后发现液面低于容量瓶的刻度线,再用胶头滴管加水至刻度线.21. 某强酸性溶液X中可能含有Ba2+、Al3+、NH4+、Fe2+、Fe3+、CO32﹣、SO32﹣、SO42﹣、Cl﹣、NO3﹣中的一种或几种,取该溶液进行连续实验,实验过程如图: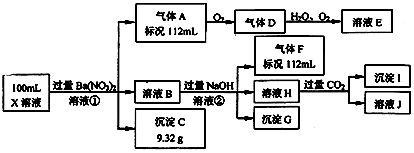
根据以上信息,回答下列问题:
(1)、仅根据上述连续实验,不能确定溶液X中是否含有的阳、阴离子分别是(填离子符号),能证明该阴离子是否存在的简单实验操作为 .
(2)、①中生成气体A的离子方程式为 .(3)、若②中所用氢氧化钠的浓度为2mol/L,当加入l0mL时开始产生沉淀,55mL时沉淀的量达到最大值为0.03mol,继续滴加沉淀的量保持不变,随后再滴加沉淀部分溶解,到60mL时沉淀的量降为0.025mol且保持不变,则原溶液中c(Fe3+)为mol/L、c(Cl﹣)为mol/L(若有些离子不存在,请填“0”).22. 某课外活动小组欲利用CuO与NH3反应,研究NH3的某种性质并测定其组成,设计了如下实验装置(夹持装置未画出)进行实验.请回答下列问题: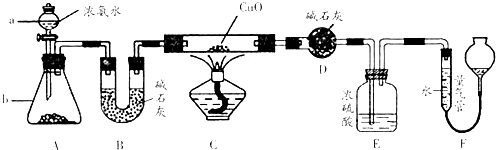 (1)、仪器a的名称为;仪器b中可选择的试剂为 .(2)、实验室中,利用装置A,还可制取的无色气体是 (填字母).A、Cl2 B、O2 C、CO2 D、NO2(3)、实验中观察到装置C中黑色CuO粉末变为红色固体,量气管有无色无味的气体,上述现象证明NH3具有性,写出相应的化学方程式(4)、E装置中浓硫酸的作用 .(5)、读取气体体积前,应对装置F进行的操作:(6)、实验完毕,若测得干燥管D增重mg,装置F测得气体的体积为nL(已折算成标准状况),则氨分子中氮、氢的原子个数比为(用含m、n字母的代数式表示)23. 某化学兴趣小组利用NaI溶液中通入少量Cl2得到含碘废液,再利用含碘废液获取NaI固体,实验流程如下:
(1)、仪器a的名称为;仪器b中可选择的试剂为 .(2)、实验室中,利用装置A,还可制取的无色气体是 (填字母).A、Cl2 B、O2 C、CO2 D、NO2(3)、实验中观察到装置C中黑色CuO粉末变为红色固体,量气管有无色无味的气体,上述现象证明NH3具有性,写出相应的化学方程式(4)、E装置中浓硫酸的作用 .(5)、读取气体体积前,应对装置F进行的操作:(6)、实验完毕,若测得干燥管D增重mg,装置F测得气体的体积为nL(已折算成标准状况),则氨分子中氮、氢的原子个数比为(用含m、n字母的代数式表示)23. 某化学兴趣小组利用NaI溶液中通入少量Cl2得到含碘废液,再利用含碘废液获取NaI固体,实验流程如下: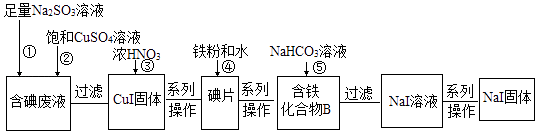
已知反应②:2I﹣+2Cu2++SO32﹣+H2O═2CuI↓+SO42﹣+2H+ .
回答下列问题:
(1)、过滤实验所需要的玻璃仪器有普通漏斗、烧杯、 .(2)、反应③中CuI被氧化,还原产物只有NO2 , 该反应的化学方程式为 .当有95.5g CuI参与反应,则需要标况下L的O2才能将生成的NO2在水中完全转化为硝酸.
(3)、化合物B中含两种元素,铁元素原子与另一种元素原子的物质的量之比为3:8,则化合物B的化学式为 .(4)、反应⑤中生成黑色固体和无色气体,黑色固体的俗称为磁性氧化铁,则反应⑤的化学方程式为 .(5)、将足量的Cl2通入含12g NaI的溶液中,一段时间后把溶液蒸干得到固体的质量为g.
-