湖南省永州市2016-2017学年高一下学期期末考试试卷
试卷更新日期:2017-09-16 类型:期末考试
一、选择题
-
1. “保护环境”是我国的基本国策之一.下列做法不应该提倡的是( )A、采取低碳、节俭的生活方式 B、严禁排放未经处理的有毒工业废水 C、经常使用一次性筷子、塑料袋等 D、按照规定对生活废弃物进行分类放置2. 由德、法、英及波兰等多国科学家组成的科研小组,通过试验获得了6个罕见的 Fe原子,则该原子的中子数是( )A、19 B、26 C、30 D、453. 化学反应一定伴随着能量变化,下列反应的能量变化与如图相符的是( )
 A、高温煅烧石灰石 B、氧化钙与水反应 C、氢气还原氧化铜 D、Ba(OH)2•8H2O晶体与NH4Cl固体的反应4. 下列物质不能发生水解反应的是( )A、葡萄糖 B、淀粉 C、油脂 D、蛋白质5. 下列物质中,只含有离子键的是( )A、H2O B、CO2 C、MgCl2 D、KOH6. 有关化学用语正确的是( )A、乙烯的结构简式:CH2CH2 B、氮气的电子:
A、高温煅烧石灰石 B、氧化钙与水反应 C、氢气还原氧化铜 D、Ba(OH)2•8H2O晶体与NH4Cl固体的反应4. 下列物质不能发生水解反应的是( )A、葡萄糖 B、淀粉 C、油脂 D、蛋白质5. 下列物质中,只含有离子键的是( )A、H2O B、CO2 C、MgCl2 D、KOH6. 有关化学用语正确的是( )A、乙烯的结构简式:CH2CH2 B、氮气的电子: C、硅的原子结构示意图:
C、硅的原子结构示意图:  D、蔗糖的分子式:C6H12O6
7. 下列物质的性质比较不正确的( )A、热稳定性:HCl>HBr B、沸点:H2O>H2S C、碱性:Ca(OH)2>Mg(OH)2 D、酸性:H3PO4>H2SO48. 如图,将铁棒和碳棒用导线连接后插入稀硫酸中,构成原电池.下列叙述不正确的是( )
D、蔗糖的分子式:C6H12O6
7. 下列物质的性质比较不正确的( )A、热稳定性:HCl>HBr B、沸点:H2O>H2S C、碱性:Ca(OH)2>Mg(OH)2 D、酸性:H3PO4>H2SO48. 如图,将铁棒和碳棒用导线连接后插入稀硫酸中,构成原电池.下列叙述不正确的是( ) A、电子从碳棒经导线流向铁棒 B、铁棒是负极,碳棒是正极 C、电池反应为:Fe+2H+=Fe2++H2↑ D、碳棒上有气体放出,溶液c(H+)减小9. 下列措施是为了降低化学反应速率的是( )A、合成氨的反应中,选择“触媒”作催化剂 B、保存浓硝酸时,通常用棕色瓶并放在阴凉处 C、在试管中进行铝和氢氧化钠溶液反应时,稍微加热 D、用纯锌与稀硫酸反应制取氢气时,在溶液中加入少量硫酸铜溶液10. 阿托酸是一种常用的医药中间体,其结构如图所示.下列关于阿托酸的说法正确的是( )
A、电子从碳棒经导线流向铁棒 B、铁棒是负极,碳棒是正极 C、电池反应为:Fe+2H+=Fe2++H2↑ D、碳棒上有气体放出,溶液c(H+)减小9. 下列措施是为了降低化学反应速率的是( )A、合成氨的反应中,选择“触媒”作催化剂 B、保存浓硝酸时,通常用棕色瓶并放在阴凉处 C、在试管中进行铝和氢氧化钠溶液反应时,稍微加热 D、用纯锌与稀硫酸反应制取氢气时,在溶液中加入少量硫酸铜溶液10. 阿托酸是一种常用的医药中间体,其结构如图所示.下列关于阿托酸的说法正确的是( ) A、分子式为C9H10O2 B、能发生取代、加聚、氧化等反应 C、不能与Na2CO3溶液反应放出气体 D、1 mol阿托酸最多能和5 mol Br2发生加成反应11. 设NA为阿伏加德罗常数值,下列说法不正确的是( )A、10 g D216O中所含中子数为5NA B、标准状况下,22.4 L乙烷中所含共价键数目为7NA C、7.8g Na2O2中所含阴、阳离子总数目为0.4NA D、密闭容器中,1 mol N2和3 mol H2充分反应后,容器中的分子数一定大于2NA12. 海带提碘实验中,不会用到的装置是( )A、
A、分子式为C9H10O2 B、能发生取代、加聚、氧化等反应 C、不能与Na2CO3溶液反应放出气体 D、1 mol阿托酸最多能和5 mol Br2发生加成反应11. 设NA为阿伏加德罗常数值,下列说法不正确的是( )A、10 g D216O中所含中子数为5NA B、标准状况下,22.4 L乙烷中所含共价键数目为7NA C、7.8g Na2O2中所含阴、阳离子总数目为0.4NA D、密闭容器中,1 mol N2和3 mol H2充分反应后,容器中的分子数一定大于2NA12. 海带提碘实验中,不会用到的装置是( )A、 B、
B、 C、
C、 D、
D、 13. 下列说法中,正确的是( )A、非金属元素之间只能形成共价化合物 B、第IA族元素的金属性一定比IIA族元素的金属性强 C、短周期中,同周期元素的离子半径从左到右逐渐减小 D、非金属元素的气态氢化物还原性越强,对应元素的最高价含氧酸酸性越弱14. 下列实验操作和现象与结论的关系不相符的是( )
13. 下列说法中,正确的是( )A、非金属元素之间只能形成共价化合物 B、第IA族元素的金属性一定比IIA族元素的金属性强 C、短周期中,同周期元素的离子半径从左到右逐渐减小 D、非金属元素的气态氢化物还原性越强,对应元素的最高价含氧酸酸性越弱14. 下列实验操作和现象与结论的关系不相符的是( )操作和现象
结论
A
将一小块钠分别投入盛有水和乙醇的小烧杯中,钠与乙醇反应要平缓得多
乙醇羟基中的氢原子不如水分子中的氢原子活泼
B
在催化剂存在的条件下,石蜡油加强热生成的气体通入溴的四氯化碳溶液中,溶液褪色
石蜡油的分解产物中含有烯烃
C
向盛有Na2CO3固体的锥形瓶中滴加稀盐酸,产生无色气体
不能证明氯元素的非金属性强于碳元素
D
向蔗糖溶液中加入稀硫酸,水浴加热一段时间后,再加入新制Cu(OH)2悬浊液,用酒精灯加热,未见砖红色沉淀
蔗糖未水解
A、A B、B C、C D、D15. 有aW、bX、cY、dZ四种短周期元素,已知d﹣c=c﹣b=b﹣a=5,且W、X、Y的最外层电子数总和大于Z的最外层电子数.下列说法不正确的是( )A、W元素的单质常温下是气体 B、X是蛋白质的组成元素之一 C、Y元素的单质能与冷水发生剧烈反应 D、Z元素的气态氢化物的水溶液呈酸性16. MO2受热分解为+4和+2价的混合氧化物,+4价的M能氧化浓盐酸生成Cl2 , 将1mol MO2加热分解得到O2 , 再向残余固体中加入过量的浓盐酸得到Cl2 , 所得 O2和Cl2物质的量之比为3:2,则残余固体的组成及物质的量之比可能是( )A、M3O4、MO 1:1 B、MO2、MO 3:1 C、M3O4、MO2 2:1 D、MO2、MO 1:4二、非选择题
-
17. 如表是元素周期表的一部分,用化学用语回答:
族
周期
IA
IIA
IIIA
IVA
VA
VIA
VIIA
二
]
①
②
三
③
④
⑤
⑥
四
⑦
(1)、②的元素符号为 .(2)、比较元素③和⑦的原子半径大小:③⑦(填“>”或“<”).(3)、绘出元素⑤的离子结构示意图 .(4)、元素①的氢化物的电子式为 , 将该氢化物通入④和⑥形成的化合物的水溶液中,发生反应的离子方程式为 .18. 如图所示的过程是目前直接利用太阳能的研究热点.人们把通过人工光化学手段合成燃料的过程叫做人工光合作用. (1)、在上图构想的物质和能量循环中太阳能最终转化为能.(2)、人工光合作用的途径之一就是在催化剂和光照条件下,将CO2和H2O转化为CH3OH,该反应的化学方程式为:2CO2(g)+4H2O(g) 2CH3OH(g)+3O2(g).
(1)、在上图构想的物质和能量循环中太阳能最终转化为能.(2)、人工光合作用的途径之一就是在催化剂和光照条件下,将CO2和H2O转化为CH3OH,该反应的化学方程式为:2CO2(g)+4H2O(g) 2CH3OH(g)+3O2(g).一定条件下,在2L密闭容器中进行上述反应,测得n(CH3OH)随时间的变化如下表所示:
时间/min
0
1
2
3
4
5
6
n(CH3OH)/mol
0.000
0.040
0.070
0.090
0.100
0.100
0.100
①用CH3OH表示0~3min内该反应的平均反应速率为 .
②能说明该反应已达到平衡状态的是 .
a.v正(H2O)=2v逆(CO2)
b.n(CH3OH):n(O2)=2:3
c.容器内密度保持不变
d.容器内压强保持不变
(3)、用人工光合作用得到的甲醇、氧气和稀硫酸制作燃料电池,则甲醇应通入该燃料电池的极(填“正”或“负”),通入氧气的一极的电极反应式为 .19. 下表是A、B、C、D四种常见有机物的相关信息.有机物A
有机物B
有机物C
有机物D
①可用于果实催熟
②比例模型为

①由C、H两种元素组成
②球棍模型为

①生活中常见的液态有机物,分子中碳原子数与有机物A相同
②能与Na反应,但不能与NaOH反应
①相对分子质量比有机物C大14
②能由有机物C氧化生成
根据表中信息回答下列问题:
(1)、有机物A的分子式为 .(2)、下列有关有机物A、B的说法正确的是a.A,B均可使酸性KMnO4溶液褪色
b.A,B分子中所有的原子在同一平面内
c.等质量的A,B完全燃烧,消耗氧气的量相同
d.A,B分子均含有官能团碳碳双键,能发生加成反应
(3)、写出有机物C的同分异构体的结构简式 .(4)、在一定条件下,有机物C与有机物D反应能生成具有水果香味的物质E,其化学反应方程式为 , 某次实验中,以5.0gD为原料,制得4.4gE,则D的转化率为 .20. 海水中含有丰富的Na+、Mg2+、Cl﹣、Br﹣等化学资源.将海水淡化与浓缩海水结合是综合利用海水资源的途径之一.以浓缩海水为原料,通过一系列工艺流程可以提取Mg、Br2等产品.(1)、如图是采用膜分离技术的海水淡化示意图.淡化膜可以让水分子通过,而海水中其他分子和离子均不能通过.加压后,左侧淡水中增加的是(填字母).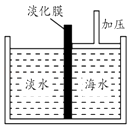
a.溶质质量 b.溶剂质量 c.溶质的质量分数
(2)、从海水中提取镁的主要步骤如下: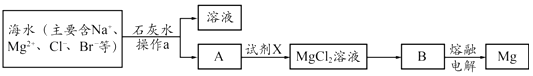
①操作a的名称是 .
②写出B冶炼金属镁的化学方程式 .
(3)、空气吹出法是用于工业规模海水提溴的常用方法,其中一种工艺是以预先经过酸化的浓缩海水为原料,通过以下步骤提取溴:步骤一:用氯气置换溴离子使之成为单质溴;
步骤二:通入空气和水蒸气,将溴吹入吸收塔,使溴蒸气和吸收剂SO2发生作用转化成氢溴酸;
步骤三:用氯气将氢溴酸氧化得到产品溴.
①步骤一和步骤二的目的是 .
②步骤二中发生反应的化学方程式为 .
21. 利用甲烷与氯气发生取代反应制取副产品盐酸的设想在工业上已成为现实.某化学兴趣小组在实验室中模拟上述过程,设计的模拟装置如下:

根据设计要求回答:
(1)、在B装置中,经过一段时间的光照,发现硬质玻璃管内壁有黑色小颗粒产生,写出置换出黑色小颗粒的化学方程式 .(2)、C装置的石棉中均匀混有KI粉末,其作用是 .(3)、D装置用于吸收HCl的优点是 .(4)、从环保的角度考虑,该装置还不完善,原因是没有进行尾气处理,其尾气主要成分可能有(填编号).a.CH4 b.CH3Cl c.CH2Cl2 d.CHCl3 e.CCl4
(5)、其他条件均不变,若去掉A装置,则D中所得盐酸的浓度将(填“不变”、“变大”或“变小”),你认为可能原因是 .