湖北省部分重点中学2016-2017学年高一下学期期末考试试卷
试卷更新日期:2017-09-16 类型:期末考试
一、选择题
-
1. 已知反应X+Y=M+N为吸热反应,对这个反应的下列说法中正确的是( )A、X的能量一定低于M的,Y的能量一定低于N的 B、因为该反应为吸热反应,故一定要加热反应才能进行 C、破坏反应物中的化学键所吸收的能量小于形成生成物中化学键所放出的能量 D、X和Y的总能量一定低于M和N的总能量2. 下列各组热化学方程式中,化学反应的△H前者大于后者的是( )
①C(s)+O2(g)═CO2(g);△H1 C(s)+ O2(g)═CO(g);△H2
②S(s)+O2(g)═SO2(g);△H3 S(g)+O2(g)═SO2(g);△H4
③H2(g)+ O2(g)═H2O(l);△H5 2H2(g)+O2(g)═2H2O(l);△H6
④CaCO3(s)═CaO(s)+CO2(g);△H7 CaO(s)+H2O(l)═Ca(OH)2(s);△H8 .
A、① B、④ C、②③④ D、①②③3. 已知:H2(g)+F2(g)═2HF(g)△H=﹣546.6kJ•mol﹣1 , 下列说法不正确的是( )A、44.8 L氟化氢气体分解成22.4 L的氢气和22.4 L的氟气吸收546.6 kJ热量 B、1 mol 氢气与1 mol氟气反应生成2 mol液态氟化氢放出的热量大于546.6 kJ C、相同条件下,1 mol 氢气与1 mol氟气的能量总和高于2 mol氟化氢气体的能量 D、2 mol H﹣F键的键能比 1 mol H﹣H 键和1 mol F﹣F键的键能之和大546.6 kJ4. 下列依据热化学方程式得出的结论正确的是( )A、若C(石墨,s)=C(金刚石,s)△H>0,则金刚石比石墨稳定 B、已知NaOH(aq)+HCl(aq)═NaCl(aq)+H2O(l)△H=﹣57.3 kJ•mol﹣1 , 则20.0g NaOH固体与稀盐酸完全中和,放出28.65 kJ的热量 C、因为热化学方程式中的化学计量数只表示物质的量,所以化学计量数可以是分数 D、若2H2(g)+O2(g)═2H2O(g)△H=﹣483.6 kJ•mol﹣1 , 则H2燃烧热为241.8 kJ•mol﹣15. 已知在25℃、101kPa下,1g C8H18(l)燃烧生成CO2和液态H2O时放出48.40kJ的热量,表示上述反应的热化学方程式正确的是( )A、C8H18(l)+ O2(g)═8CO2(g)+9H2O(g)△H=﹣48.40 kJ•mol﹣1 B、C8H18(l)+ O2(g)═8CO2(g)+9H2O(l)△H=﹣5 517.6 kJ•mol﹣1 C、C8H18(l)+ O2(g)═8CO2(g)+9H2O(g)△H=+5 517.6 kJ•mol﹣1 D、2C8H18(l)+25O2(g)═16CO2(g)+18 H2O(l)△H=﹣5 517.6 kJ•mol﹣16. 已知反应:①2H2O(g)=2H2(g)+O2(g)△H1②Cl2(g)+H2(g)=2HCl(g)△H2③2Cl2(g)+2H2O(g)=4HCl(g)+O2(g)△H3
则△H1、△H2、△H3间的关系正确的是( )
A、△H1+△H2=△H3 B、△H1﹣△H2=△H3 C、△H1+2△H2=△H3 D、△H1﹣2△H2=△H37. 下列叙述正确的是( )A、金属腐蚀就是金属失去电子被还原的过程 B、将水库中的水闸(钢板)与外加直流电源的负极相连接,可防止水闸被腐蚀 C、合金的熔点都高于它的成分金属,合金的耐腐蚀性也都比其成分金属强 D、铜板上的铁铆钉处在潮湿的空气中直接发生反应:Fe﹣3e+=Fe3+ , 继而形成铁锈8. 氢氧燃料电池用于航天飞机,以30%KOH溶液为电解质溶液的这种电池在使用时,下列说法错误的是( )A、H2在负极发生的电极反应是:2H2+4OH﹣﹣4e﹣═4H2O B、供电时的总反应为:2H2+O2═2H2O C、O2正极的电极反应是:O2+2H2O+4e﹣═4OH﹣ D、燃料电池的能量转化率可达100%9. 某实验兴趣小组按如图装置实验后,所记录内容合理的是( )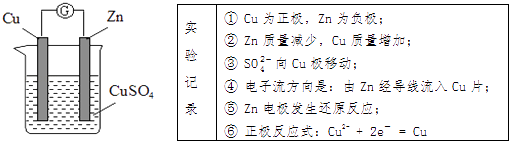 A、②③④ B、①②④⑥ C、①②④⑤ D、②③⑤⑥10. 化学用语是学习化学的重要工具,下列用来表示物质变化的化学用语中,正确的是( )A、用惰性电极电解饱和食盐水时,阳极的电极反应式为2Cl﹣﹣2e﹣═Cl2↑ B、氢氧燃料电池的负极反应式:O2+2H2O+4e﹣═4OH﹣ C、粗铜精炼时,与电源正极相连的是纯铜,阳极反应式为Cu﹣2e﹣═Cu2+ D、钢铁发生电化学腐蚀的正极反应式:Fe﹣2e﹣═Fe2+11. 观察下列几个装置示意图,有关叙述正确的是( )
A、②③④ B、①②④⑥ C、①②④⑤ D、②③⑤⑥10. 化学用语是学习化学的重要工具,下列用来表示物质变化的化学用语中,正确的是( )A、用惰性电极电解饱和食盐水时,阳极的电极反应式为2Cl﹣﹣2e﹣═Cl2↑ B、氢氧燃料电池的负极反应式:O2+2H2O+4e﹣═4OH﹣ C、粗铜精炼时,与电源正极相连的是纯铜,阳极反应式为Cu﹣2e﹣═Cu2+ D、钢铁发生电化学腐蚀的正极反应式:Fe﹣2e﹣═Fe2+11. 观察下列几个装置示意图,有关叙述正确的是( ) A、装置①中阳极上析出红色固体 B、装置②的待镀铁制品应与电源正极相连 C、装置③中外电路电子由a极流向b极 D、装置④的离子交换膜允许阳离子、阴离子、水分子自由通过12. 下列说法正确的是( )A、
A、装置①中阳极上析出红色固体 B、装置②的待镀铁制品应与电源正极相连 C、装置③中外电路电子由a极流向b极 D、装置④的离子交换膜允许阳离子、阴离子、水分子自由通过12. 下列说法正确的是( )A、 用如图装置电解精炼镁
B、
用如图装置电解精炼镁
B、 用如图装置验证试管中铁丝发生析氢腐蚀
C、
用如图装置验证试管中铁丝发生析氢腐蚀
C、 如图装置中Mg作负极,Al作正极
D、
如图装置中Mg作负极,Al作正极
D、 用如图装置对二次电池进行充电
13. 下列四支试管中,过氧化氢分解的化学反应速率最大的是( )
用如图装置对二次电池进行充电
13. 下列四支试管中,过氧化氢分解的化学反应速率最大的是( )试管
温度
过氧化氢浓度
催化剂
A
室温(25℃)
12%
有
B
水浴加热(50℃)
4%
无
C
水浴加热( 50℃)
12%
有
D
室温(25℃)
4%
无
A、A B、B C、C D、D14. 一定温度下反应4A(s)+3B(g)⇌2C(g)+D(g)经2min B的浓度减少0.6mol•L﹣1 , 对此反应速率的表示正确的是( )A、用A表示的反应速率是0.4mol•L﹣1•min﹣1 B、分别用B,C,D表示反应的速率,其比值是1:2:3 C、2min末的反应速率v(B)=0.3mol•L﹣1•min﹣1 D、在这2min内用B和C表示的正反应速率的值都是逐渐减小的15. 对于可逆反应A(g)+3B(g)⇌2C(g)+2D(g),在不同条件下的化学反应速率如下,其中表示的反应速率最快的是( )A、v(A)=0.5 mol•L﹣1•min﹣1 B、v(B)=1.2 mol•L﹣1•s﹣1 C、v(D)=0.4 mol•L﹣1•min﹣1 D、v(C)=0.1 mol•L﹣1•s﹣116. 将下列装置如图连接,D、F、X、Y、E 都是铂电极,C是铁电极.甲,乙,丙三个装置中电解前后溶液的体积都是500mL.将电源接通后,向乙中滴入酚酞试液,在F极附近显红色.下列说法不正确的是( )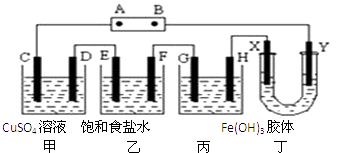 A、电源B 极的名称是负极,丁中Y极附近颜色变深 B、乙装置中电解一段时间后,加入0.2mol盐酸则可以恢复原来的浓度 C、设甲池中溶液的体积在电解前后都是500mL,当乙池所产生气体的体积为4.48L(标准状况)时,甲池中所生成物质的物质的量浓度为0.2mol/L D、甲装置中电解反应的总化学方程式是:CuSO4+Fe Cu+FeSO4
A、电源B 极的名称是负极,丁中Y极附近颜色变深 B、乙装置中电解一段时间后,加入0.2mol盐酸则可以恢复原来的浓度 C、设甲池中溶液的体积在电解前后都是500mL,当乙池所产生气体的体积为4.48L(标准状况)时,甲池中所生成物质的物质的量浓度为0.2mol/L D、甲装置中电解反应的总化学方程式是:CuSO4+Fe Cu+FeSO4二、非选择题
-
17. 已知下列热化学方程式:①H2(g)+ O2(g)=H2O(l)△=﹣285.8kJ•mol﹣1
②H2(g)+ O2(g)=H2O(g)△H=﹣241.8kJ•mol﹣1
③C(s)+ O2(g)=CO(g)△H=﹣110.5kJ•mol﹣1
④C(s)+O2(g)=CO2(g)△H=﹣393.5kJ•mol﹣1 ,
回答下列问题:
(1)、上述反应中属于放热反应的是(填序号)(2)、C的燃烧热为(3)、燃烧20g H2生成液态水,放出的热量为(4)、写出CO燃烧的热化学方程式 .18. 对钢铁制品进行抗腐蚀处理,可适当延长其使用寿命.(1)、抗腐蚀处理前,生产中常用盐酸来除铁锈.现将一表面生锈的铁件放入盐酸中,除去铁锈的化学反应的离子方程式为: .(2)、利用如图装置,可以模拟铁的电化学防护.①若X为碳棒,为减缓铁件的腐蚀,开关K应置于处.
②若X为锌,开关K置于M处,该电化学防护法称为 .
(3)、图中若X为粗铜,容器中海水替换为硫酸铜溶液,开关K置于N处,一段时间后,当铁件质量增加3.2g时,转移的电子数为NA . 铁件表面镀铜可有效防止铁被腐蚀,如果铁件部分未镀上铜,或镀层破损,镀铜铁比镀锌铁反而更易被腐蚀,请简要说明原因: . 19. 根据问题填空:(1)、已知H+(aq)+OH﹣(aq)═H2O(l)△H=﹣57.3kJ•mol﹣1 . 若向三份等体积、等物质的量浓度的NaOH溶液中分别加入醋酸、浓硫酸、稀硝酸至恰好完全反应,并将上述过程中放出的热量分别记为Q1kJ、Q2kJ、Q3kJ.则三者的由小到大关系是(用Q1、Q2、Q3表示).(2)、如图所示A为泡沫塑料板,上面有两个小孔,分别插入温度计和环形玻璃搅拌棒,两个小孔不能开得过大,其目的是; 若实验中不加盖泡沫塑料板,则求得的中和热数值(填偏大、偏小、无影响)
19. 根据问题填空:(1)、已知H+(aq)+OH﹣(aq)═H2O(l)△H=﹣57.3kJ•mol﹣1 . 若向三份等体积、等物质的量浓度的NaOH溶液中分别加入醋酸、浓硫酸、稀硝酸至恰好完全反应,并将上述过程中放出的热量分别记为Q1kJ、Q2kJ、Q3kJ.则三者的由小到大关系是(用Q1、Q2、Q3表示).(2)、如图所示A为泡沫塑料板,上面有两个小孔,分别插入温度计和环形玻璃搅拌棒,两个小孔不能开得过大,其目的是; 若实验中不加盖泡沫塑料板,则求得的中和热数值(填偏大、偏小、无影响) (3)、实验室用50mL 0.50mol•L﹣1盐酸、50mL 0.55mol•L﹣1NaOH溶液利用如图装置,进行测定中和热的实验.假设盐酸和氢氧化钠溶液的密度都是1g/cm3 , 又知中和后生成溶液的比热容c=4.18J/(g•℃).为了计算中和热,实验时还需测量的数据有(填序号) .A、反应前盐酸的温度 B、反应前盐酸的质量 C、反应前氢氧化钠溶液的温度 D、反应前氢氧化钠溶液的质量 E、反应后混合溶液的最高温度 F、反应后混合溶液的质量(4)、某学生实验记录数据如下:
(3)、实验室用50mL 0.50mol•L﹣1盐酸、50mL 0.55mol•L﹣1NaOH溶液利用如图装置,进行测定中和热的实验.假设盐酸和氢氧化钠溶液的密度都是1g/cm3 , 又知中和后生成溶液的比热容c=4.18J/(g•℃).为了计算中和热,实验时还需测量的数据有(填序号) .A、反应前盐酸的温度 B、反应前盐酸的质量 C、反应前氢氧化钠溶液的温度 D、反应前氢氧化钠溶液的质量 E、反应后混合溶液的最高温度 F、反应后混合溶液的质量(4)、某学生实验记录数据如下:实验序号
起始温度t1/℃
终止温度t2/℃
盐酸
氢氧化钠溶液
混合溶液
1
20.0
20.1
23.4
2
20.2
20.4
23.6
3
20.5
20.6
23.8
依据该学生的实验数据计算,该实验测得的中和热△H为 . (保留三位有效数字)
20. 某兴趣小组的同学用如图所示装置研究有关电化学的问题.当闭合该装置的电键时,观察到电流计的指针发生了偏转.请回答下列问题: (1)、甲池中通入CH3OH电极的电极反应为 .(2)、乙池中A(石墨)电极的名称为(填“正极”、“负极”或“阴极”、“阳极”),乙池中总反应式为 .(3)、当乙池中B极质量增加5.40g时,甲池中理论上消耗O2的体积为mL(标准状况),丙池中(填“C”或“D”)极析出g铜.21. 某温度时在2L容器中X、Y、Z三种气态物质的物质的量(n)随时间(t)变化的曲线如图所示,由图中数据分析:
(1)、甲池中通入CH3OH电极的电极反应为 .(2)、乙池中A(石墨)电极的名称为(填“正极”、“负极”或“阴极”、“阳极”),乙池中总反应式为 .(3)、当乙池中B极质量增加5.40g时,甲池中理论上消耗O2的体积为mL(标准状况),丙池中(填“C”或“D”)极析出g铜.21. 某温度时在2L容器中X、Y、Z三种气态物质的物质的量(n)随时间(t)变化的曲线如图所示,由图中数据分析: (1)、该反应的化学方程式为: .(2)、反应开始至2min,用Z表示的平均反应速率为: .(3)、在下列事实中,什么因素影响了化学反应的速率?
(1)、该反应的化学方程式为: .(2)、反应开始至2min,用Z表示的平均反应速率为: .(3)、在下列事实中,什么因素影响了化学反应的速率?①同浓度、同体积的盐酸中放入大小相同的铁片和镁片产生气体有快有慢:;
②熔化的KClO3放出气泡很慢,加入少量MnO2很快产生气体: .
(4)、在密闭容器里,通入a mol X(g)和b mol Y(g),发生反应X(g)+Y(g)⇌2Z(g),当改变下列条件时,反应速率会发生什么变化?(选填“增大”、“减小”或“不变”)①升高温度,反应速率;
②保持容器体积不变,充入不参加反应的惰性气体,反应速率 .