浙江省嘉兴市2016-2017学年高一上学期期末考试试卷
试卷更新日期:2017-09-16 类型:期末考试
一、选择题
-
1. 化学与生活是紧密相联的,下列说法正确的是( )A、为防止食品的氧化变质,常在食品包装袋中放入生石灰 B、节日里绚丽的烟花,是通过某些金属元素的化学变化实现的 C、SO2具有漂白性,通常用于银耳等食品的漂白 D、干冰或碘化银可用于进行人工降雨2. 人们对原子结构的认识有一个不断深入的过程,其中提出“葡萄干面包”原子模型的科学家是( )A、道尔顿 B、汤姆生 C、卢瑟福 D、玻尔3. 下列物质属于酸性氧化物的是( )A、Na2O2 B、CO C、CaO D、SiO24. 下列仪器对应名称不正确的是( )A、
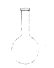 蒸馏烧瓶
B、
蒸馏烧瓶
B、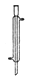 冷凝管
C、
冷凝管
C、 蒸发皿
D、
蒸发皿
D、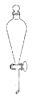 分液漏斗
5. 下列反应中既属于分解反应又属于氧化还原反应的是( )A、Fe+2HCl═FeCl2+H2 B、CH4 C+2H2 C、Mg(OH)2+2HCl═MgCl2+2H2O D、CaCO3 CaO+CO26. 下列溶液中,氯离子的物质的量浓度是3mol•L﹣1的是( )A、200mL 3mol•L﹣1 NaClO3溶液 B、100mL 2mol•L﹣1 FeCl3溶液 C、150mL 3mol•L﹣1 KCl溶液 D、150mL 1mol•L﹣1 MgCl2溶液7. 下列有关氯化铁溶液与氢氧化铁胶体叙述正确的是( )A、分散质颗粒直径都在1~100nm之间 B、都能透过半透膜 C、都是均一、稳定的液体 D、都能产生丁达尔效应8. 下列关于常见物质的工业制法的叙述,不正确的是( )A、工业制硅:用焦炭在高温下还原二氧化硅可制得高纯硅 B、工业冶炼铁:需要用到的原料有铁矿石、焦炭、空气和石灰石 C、工业冶炼镁:电解熔融的无水氯化镁,可以得到金属镁 D、工业制玻璃:将石灰石、纯碱、石英在玻璃熔炉中高温熔融制得9. 下列有关硫酸的性质,叙述正确的是( )A、浓硫酸因具有吸水性,所以能使蔗糖炭化 B、实验室用浓硫酸与亚硫酸钠反应制SO2 , 体现浓硫酸的强氧化性 C、常温下,铁遇浓硫酸发生钝化,铁表面生成致密的氧化膜 D、浓硫酸作干燥剂,可以干燥H2、CO2、NH3、Cl2等气体10. 医学上通过研究并实现了利用含放射性元素32P的“纸贴”治疗疤痕疙瘩,下列有关32P和31P的叙述正确的是( )A、32P和31P属于同一种核素 B、32P的原子中所含的质子数为16 C、31P的中子数为16 D、32P的摩尔质量为3211. 表中的物质分类,正确的是( )
分液漏斗
5. 下列反应中既属于分解反应又属于氧化还原反应的是( )A、Fe+2HCl═FeCl2+H2 B、CH4 C+2H2 C、Mg(OH)2+2HCl═MgCl2+2H2O D、CaCO3 CaO+CO26. 下列溶液中,氯离子的物质的量浓度是3mol•L﹣1的是( )A、200mL 3mol•L﹣1 NaClO3溶液 B、100mL 2mol•L﹣1 FeCl3溶液 C、150mL 3mol•L﹣1 KCl溶液 D、150mL 1mol•L﹣1 MgCl2溶液7. 下列有关氯化铁溶液与氢氧化铁胶体叙述正确的是( )A、分散质颗粒直径都在1~100nm之间 B、都能透过半透膜 C、都是均一、稳定的液体 D、都能产生丁达尔效应8. 下列关于常见物质的工业制法的叙述,不正确的是( )A、工业制硅:用焦炭在高温下还原二氧化硅可制得高纯硅 B、工业冶炼铁:需要用到的原料有铁矿石、焦炭、空气和石灰石 C、工业冶炼镁:电解熔融的无水氯化镁,可以得到金属镁 D、工业制玻璃:将石灰石、纯碱、石英在玻璃熔炉中高温熔融制得9. 下列有关硫酸的性质,叙述正确的是( )A、浓硫酸因具有吸水性,所以能使蔗糖炭化 B、实验室用浓硫酸与亚硫酸钠反应制SO2 , 体现浓硫酸的强氧化性 C、常温下,铁遇浓硫酸发生钝化,铁表面生成致密的氧化膜 D、浓硫酸作干燥剂,可以干燥H2、CO2、NH3、Cl2等气体10. 医学上通过研究并实现了利用含放射性元素32P的“纸贴”治疗疤痕疙瘩,下列有关32P和31P的叙述正确的是( )A、32P和31P属于同一种核素 B、32P的原子中所含的质子数为16 C、31P的中子数为16 D、32P的摩尔质量为3211. 表中的物质分类,正确的是( )强电解质
弱电解质
非电解质
A
钠
碳酸
氨气
B
氯化钠
水
Cu
C
硫酸钡
氢氧化钙
硅酸
D
烧碱
次氯酸
CO2
A、A B、B C、C D、D12. 实验室有两瓶失去标签的溶液,其中一瓶是Na2CO3溶液,另一瓶是NaOH溶液,浓度均未知.鉴别时,下列选用的试纸或试剂不正确的是( )A、酚酞溶液 B、HCl溶液 C、BaCl2溶液 D、Ba(OH)2溶液13. 实验室保存下列化学试剂的方法不正确的是( )A、新制氯水放在棕色试剂瓶中,避光保存 B、液溴密封盛放在棕色瓶中,液面上放一层水 C、少量金属钠保存在四氯化碳中 D、水玻璃保存在带胶塞的玻璃试剂瓶中14. 下列有关说法正确的是( )A、将一小块钠投入硫酸铜溶液,会析出紫红色的铜 B、将金属钠放置在空气中,最终转化为碳酸钠 C、铁在氧气中燃烧,可以得到红色的三氧化二铁 D、硫在过量的氧气中燃烧,可以得到产物SO315. 下列有关说法不正确的是( )A、溴化银是一种重要的感光材料,是胶卷中的核心成分之一 B、硅晶体是一种重要的半导体材料,还可用于制造光导纤维 C、镁燃烧发出耀眼的白光,常用于制造信号弹和焰火 D、硫酸钡不容易被X射线透过,在医疗上可用作检查肠胃的内服药剂16. 下列有关反应原理与化学反应方程式相符的是( )A、过量的铁粉在氯气中燃烧:Fe+Cl2 FeCl2 B、金属钠在空气中燃烧:4Na+O2 2Na2O C、高炉炼铁中,还原铁矿石:2Fe2O3+3C 4Fe+3CO2 D、金属镁着火,不能用CO2灭火:2Mg+CO2 2MgO+C17. 在向盛有氯化铁溶液的烧杯中加入过量铜粉,反应结束后过滤,对溶液中大量存在的金属阳离子的成分判断正确的是( )A、只有Cu2+ B、Fe2+、Cu2+ C、Fe3+、Fe2+ D、Fe3+、Cu2+18. 下列离子方程式书写正确的是( )A、铁粉放入稀硫酸溶液:2Fe+6H+═2Fe3++3H2↑ B、往NH4HCO3溶液中加过量的NaOH溶液并加热:NH4++OH﹣ NH3↑+H2O C、石灰石与稀盐酸反应:CO32﹣+2H+═CO2↑+H2O D、Cl2通入水中:Cl2+H2O⇌H++Cl﹣+HClO19. 下列实验操作或结论叙述不正确的是( )A、用洁净的铂丝蘸取某溶液,置于火焰上灼烧,透过蓝色钴玻璃能观察到火焰呈紫色,则该溶液中一定含有钾离子 B、向某溶液中滴加足量稀盐酸,产生的气体能使澄清石灰水变浑浊,则说明原溶液中一定含CO32﹣ C、分液时,分液漏斗中下层液体从下口放出,上层液体从上口倒出 D、如果在蒸馏实验中忘记加沸石,可以先停止加热,待溶液冷却后补加沸石,再继续加热蒸馏20. 用NA表示阿伏加德罗常数的值,下列叙述中正确的是( )A、在常温常压下,2.24L NH3与1.8g H2O,所含的质子数均为NA B、在常温常压下,1mol Cl2与足量的NaOH溶液完全反应,转移电子2NA C、在标准状况下,64g SO2 中含有的原子数为3NA D、在标准状况下,11.2L H2O含有的分子数为0.5NA21. 已知一定条件下硫酸铵分解反应为4(NH4)2SO4=N2↑+6NH3↑+3SO2↑+SO3↑+7H2O,将反应后的混合气体通入氯化钡溶液中,下列判断正确的是( )A、得到的沉淀是BaSO4 B、得到的沉淀是BaSO4和BaSO3 C、一定无BaSO3生成 D、无沉淀生成22. 下列装置或操作正确并能达到实验目的( ) A、用Ⅰ图装置,可得到干燥的CO2 B、用Ⅱ图装置,若C中出现白色沉淀,则可说明H2CO3的酸性强于H2SiO3 C、用Ⅲ图装置,可除去氯化钠溶液中的泥沙 D、用Ⅳ图装置,分离乙醇和水23. 海带中含有丰富的碘元素,在实验室中,我们可以用海带通过多步实验制成碘水,下列说法正确的是( )A、该实验过程中要用到氧化剂 B、检验碘单质是否存在,可用碘化钾溶液 C、要萃取碘水中的碘,可以用汽油或酒精 D、利用如图所示装置不能分离食盐和晶体碘的混和物
A、用Ⅰ图装置,可得到干燥的CO2 B、用Ⅱ图装置,若C中出现白色沉淀,则可说明H2CO3的酸性强于H2SiO3 C、用Ⅲ图装置,可除去氯化钠溶液中的泥沙 D、用Ⅳ图装置,分离乙醇和水23. 海带中含有丰富的碘元素,在实验室中,我们可以用海带通过多步实验制成碘水,下列说法正确的是( )A、该实验过程中要用到氧化剂 B、检验碘单质是否存在,可用碘化钾溶液 C、要萃取碘水中的碘,可以用汽油或酒精 D、利用如图所示装置不能分离食盐和晶体碘的混和物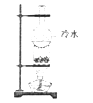 24. m g铜与足量浓H2SO4共热时完全反应,收集到n L SO2 , 则被还原的H2SO4的物质的量是( )A、 mol B、 mol C、 mol D、 mol25. 某溶液中只可能含有下列离子中的几种:Na+、NH4+、SO42﹣、CO32﹣、NO3﹣、Cl﹣(不考虑溶液中少量的H+和OH﹣),取200mL该溶液,分为两等份进行下列实验:
24. m g铜与足量浓H2SO4共热时完全反应,收集到n L SO2 , 则被还原的H2SO4的物质的量是( )A、 mol B、 mol C、 mol D、 mol25. 某溶液中只可能含有下列离子中的几种:Na+、NH4+、SO42﹣、CO32﹣、NO3﹣、Cl﹣(不考虑溶液中少量的H+和OH﹣),取200mL该溶液,分为两等份进行下列实验:①第一份加入足量的烧碱并加热,产生的气体在标准状况下为224mL;
②第二份先加入足量的盐酸,无现象,再加入足量的BaCl2溶液,得固体2.33g.
③在②的滤液中滴入AgNO3 , 产生白色沉淀,加稀硝酸,沉淀不溶解.
下列说法正确的是( )
A、该溶液中可能含Na+ B、该溶液中肯定含有NH4+、SO42﹣、Cl﹣ C、该溶液中一定不含NO3﹣、CO3﹣ D、该溶液中一定含有Na+二、解答题
-
26. 按要求填空(1)、S2﹣中含有18个电子,画出S的原子结构示意图 .(2)、一水合氨(NH3•H2O)是一种弱电解质,在水中可电离出铵根离子和氢氧根离子,试写出一水合氨的电离方程式 .(3)、正长石的组成可表示为KAlSi3Ox , 试根据化合价计算x= .27. 化合物Q是一种具有耐高温等优异性能的新型陶瓷.工业上可用以下方法制取:
3SiO2+6C+2N2 Q+6CO
(1)、根据上述反应,推测Q的化学式为 .(2)、上述反应中的还原剂是 .(3)、上述反应中,每消耗90g SiO2 , 可生成产物Qg.28. 氯气是一种非常重要的化工原料.请回答下列问题:(1)、实验室用二氧化锰和浓盐酸为原料制取氯气,请写出反应的化学方程式 .(2)、将氯气通入品红溶液,品红褪色,起作用的微粒是 , SO2也能使品红褪色;但是将氯气和SO2等体积混合,通入水中后,水溶液不再有漂白作用,试推测在此过程中,氯气与SO2(包括水)反应的离子方程式是 .(3)、工业用氯气与石灰乳制漂白粉,漂白粉的有效成分是 .(4)、向FeI2溶液中通入过量的氯气时,所发生的化学反应的方程式是 .29. 将大部分已经锈蚀(成分为Fe2O3)的废铁屑制备绿矾(FeSO4•7H2O),实验操作过程如下: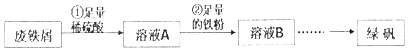
已知:杂质不溶于稀硫酸.
请回答下列问题:
(1)、步骤①中,稀硫酸与Fe2O3反应的方程式为 , 废铁屑用硫酸处理后,还含有不溶性杂质,为获取澄清的A溶液,需进行的操作名称是 .(2)、步骤②中溶液A与铁粉反应的离子方程式为 .(3)、检验溶液B中是否还存在Fe3+的方法是 .30. 某研究性学习小组根据老师的学案设计实验对碳酸钠和碳酸氢钠的性质进行研究.(1)、甲同学设计除去碳酸氢钠溶液中碳酸钠杂质的方法:向溶液中通入足量的二氧化碳.请写出相关反应的离子方程式 .(2)、乙同学设计如图实验装置,比较碳酸氢钠和碳酸钠的热稳定性,并检验分解产物.最好应在a试管底部加入(填化学式).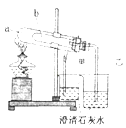 (3)、小苏打长期放置在空气中会变质(部分转变为碳酸钠),丙同学称取27.4g变质小苏打样品,经过充分加热、冷却、称量,所得固体的质量为21.2g,则原混合物中碳酸钠的质量为 .31. 实验室需要配制100mL 0.1mol•L﹣1 CuSO4溶液.(1)、本实验用到的基本实验仪器除托盘天平、胶头滴管、玻璃棒、100mL容量瓶外,还必须使用一种玻璃仪器是 .(2)、下列有关实验说法正确的是 .
(3)、小苏打长期放置在空气中会变质(部分转变为碳酸钠),丙同学称取27.4g变质小苏打样品,经过充分加热、冷却、称量,所得固体的质量为21.2g,则原混合物中碳酸钠的质量为 .31. 实验室需要配制100mL 0.1mol•L﹣1 CuSO4溶液.(1)、本实验用到的基本实验仪器除托盘天平、胶头滴管、玻璃棒、100mL容量瓶外,还必须使用一种玻璃仪器是 .(2)、下列有关实验说法正确的是 .a.需称量CuSO4•5H2O晶体2.5g
b.将固体溶解、冷却后,依照如图转移至容量瓶

c.需用蒸馏水洗涤烧杯和玻璃棒2﹣3次,洗涤液均转入容量瓶
d.定容摇匀后,发现液面低于刻度线,继续向容量瓶中加水至凹液面与刻度相切即可
(3)、若实验遇到下列情况,分析对所配制溶液的浓度的影响(选填“偏高”、“偏低”、“无影响”)①容量瓶内壁附有水珠而未干燥 ,
②在定容时,俯视刻度线 .
32. 现有200mL盐酸与硫酸的混合溶液,其中H+浓度为2.5mol•L﹣1 , 向溶液中逐滴加入Ba(OH)2溶液200mL时,恰好沉淀完全,得到沉淀4.66g.(1)、原溶液中H+的物质的量为mol.(2)、加入的Ba(OH)2的物质的量浓度为mol•L﹣1 .(3)、原溶液中HCl的物质的量浓度为mol•L﹣1 .