河北省2020年高考理综-化学一模试卷(全国Ⅰ卷)
试卷更新日期:2020-05-11 类型:高考模拟
一、选择题
-
1. 化学与生活密切相关,下列说法正确的是( )A、中国天眼用到碳化硅,芯片用到高纯硅,石英玻璃用到硅酸盐 B、《本草经集注》中关于鉴别硝石(KNO3)和朴硝(Na2SO4)的记载:“以火烧之,紫青烟起,乃真硝石也”,该方法应用了焰色反应 C、宋·王希孟《千里江山图》卷中的绿色颜料铜绿的主要成分是氢氧化铜 D、“笔、墨、纸、砚”在中国传统文化中被称为“文房四宝”,用石材制作砚台的过程是化学变化2. 设NA为阿伏加德罗常数的值,下列说法正确的是( )A、常温常压下,36 g18O2中所含的中子数为16NA B、4.6 g NO2与N2O4的混合气体中所含氮原子数为0.1NA C、100 mL pH=2的CH3COOH溶液中所含氢离子数小于1.0×10-3NA D、标准状况下,2.24 L Cl2与足量的NaOH稀溶液反应,转移电子数为0.2NA3. 从某含有FeCl2、FeCl3、CuCl2的工业废液中回收铜并制备氯化铁晶体的流程如下:
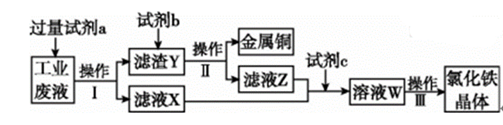
则下列说法正确的是( )
A、试剂a是铁、试剂b是稀硫酸 B、操作Ⅰ、操作Ⅱ、操作Ⅲ所用仪器相同 C、试剂c是氯气,相应的反应为2Fe2++Cl2=2Fe3++2Cl- D、用酸性KMnO4溶液可检验溶液W中是否含有Fe2+4. 下列有关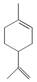 (a)、
(a)、 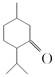 (b)、
(b)、 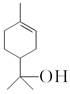 (c)的说法正确的是( ) A、a、b、c都属于芳香族化合物 B、a、b、c都能使溴水因化学反应褪色 C、由a生成c的反应是氧化反应 D、b、c互为同分异构体5. 短周期主族元素X、Y、Z、W原子序数依次增大,X原子的原子核内只有1个质子,Y原子最外层比W原子最外层多1个电子,Z的单质是空气中含量最高的气体,W的单质在常温下接触浓硫酸会钝化。下列说法正确的是( )A、原子半径:Y<Z<W B、简单离子半径:Z>W C、X、Y形成的化合物只含有极性键 D、Y的最高价氧化物对应水化物的酸性比Z的强6. 氢氧熔融碳酸盐燃料电池是一种高温电池(600~700 ℃),具有效率高、噪声低、无污染等优点。熔融碳酸盐燃料电池的工作原理如图所示。下列说法正确的是( )
(c)的说法正确的是( ) A、a、b、c都属于芳香族化合物 B、a、b、c都能使溴水因化学反应褪色 C、由a生成c的反应是氧化反应 D、b、c互为同分异构体5. 短周期主族元素X、Y、Z、W原子序数依次增大,X原子的原子核内只有1个质子,Y原子最外层比W原子最外层多1个电子,Z的单质是空气中含量最高的气体,W的单质在常温下接触浓硫酸会钝化。下列说法正确的是( )A、原子半径:Y<Z<W B、简单离子半径:Z>W C、X、Y形成的化合物只含有极性键 D、Y的最高价氧化物对应水化物的酸性比Z的强6. 氢氧熔融碳酸盐燃料电池是一种高温电池(600~700 ℃),具有效率高、噪声低、无污染等优点。熔融碳酸盐燃料电池的工作原理如图所示。下列说法正确的是( )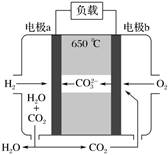 A、电池工作时,熔融碳酸盐只起到导电的作用 B、负极反应式为H2-2e-+CO =CO2+H2O C、电子流向:电极a→负载→电极b→熔融碳酸盐→电极a D、电池工作时,外电路中通过0.2 mol电子,消耗3.2 g O27. 已知 pOH=-lgc(OH-)。向20 mL 0.1 mol·L-1 的氨水中滴加未知浓度的稀 H2SO4 , 测得混合溶液的温度、pOH随加入稀硫酸体积的变化如下图所示,下列说法不正确的是( )
A、电池工作时,熔融碳酸盐只起到导电的作用 B、负极反应式为H2-2e-+CO =CO2+H2O C、电子流向:电极a→负载→电极b→熔融碳酸盐→电极a D、电池工作时,外电路中通过0.2 mol电子,消耗3.2 g O27. 已知 pOH=-lgc(OH-)。向20 mL 0.1 mol·L-1 的氨水中滴加未知浓度的稀 H2SO4 , 测得混合溶液的温度、pOH随加入稀硫酸体积的变化如下图所示,下列说法不正确的是( )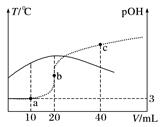 A、稀H2SO4 的物质的量浓度为0.05 mol·L-1 B、当溶液中pH=pOH时,水的电离程度最大 C、a点时溶液中存在c(NH3·H2O)+2c(OH-)=c(NH )+2c(H+) D、a、b、c 三点对应 NH 的水解平衡常数:Kh(b)>Kh(a)>Kh(c)
A、稀H2SO4 的物质的量浓度为0.05 mol·L-1 B、当溶液中pH=pOH时,水的电离程度最大 C、a点时溶液中存在c(NH3·H2O)+2c(OH-)=c(NH )+2c(H+) D、a、b、c 三点对应 NH 的水解平衡常数:Kh(b)>Kh(a)>Kh(c)二、非选择题:
-
8. 已知草酸镍晶体(NiC2O4·2H2O)难溶于水,工业上从废镍催化剂(主要成分为Ni,含有一定量的Al2O3、FeO、SiO2、CaO等)中制备草酸镍晶体的流程如图所示:
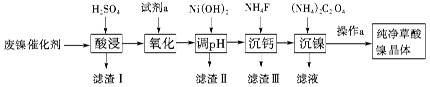
已知:①相关金属离子生成氢氧化物沉淀的pH见表中数据:
金属离子
Fe3+
Fe2+
Al3+
Ni2+
开始沉淀的pH
1.1
5.8
3.0
6.8
完全沉淀的pH
3.2
8.8
5.0
9.5
②Ksp(CaF2)=1.46×10-10;
③当某物质浓度小于1.0×10-5 mol·L-1时,视为完全沉淀。
请回答下列问题:
(1)、请写出一种能提高“酸浸”速率的措施:。(2)、试剂a是一种绿色氧化剂,写出“氧化”时反应的离子方程式:。(3)、“调pH”时pH的调控范围为 , 试用化学反应原理的相关知识解释滤渣Ⅱ的生成:。(4)、写出“沉镍”时发生反应的离子方程式: , 证明Ni2+已经沉淀完全的实验步骤及现象是 , 当Ca2+沉淀完全时,溶液中c(F-)> mol·L-1(写出计算式即可)。(5)、操作a的内容是。9. 环己烯是重要的化工原料。其实验室制备流程如下: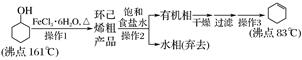
回答下列问题:
(1)、Ⅰ.环己烯的制备与提纯原料环己醇中若含苯酚杂质,检验试剂为 , 现象为。
(2)、操作1的装置如图所示(加热和夹持装置已略去)。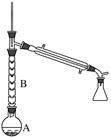
①烧瓶A中进行的可逆反应化学方程式为 ,
浓硫酸也可作该反应的催化剂,选择FeCl3·6H2O而不用浓硫酸的原因为(填序号)。
a.浓硫酸易使原料炭化并产生SO2
b.FeCl3·6H2O污染小、可循环使用,符合绿色化学理念
c.同等条件下,用FeCl3·6H2O比浓硫酸的平衡转化率高
②仪器B的作用为。
(3)、操作2用到的玻璃仪器是。(4)、将操作3(蒸馏)的步骤补齐:安装蒸馏装置,加入待蒸馏的物质和沸石, , 弃去前馏分,收集83 ℃的馏分。(5)、Ⅱ.环己烯含量的测定在一定条件下,向a g环己烯样品中加入定量制得的b mol Br2 , 与环己烯充分反应后,剩余的Br2与足量KI作用生成I2 , 用c mol·L-1的Na2S2O3标准溶液滴定,终点时消耗Na2S2O3标准溶液V mL(以上数据均已扣除干扰因素)。
测定过程中,发生的反应如下:
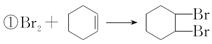
②Br2+2KI=I2+2KBr
③I2+2Na2S2O3=2NaI+Na2S4O6
滴定所用指示剂为。样品中环己烯的质量分数为(用字母表示)。
(6)、下列情况会导致测定结果偏低的是(填序号)。a.样品中含有苯酚杂质
b.在测定过程中部分环己烯挥发
c.Na2S2O3标准溶液部分被氧化
10. “绿水青山就是金山银山”,近年来,绿色发展、生态保护成为中国展示给世界的一张新“名片”。汽车尾气是造成大气污染的重要原因之一,减少氮的氧化物在大气中的排放是环境保护的重要内容之一。请回答下列问题:(1)、已知:N2(g)+O2(g)=2NO(g)ΔH1=+180.5 kJ·mol-1C(s)+O2(g)=CO2(g)ΔH2=-393.5 kJ·mol-1
2C(s)+O2(g)=2CO(g)ΔH3=-221 kJ·mol-1
若某反应的平衡常数表达式为K= ,则此反应的热化学方程式为。
(2)、N2O5在一定条件下可发生分解反应:2N2O5(g) 4NO2(g)+O2(g),某温度下向恒容密闭容器中加入一定量N2O5 , 测得N2O5浓度随时间的变化如下表:t/min
0
1
2
3
4
5
c(N2O5)/(mol·L-1)
1.00
0.71
0.50
0.35
0.25
0.17
①反应开始时体系压强为p0 , 第2 min时体系压强为p1 , 则p1∶p0=。2~5 min内用NO2表示的该反应的平均反应速率为。
②一定温度下,在恒容密闭容器中充入一定量N2O5进行该反应,能判断反应已达到化学平衡状态的是。(填字母)
a.NO2和O2的浓度比保持不变
b.容器中压强不再变化
c.2v正(NO2)=v逆(N2O5)
d.气体的密度保持不变
(3)、Kp是用反应体系中气体物质的分压来表示的平衡常数,即将K表达式中平衡浓度用平衡分压代替。已知反应:NO2(g)+CO(g)NO(g)+CO2(g),该反应中正反应速率v正=k正·p(NO2)·p(CO),逆反应速率v逆=k逆·p(NO)·p(CO2),其中k正、k逆为速率常数,则Kp为(用k正、k逆表示)。(4)、如图是密闭反应器中按n(N2)∶n(H2)=1∶3投料后,在200 ℃、400 ℃、600 ℃下,合成NH3反应达到平衡时,混合物中NH3的物质的量分数随压强的变化曲线,已知该反应为放热反应。
①曲线a对应的温度是。
②M点对应的H2的转化率是。
(5)、工业生产中产生的SO2废气可用如图方法获得H2SO4。写出电解的阳极反应式。 11. 铜元素可形成多种重要化合物。回答下列问题:(1)、铜元素位于元素周期表中的区,其基态原子的价电子排布图为。(2)、往硫酸铜溶液中加入过量氨水,可形成[Cu(NH3)4]SO4溶液,该溶液可用于溶解纤维素。
11. 铜元素可形成多种重要化合物。回答下列问题:(1)、铜元素位于元素周期表中的区,其基态原子的价电子排布图为。(2)、往硫酸铜溶液中加入过量氨水,可形成[Cu(NH3)4]SO4溶液,该溶液可用于溶解纤维素。①[Cu(NH3)4]SO4中阴离子的立体构型是。
②在[Cu(NH3)4]SO4中,Cu2+与NH3 之间形成的化学键称为 , 提供孤电子对的成键原子是。
③除硫元素外,[Cu(NH3)4]SO4中所含元素的电负性由小到大的顺序为。
④NF3与NH3 的立体构型相同,中心原子的轨道杂化类型均为。但NF3不易与Cu2+形成化学键,其原因是。
(3)、一种Hg—Ba—Cu—O高温超导材料的晶胞(长方体)如图所示。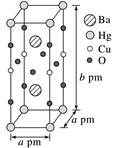
①该物质的化学式为。
②已知该晶胞中两个Ba2+的间距为c pm,则距离Ba2+最近的Hg+数目为个,二者的最短距离为pm。(列出计算式即可,下同)
③设该物质的摩尔质量为M , 阿伏加德罗常数的值为NA , 则该晶体的密度为g·cm-3。
12. 以香兰醛( )为主要原料合成药物利喘贝(V)的流程如下:
)为主要原料合成药物利喘贝(V)的流程如下: 
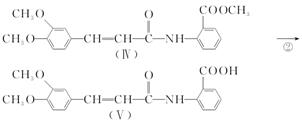
已知:
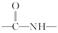 (酰胺键)在无肽键酶作用下的水解可忽略。(1)、H2C(COOH)2的化学名称为。(2)、①的反应类型是。(3)、反应②所需试剂条件分别为、。(4)、利喘贝(V)的分子式为。(5)、Ⅲ中官能团的名称是。(6)、写出与香兰醛互为同分异构体的酯类化合物的结构简式(且核磁共振氢谱为四组峰,峰面积之比为1∶2∶2∶3):(写出3种)。(7)、已知:
(酰胺键)在无肽键酶作用下的水解可忽略。(1)、H2C(COOH)2的化学名称为。(2)、①的反应类型是。(3)、反应②所需试剂条件分别为、。(4)、利喘贝(V)的分子式为。(5)、Ⅲ中官能团的名称是。(6)、写出与香兰醛互为同分异构体的酯类化合物的结构简式(且核磁共振氢谱为四组峰,峰面积之比为1∶2∶2∶3):(写出3种)。(7)、已知: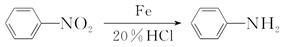 ,结合上述流程中的信息,设计以甲苯和甲醇为起始原料制备邻氨基苯甲酸甲酯(
,结合上述流程中的信息,设计以甲苯和甲醇为起始原料制备邻氨基苯甲酸甲酯(  )的合成路线(其他无机试剂任选)。
)的合成路线(其他无机试剂任选)。