山东省德州市2020年高考化学一模试卷
试卷更新日期:2020-05-06 类型:高考模拟
一、选择题
-
1. 新型冠状病毒正威胁着全世界人们的身体健康。以下是新型冠状病毒相关的一些知识,其中正确的是( )A、新型冠状病毒由C,H,O三种元素组成 B、生产医用防护服、口罩均要用到有机高分子材料 C、过氧化氢、乙醇、过氧乙酸等均可将病毒氧化而达到消毒目的 D、84消毒液是以NaClO为有效成分的消毒剂,与医用酒精混合可提升消毒效果2. 据《Green Chemistry》报道:我国学者发明了低压高效电催化还原CO2的新方法,其总反应为:NaCl+CO2 CO+NaClO。下列说法正确的是( )A、CO2的电子式:
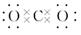 B、NaCl属于离子晶体, 其配位数为8
C、NaClO中既有离子键又有共价键
D、还原22.4LCO2转移的电子数2NA
3. 下列说法正确的是( )A、CH2=CH2和CH2=CHCH=CH2互为同系物 B、
B、NaCl属于离子晶体, 其配位数为8
C、NaClO中既有离子键又有共价键
D、还原22.4LCO2转移的电子数2NA
3. 下列说法正确的是( )A、CH2=CH2和CH2=CHCH=CH2互为同系物 B、 互为同分异构体
C、有机物
互为同分异构体
C、有机物  的二氯代物有5种
D、(CH3)3C-CH=CH2与氢气加成后,生成2,2,3一三甲基戊烷
4. 下列对实验事实的理论解释正确的是( )
的二氯代物有5种
D、(CH3)3C-CH=CH2与氢气加成后,生成2,2,3一三甲基戊烷
4. 下列对实验事实的理论解释正确的是( )选项
实验事实
理论解释
A
酸性:HClO<H2CO3
非金属:C>Cl
B
NH3溶于水形成的溶液能导电
NH3是电解质
C
氮原子的第一电离能大于氧原子
氮原子2p能级半充满
D
H2O的沸点高于H2S
H-O的键能大于H-S的键能
A、A B、B C、C D、D5. 通常监测SO2含量是否达到排放标准的反应原理是SO2+H2O2+BaCl2=BaSO4↓++2HCl。设NA表示阿伏加德罗常数的值,下列说法正确的是( )A、0.1molBaCl2晶体中所含离子总数为0.2NA B、25℃时,pH=1的HCl溶液中含有H+的数目为0.1NA C、17gH2O2中含有非极性键数目为0.5NA D、生成2.33gBaSO4沉淀时, 转移电子数目为0.01NA6. 下列实验设计能达到实验目的的是( )选项
实验目的
实验设计
A
检验溶液中是否含有Fe2+
取少量溶液,滴加几滴新制氯水,振荡,再加入少量KSCN溶液,溶液变为红色
B
检验丙烯醛中是否含碳碳双键
向丙烯醛溶液中滴加KMnO4(H+)
C
比较AgBr和AgCl的Ksp大小
向AgCl的饱和溶液的滴加NaBr
D
比较水与乙醇中羟基氢的活泼性
分别将少量钠投入盛有水和乙醇的烧杯中
A、A B、B C、C D、D7. 我国中草药文化源远流长,通过临床试验,从某中草药中提取的有机物具有较好的治疗癌症的作用,该有机物的结构如下图所示。下列说法中错误的是( ) A、分子式为C13H12O6 B、该有机物能发生取代反应、加成反应、氧化反应 C、1mol该有机物与NaOH反应最多消耗2molNaOH D、1mol该有机物与溴水反应最多消耗3molBr28. X、Y、Z、Q、R为原子序数依次增大的短周期元素。25℃时,其最高价氧化物的水化物溶液(浓度均为0.001mol·L-1) 的pH和原子半径的关系如图所示。下列说法中正确的是( )
A、分子式为C13H12O6 B、该有机物能发生取代反应、加成反应、氧化反应 C、1mol该有机物与NaOH反应最多消耗2molNaOH D、1mol该有机物与溴水反应最多消耗3molBr28. X、Y、Z、Q、R为原子序数依次增大的短周期元素。25℃时,其最高价氧化物的水化物溶液(浓度均为0.001mol·L-1) 的pH和原子半径的关系如图所示。下列说法中正确的是( ) A、Y和Z的简单离子半径:Y<Z B、R,Q的气态氢化物的稳定性:R>Q C、R的最高价氧化物对应水化物的化学式为HRO3 D、上述五种元素中有两种元素是金属元素9. 乙酸丁酯是重要的化工原料。实验室用乙酸、丁醇在浓硫酸作催化剂、加热条件下制备乙酸丁酯的装置示意图(加热和夹持置已省略)和有关信息如下:
A、Y和Z的简单离子半径:Y<Z B、R,Q的气态氢化物的稳定性:R>Q C、R的最高价氧化物对应水化物的化学式为HRO3 D、上述五种元素中有两种元素是金属元素9. 乙酸丁酯是重要的化工原料。实验室用乙酸、丁醇在浓硫酸作催化剂、加热条件下制备乙酸丁酯的装置示意图(加热和夹持置已省略)和有关信息如下:
乙酸
正丁醇
乙酸丁酯
熔点/℃
16.6
-89.5
-73.5
沸点/℃
117.9
117
126.0
密度/g·cm-3
1.1
0.80
0.88
下列说法正确的是( )
A、加热一段时间后,发现烧瓶C中忘记加沸石,可打开瓶塞直接加人即可 B、装置B的作用是不断分离出乙酸丁酯.提高产率 C、装置A可以装配蒸馏装置的冷凝器,且冷凝水由a口进,b口出 D、乙酸丁酯中残留的乙酸和正丁醇可用饱和碳酸钠溶液除去10. 还原沉淀法是处理含铬(含Cr2O 和CrO )工业废水的常用方法,过程如下:
已知:转化过程中的反应为2CrO (aq) +2H+(aq) Cr2O (aq)+H2O(I)。常温下Ksp[Cr(OH)3]=1×10-32。下列说法错误的是( )
A、反应①v正(CrO ) =2v逆(Cr2O ) 时,反应处于平衡状态 B、反应②转移0.6mole- , 则有0.2molCr2O 被还原 C、除去废水中含铬离子的过程包括氧化还原反应和复分解反应 D、常温下, 要使处理后废水中的c(Cr3+) 降至1×10-5mol·L-1 , 反应③应调溶液pH=5二、选择题
-
11. 为防止废弃的硒单质(Se)造成环境污染,通常用浓硫酸将其转化成二氧化硒(SeO2),再用KI溶液处理后回收Se。发生的反应为:①Se+2H2SO4(浓)=2SO2+SeO2+2H2O、②SeO2+4KI+4HNO3=4KNO3+Se+2I2+2H2O,下列说法错误的是( )A、①中SO2是还原产物,SeO2是氧化产物 B、②中KI是还原剂,HNO3是氧化剂 C、每生成0.4molI2共转移1.2mol电子 D、氧化性由强到弱的顺序是:H2SO4(浓)>SeO2>HNO312. 已知反应:CH2=CHCH3(g)+Cl2(g) CH2=CHCH2Cl(g)+HCl(g) 。在一定压强下,按ω= 向密闭容器中充入氯气与丙烯。图甲表示平衡时,丙烯的体积分数(
 )与温度(T)、ω的关系,图乙表示反应的平衡常数K与温度T的关系。则下列说法正确的是( )
)与温度(T)、ω的关系,图乙表示反应的平衡常数K与温度T的关系。则下列说法正确的是( )  A、图甲中ω1≥1 B、图乙中,线A表示正反应的平衡常数 C、在恒容容器中进行,压强不变时反应达到平衡状态 D、当温度为T1、ω=2时,Cl2的转化率约为33.3%13. 2022年前后我国将建成首座载人空间站。为实现空间站的零排放,循环利用人体呼出的CO2并提供O2 , 我国科学家研发了一种能量转化装置,总反应方程式为2CO2=2CO+O2。下列说法正确的是( )
A、图甲中ω1≥1 B、图乙中,线A表示正反应的平衡常数 C、在恒容容器中进行,压强不变时反应达到平衡状态 D、当温度为T1、ω=2时,Cl2的转化率约为33.3%13. 2022年前后我国将建成首座载人空间站。为实现空间站的零排放,循环利用人体呼出的CO2并提供O2 , 我国科学家研发了一种能量转化装置,总反应方程式为2CO2=2CO+O2。下列说法正确的是( ) A、该装置将太阳能直接转化为化学能 B、离子交换膜为阳离子交换膜 C、反应完毕,该装置中电解质溶液的pH不变 D、Y电极的反应:CO+2e-+H2O=CO+2OH-14. 常温下,向VmL 0.1mol·L-1HA溶液中滴入0.1mol·L-1NaOH溶液,溶液中由水电离出的氢离子浓度的负对数[-lgc水(H+)]与所加NaOH溶液体积的关系如图所示。下列说法不正确的是( )
A、该装置将太阳能直接转化为化学能 B、离子交换膜为阳离子交换膜 C、反应完毕,该装置中电解质溶液的pH不变 D、Y电极的反应:CO+2e-+H2O=CO+2OH-14. 常温下,向VmL 0.1mol·L-1HA溶液中滴入0.1mol·L-1NaOH溶液,溶液中由水电离出的氢离子浓度的负对数[-lgc水(H+)]与所加NaOH溶液体积的关系如图所示。下列说法不正确的是( ) A、常温下,Ka(HA)约为10-5 B、P点溶液对应的pH=7 C、M点溶液中存在:c(Na+)=c(A-)+c(HA) D、N点溶液中存在:c(Na+)≥c(A-)≥c(OH-)>c(H+)15. 水煤气变换反应为:CO(g)+H2O(g)=CO2(g)+H2(g)。我国学者结合实验与计算机模拟结果,研究了在金催化剂表面上水煤气变换的反应历程,如图所示,其中吸附在金催化剂表面上的物种用·标注。下列说法正确的是( )
A、常温下,Ka(HA)约为10-5 B、P点溶液对应的pH=7 C、M点溶液中存在:c(Na+)=c(A-)+c(HA) D、N点溶液中存在:c(Na+)≥c(A-)≥c(OH-)>c(H+)15. 水煤气变换反应为:CO(g)+H2O(g)=CO2(g)+H2(g)。我国学者结合实验与计算机模拟结果,研究了在金催化剂表面上水煤气变换的反应历程,如图所示,其中吸附在金催化剂表面上的物种用·标注。下列说法正确的是( ) A、水煤气变换反应的△H>0 B、步骤③的化学方程式为:CO·+OH·+H2O(g)=COOH·+H2O· C、步骤⑤只有非极性键H-H键形成 D、该历程中最大能垒(活化能)E正=2.02eV
A、水煤气变换反应的△H>0 B、步骤③的化学方程式为:CO·+OH·+H2O(g)=COOH·+H2O· C、步骤⑤只有非极性键H-H键形成 D、该历程中最大能垒(活化能)E正=2.02eV三、非选择题
-
16. 亚硝酰氯(NOCl)是一种黄色气体,沸点为-5.5℃。其液体呈红褐色。遇水发生反应:2NOCl+H2O=2HCl+NO↑+NO2↑。某化学兴趣小组设计下图装置用Cl2和NO制备NOCl。回答下列相关问题:
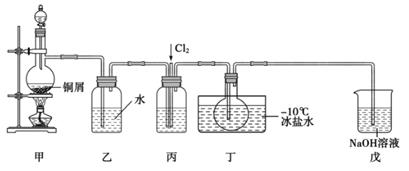 (1)、甲装置发生的离子反应方程式为 , 装置丙中的液体为。(2)、实验时,先通入Cl2 , 待丁中烧瓶内充满黄绿色气体时,再通入NO.这样做的目的是 。(3)、装置丁中冰盐水的作用是 。(4)、经分析该套装置设计上有一处明显缺陷.改进方法是 (用文字描述)。(5)、吸收尾气时,NOCl发生反应的化学方程式为。
(1)、甲装置发生的离子反应方程式为 , 装置丙中的液体为。(2)、实验时,先通入Cl2 , 待丁中烧瓶内充满黄绿色气体时,再通入NO.这样做的目的是 。(3)、装置丁中冰盐水的作用是 。(4)、经分析该套装置设计上有一处明显缺陷.改进方法是 (用文字描述)。(5)、吸收尾气时,NOCl发生反应的化学方程式为。(已知:NO+NO2+2NaOH=2NaNO2+H2O)
(6)、反应完成后,取烧瓶中所得产物mg溶于水,配制成250mL溶液,取出25.00mL,以K2CrO4溶液为指示剂,用c mol·L-1AgNO3标准溶液滴定至终点,消耗标准溶液的体积为VmL。则产物中NOCl纯度的计算式为。17. Fe、Co、Ni均为第Ⅷ族元素,它们的化合物在生产、生活中有着广泛的应用。(1)、基态Fe原子中,电子填充的能量最高的能级符号为。(2)、在空气中FeO稳定性小于Fe2O3 , 从电子排布的角度分析,其主要原因是。(3)、铁氰化钾(K3[Fe(CN)6])溶液是检验Fe2+常用的试剂。1mol[Fe(CN)6]3-含σ键的数目为。(4)、Co3+的一种配离子[Co(N3)(NH3)5]2+中,Co3+的配位数是。配体N 中心原子的杂化类型为。CoO的熔点是1935℃,CoS的熔点是1135℃,试分析CoO的熔点较高的原因 。(5)、NiO的晶胞结构如图所示,其中原子坐标参数A为(0,0,0) ,B为(1,1,0),则C原子坐标参数为。 18. 二氧化碳的利用是我国能源领域的一个重要战略方向,目前我国科学家在以下方面已经取得重大成果。(1)、图1是由CO2制取C的太阳能工艺,已知过程1发生的反应中 =6,则FexOy的化学式为。过程1生成1molC的反应热为△H1;过程2产生1molO2(g)的反应热为△H2。则由CO2制取C的热化学方程式为。
18. 二氧化碳的利用是我国能源领域的一个重要战略方向,目前我国科学家在以下方面已经取得重大成果。(1)、图1是由CO2制取C的太阳能工艺,已知过程1发生的反应中 =6,则FexOy的化学式为。过程1生成1molC的反应热为△H1;过程2产生1molO2(g)的反应热为△H2。则由CO2制取C的热化学方程式为。 (2)、利用CO2合成甲醇的反应为:CO2(g)+3H2(g) H2O(g)+CH3OH(g)△H=-53.7kJ·mol-1 , 一定条件下,将1mol CO2和2.8mol H2充入容积为2L的绝热密闭容器中,发生上述反应。CO2的转化率[a(CO2)]在不同催化剂作用下随时间的变化曲线如图2所示。过程Ⅰ的活化能(填“>”“<”或“=”)过程Ⅱ的活化能,n点的平衡常数K=。(3)、用二氧化碳合成低密度聚乙烯(LDPE),以纳米二氧化钛膜为工作电极,常温常压电解CO2 , 可制得LDPE,该电极反应可能的机理如图3所示。
(2)、利用CO2合成甲醇的反应为:CO2(g)+3H2(g) H2O(g)+CH3OH(g)△H=-53.7kJ·mol-1 , 一定条件下,将1mol CO2和2.8mol H2充入容积为2L的绝热密闭容器中,发生上述反应。CO2的转化率[a(CO2)]在不同催化剂作用下随时间的变化曲线如图2所示。过程Ⅰ的活化能(填“>”“<”或“=”)过程Ⅱ的活化能,n点的平衡常数K=。(3)、用二氧化碳合成低密度聚乙烯(LDPE),以纳米二氧化钛膜为工作电极,常温常压电解CO2 , 可制得LDPE,该电极反应可能的机理如图3所示。
①过程Ⅰ~Ⅲ中碳元素发生反应(填“氧化”或“还原”)。
②请补充完整并配平CO2转化为LDPE的电极反应:2nCO2+ + =
[H2C-CH2]n+ 。③工业上生产1.4×104g的LDPE,理论上需要标准状况下CO2的体积是L。
19. 随着钴酸锂电池的普及使用,从废旧的钴酸锂电池中提取锂、钴等金属材料意义重大。下图是废旧钴酸锂(LiCoO2)(含少量铁、铝、铜等元素的化合物)回收工艺流程: (1)、“拆解”前需进入“放电”处理的目的是;用食盐水浸泡是放电的常用方法,浸泡放电过程中产生的气体主要有。(2)、上述流程中将CoO 转化为Co3+的离子方程式为 。(3)、滤液1中加入Na2SO3的主要目的是;加入NaClO3的主要目的是 。(4)、“沉钴”过程中,(NH4)2C2O4的加入量(图a)、沉淀反应的温度(图b)与钴的沉淀率关系如图所示:
(1)、“拆解”前需进入“放电”处理的目的是;用食盐水浸泡是放电的常用方法,浸泡放电过程中产生的气体主要有。(2)、上述流程中将CoO 转化为Co3+的离子方程式为 。(3)、滤液1中加入Na2SO3的主要目的是;加入NaClO3的主要目的是 。(4)、“沉钴”过程中,(NH4)2C2O4的加入量(图a)、沉淀反应的温度(图b)与钴的沉淀率关系如图所示:
根据上图分析:沉钴时应控制n(C2O ):n(Co2+)比为 , 温度控制在℃左右。
20. 甲基丙烯酸甘油酯GMA( ),由于本身带有丙烯酸酯双键和环氧基团,使得其应用十分广泛。工业合成GMA的一种方法如下(部分反应所需试剂和条件已略去)
),由于本身带有丙烯酸酯双键和环氧基团,使得其应用十分广泛。工业合成GMA的一种方法如下(部分反应所需试剂和条件已略去) 
已知:

请按要求回答下列问题
(1)、B中的官能团名称:;(2)、C的结构简式 ;(3)、请写出E→F的反应方程式和反应类型:E→F: , 反应(4)、H的核磁共振氢谱峰面积之比由大到小为 , H的同分异构体中能发生水解反应的链状化合物有种。(5)、已知:CH2=CH2 。参照上述合成路线并结合此信息,以丙烯为原料,完善下列合成有机物C的路线流程图:丙烯 Br
。参照上述合成路线并结合此信息,以丙烯为原料,完善下列合成有机物C的路线流程图:丙烯 Br  = 。
= 。