2020年中考化学重点知识点专练 03 离子共存
试卷更新日期:2020-04-30 类型:二轮复习
一、单选题
-
1. 能大量共存且形成无色溶液的一组离子是( )A、Cu2+、SO42﹣、H+ B、Cl﹣、NH4+、OH﹣ C、Ba2+、SO42﹣、NO3﹣ D、Na+、K+、NO3﹣2. 下列离子组合能在pH=12的溶液中大量共存的是( )A、K+、Mg2+、SO42﹣、Cl﹣ B、HCO3﹣、H+、Na+、Cl﹣ C、K+、Na+、NO3﹣、Cl﹣ D、Ba2+、Cl﹣、Na+、SO42﹣3. 下列各组物质的溶液,不用其他试剂,只用观察和组内物质的溶液相互混合的方法,能将它们一一鉴别的是()
A、Na2CO3、HCl、BaCl2、NaCl B、Na2CO3、NaCl、Na2SO4、Ba(OH)2 C、H2SO4、NaOH、BaCl2、CuCl2 D、NaOH、Ba(NO3)2、NaCl、MgSO44. 某化学兴趣小组对A、B、C、D四种未知溶液的成分进行了检验,检验结果见下表。其中检验结果错误的是( )组别
溶液中检验出的离子
A
K+、Na+、OH-、SO42-
B
Ba2+、Na+、Cl-、OH-
C
Cu2+、Mg2+、NO3-、Cl-
D
H+、NH4+、CO32-、SO42-
A、A B、B C、C D、D5. 甲乙两工厂的生产污水中各含有下列五种离子中的三种(两厂含有一种相同的离子):H+、Cu2+、K+、NO3-、OH-。若两厂单独排放都会造成严重的污染;若将两厂的污水按一定比例混合,沉淀后污水会变成只含有一种溶质的无色澄清溶液,此溶液可做化肥。下列关于污水的分析,正确的是 ( )A、OH–和Cu2+来自同一工厂 B、Cu2+和K+来自同一工厂 C、K+和OH–来自同一工厂 D、H+和K+来自同一工厂6. 下列各组离子能在氯化钠溶液中大量共存的是( )A、Ag+、Cu2+、SO42- B、K+、Ba2+、NO3 - C、Ca2+、Na+、CO32- D、Ba2+、NH4+、OH-7. 有一包固体可能含有Ca(NO3) 2 、Na2SO4 、Na2 CO2、FeCl3 、KCl中的一种或几种,现对其进行如下实验:①取少量固体于试管中,加适量蒸馏水,固体完全溶解成无色透明溶液②取少量上述溶液,加过量稀硫酸,有气泡产生 ③取②所得溶液少量,滴加BaCl2溶液,产生白色沉淀。分析以上实验现象,对原固体组成的推断正确的是( )
A、肯定有Na2CO3 、Na2SO4 , 无FeCl3 、Ca(NO3)2 B、肯定有Na2CO3 ,无FeCl3 、Ca(NO3 )2 C、肯定有Na2 CO3 、Na2SO4 ,无FeCl3 D、肯定有Na2 CO3 , 无FeCl3、KCl8. 甲、乙两化工厂分布如图所示。箭头代表水流方向。如果在a处取得水样经检测只有少量OH-、SO42-。在c处取得水样经检测pH=7、且只含有少量NaCl。则b处水中含有的物质应是下列那一组?( ) A、MgSO4、 NaCl B、H2SO4、 Ba(NO3)2 C、BaCl2、 HCl D、H2SO4、 MgCl2
A、MgSO4、 NaCl B、H2SO4、 Ba(NO3)2 C、BaCl2、 HCl D、H2SO4、 MgCl2二、实验探究题
-
9. 某化学兴趣小组在课外活动中对某溶液进行了多次检测,其中三次检测结果如下表所示,请回答:
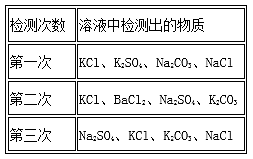 (1)、三次检测结果中第次检测结果错误.(2)、在检测时,为了确定溶液中是否存在硫酸根离子、碳酸根离子和氯离子,先向溶液中加入过量的稀硝酸溶液,检验的离子是;然后继续加入过量的溶液(填化学式),其目的是 ;过滤后,再向滤液中加入溶液(填化学式).10. 课本中”复分解反应发生条件'的活动与探究”用到H2SO4 、Ba(NO3)2、NaOH、K2CO3四种溶液。某校化学兴趣小组的同学在探究实验结束后,将所有废液倒入一个洁净的废液缸中,然后对废液缸中的废液进行了探究。取废液少许。测得其pH为12。(1)、【提出问题】:废液中除含OH―外,还含有哪些离子呢?
(1)、三次检测结果中第次检测结果错误.(2)、在检测时,为了确定溶液中是否存在硫酸根离子、碳酸根离子和氯离子,先向溶液中加入过量的稀硝酸溶液,检验的离子是;然后继续加入过量的溶液(填化学式),其目的是 ;过滤后,再向滤液中加入溶液(填化学式).10. 课本中”复分解反应发生条件'的活动与探究”用到H2SO4 、Ba(NO3)2、NaOH、K2CO3四种溶液。某校化学兴趣小组的同学在探究实验结束后,将所有废液倒入一个洁净的废液缸中,然后对废液缸中的废液进行了探究。取废液少许。测得其pH为12。(1)、【提出问题】:废液中除含OH―外,还含有哪些离子呢?【讨论分析】:一定不存在的离子是;
(2)、有三种离子一定存在,它们是。(3)、另外,废液中还可能存在什么离子呢?同学们纷纷作出猜想【猜想与假设】:甲同学:可能还含有SO42-、CO32-
乙同学:可能还含有Ba2+
丙同学:可能还含有Ba2+、SO42-、CO32-
以上甲、乙、丙三位同学的假设中,同学的假设一定不成立,原因是;
为进一步确定离子成分,丁同学取少量废液于试管中,先向其中滴加过量的稀硝酸,看到溶液中有气泡产生,然后再向试管中加入硝酸钡溶液,观察到溶液中产生白色沉淀,得出溶液中还含有的离子是。
如图为滴加稀硝酸过程中废液中某离子的个数变化情况,则①代表的离子是;②代表的离子是 。
 11. 某化学兴趣小组在一次实验中进行如图所示的实验:
11. 某化学兴趣小组在一次实验中进行如图所示的实验:此时观察到U形管左右两侧产生的现象是不同的;实验后,小组同学充分振荡U形管。发现管内仍有白色固体残留。将固体分离后,同学们对滤液成分产生浓厚的兴趣,于是进行了进一步的探究活动
 (1)、【提出问题】滤液中可能含有哪些溶质?
(1)、【提出问题】滤液中可能含有哪些溶质?【猜想与假设】猜想一:溶质为NaCl
猜想二:溶质为NaCl和BaCl2
猜想三:溶质为NaCl、BaCl2和HCl
你认为以上猜想不合理;理由是(请用化学方程式表示);请写出你的猜想
(2)、【实验探究】小红为了验证滤液成分,取滤液于试管中,向其中滴加少量的硫酸钠溶液,观察到无明显现象。由此得出结论:猜想一成立。小刚认为小红的结论是否严密(填“严密”或“不严”)。为了验证你的猜想,请填写下表:
实验操作
实验现象
实验结论
取滤液适量于试管中,向其中滴加适量溶液
溶液由无色变为红色
你的猜想成立
(3)、【归纳与总结】通过上述实验,我们能够总结出:在确定化学反应后所得溶液溶质成分时,除了考虑生成物外,还需要考虑。三、综合题
-
12. 氢氧化镁是一种重要的化工原料,某矿石由MgO、Fe2O3、CuO和SiO2组成。用它制备氢氧化镁的流程示意图如下:

部分金属阳离子以氢氧化物形成沉淀时溶液的pH见下表:
沉淀物
Fe(OH)3
Cu(OH)2
Mg(OH)2
开始沉淀
1.9
4.2
9.1
完全沉淀
3.2
6.7
11.1
(1)、熟石灰主要成分的化学式是;(2)、溶液A中的阳离子是 (填离子符号);(3)、沉淀C的成分是;(4)、溶液B与熟石灰反应的化学方程式是 。