2020年中考化学实验专题复习 专题四 金属的腐蚀
试卷更新日期:2020-04-27 类型:二轮复习
一、单选题
-
1. 可以用来除铁锈的是( )A、硫酸铜溶液 B、水 C、盐酸 D、氢氧化钠溶液2. 铜制品在空气中会发生锈蚀[铜锈的主要成分是Cu2(OH)2CO3].若要探究“铜生锈是否需要空气中的氧气?”如图所示实验中,只需完成两个实验即可达到实验目的,此两个实验是( )
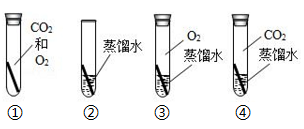 A、①③ B、②③ C、②④ D、③④3. 下图是探究铁锈蚀条件的装置。调节L端与R端的液面高度一致,塞紧木塞,一周后观察。下列推断不正确的是( )
A、①③ B、②③ C、②④ D、③④3. 下图是探究铁锈蚀条件的装置。调节L端与R端的液面高度一致,塞紧木塞,一周后观察。下列推断不正确的是( ) A、b管中铁钉不会锈蚀 B、L端与R端液面高度仍然保持一致 C、该实验说明铁锈蚀与水有关 D、若将a管中的水改为食盐水能加快铁的锈蚀
A、b管中铁钉不会锈蚀 B、L端与R端液面高度仍然保持一致 C、该实验说明铁锈蚀与水有关 D、若将a管中的水改为食盐水能加快铁的锈蚀二、填空
-
4. 碱式碳酸铜是孔雀石的主要成分,俗称铜绿,化学式为Cu2(OH)2CO3 , 受热可分解生成CuO、水和二氧化碳。(1)、碱式碳酸铜的相对分子质量是。(2)、铜绿分解生成22g的二氧化碳的同时,生成CuO的质量是。5. 人类生活离不开金属。(1)、铁是生活中常用的金属。如图是某“取暖片”外包装的图片。该“取暖片”中发热剂主要成分有铁粉、活性炭、氯化钠、水等,其发热是利用铁生锈时会放热。

①发热剂需接触到空气才会发热,原因是铁要与、等物质共同作用才会生锈。
②推测发热剂成分中氯化钠的作用是。
(2)、应用金属活动性顺序能帮助我们进一步学习金属性质。已知下列各组物质间均能发生置换反应。
A、Fe和CuSO4溶液
B、Mg和MnSO4溶液
C、Mn和FeSO4溶液
①写出Fe和CuSO4溶液反应的化学方程式。
三、实验探究题
-
6. 铜和铁是生产、生活中广泛使用的金属。(1)、工业上用一氧化碳和赤铁矿(主要成分是氧化铁)反应的化学方程式为。(2)、铁生锈的条件是;铜表面也容易生在绿色铜锈,铜锈的主要成分是碱式碳酸铜化学式为Cu2(OH)2CO3。(3)、老师用生锈的铜片、铁粉和稀硫酸进行实验,实验过程如图所示(部分生成物已略去)。

①紫红色固体C的化学式为。
②写出Ⅱ中反应的化学方程式。
7. 某化学课外小组对生活中另外一种常见金属铜在空气中能否生锈进行了以下探究:
[提出问题 铜在空气中长期放置会生锈吗?生锈的条件是什么?
查阅资料 铜在朝湿的空气中会慢慢生锈变绿,俗称铜绿,主要成分为碱式碳酸铜,化学式为Cu2(OH)2CO3
(1)、 作出猜想 小组成员一致认为,铜生锈可能是铜与空气中的氧气、共同作用的结果,他们猜想的依据是。(2)、 设计实验 同学们设计如图实验,探究铜生锈条件:将完全相同的铜片放入不同环境中,观察生锈情况。小组同学讨论认为仅完成甲、乙、丙三个实验不能得出实验结论,于是又用丁试管补充了一个实验,装置中除了铜片外,还应该加入。
[观察现象]放置两周后,发现甲中的铜片变绿了,乙丙丁中的铜片没变化。
(3)、[得出结论]甲和乙对比,得出的结论是铜生锈需要与接触。
(4)、甲和丙对比,得出的结论是铜生锈需要与接触。(5)、写出铜生锈生成碱式碳酸铜的的化学反应方程式是。(6)、[反思拓展]乙和丙中使用的是煮沸后迅速冷却的蒸馏水,目的是。
(7)、小明发现从不同地点收集到的两个铜器(一个是纯铜做的,一个是青铜做的)中,纯铜器的铜绿比青铜器的少,他据此分析认为青铜比纯铜易锈蚀。小明的分析是否全面?请你说明理由:。8. 某些铜器表面呈绿色,这是铜器长期暴露在空气中生了铜渍。为了弄清“铜绿”的组成和铜生成“铜绿”的条件,某化学实验小组进行了如下探究:(查阅资料)了解到这层锈渍的化学成分是碱式碳酸铜[Cu2(OH)2CO3],俗称“铜绿”。
(1)、(猜想与假设)据“铜绿”的组成和查阅的资料判断,铜绿可能是铜与CO2、O2和(填化学式)共同作用而生成的。(2)、(设计与实验)借鉴课本“铁制品锈蚀条件”的探究实验,小刚设计了“铜片锈蚀条件的探究”实验,实验如图所示(所用铜片洁净、光亮,试管内的为铜片)。实验较长时间后,发现试管中铜片最先生锈(填写试管字母编号)。 (3)、(解释与结论)
(3)、(解释与结论)①实验B的目的是。
②得出“铜生锈一定与CO2有关”的结论,依据的两个实验是(填编号)。
9. 在电视上的寻宝或探索节目中,常常看到一些铜制文物上有绿色的锈迹,又称铜绿。某学习小组对铜绿产生了浓厚兴趣。(提出问题)铜绿中除铜元素外还有其它什么元素?
(查阅资料)①无水硫酸铜遇水变蓝;②碳与一般的酸不反应。
(实验探究)该小组同学找到了一些铜绿并进行了如下实验:
 (1)、(记录分析)I处绿色物质变黑;
(1)、(记录分析)I处绿色物质变黑;Ⅱ处无水硫酸铜变蓝;
Ⅲ处澄清石灰水变浑浊,该处反应的化学方程式为。
(2)、(实验结论)铜绿中除铜元素外还有、和碳等元素。(3)、(交流讨论)根据铜绿的组成,小组同学对 I处产生的黑色物质的成分有如下两种不同的猜想:(1)CuO (2)CuO和C的混合物(继续探究)取 I处冷却后的少量黑色固体于试管中,滴入足量的 , 若现象为: , 则证明猜想(1)正确。
(4)、(拓展应用)根据铜绿中所含元素,可知铜生锈不仅与空气中的氧气、水有关,还可能与空气中的等有关;要保护博物馆里的青铜器,减缓生锈,我们可以减少青铜器与接触。10. 某些铜制品在空气中久置,表面生成绿色的铜锈(又称铜绿)。某化学实验小组设计并进行实验,探究铜锈的组成和铜生锈的条件。 (1)、Ⅰ.探究铜锈的组成
(1)、Ⅰ.探究铜锈的组成【查阅资料】①铜锈受热易分解②硫酸铜粉末遇水由白色变为蓝色
【进行实验】小组同学从铜器上取下适量的干燥铜锈,按如图所示装置实验(部分夹持装置已略去)。观察到B中白色粉末变为蓝色,C 中澄清石灰水变浑浊。
【解释与结论】C中反应的化学方程式是。
(2)、依据以上现象分析,铜锈中一定含有的元素:Cu和。(3)、Ⅱ.探究铜生锈的条件【提出猜想】根据铜锈的组成推测,铜生锈可能与CO2、H2O和O2有关。
【进行实验】实验小组同学取直径、长度均相同的铜丝,并打磨光亮。设计了如下图所示5个实验并持续观察。

【解释与结论】
实验中使用“经煮沸迅速冷却的蒸馏水”,其目的是。
(4)、得出“铜生锈一定与CO2有关”的结论,依据的两个实验是(填编号)。(5)、对比实验②和③,得出的结论是。(6)、为验证猜想,请在图中将实验⑤补充完整。(7)、由上述实验可推知,铜生锈的条件是。(8)、【反思与应用】结合上述实验,你对保存铜制品的建议是。
11. 兴趣小组用稀盐酸除去铁钉表面的铁锈(主要成分是Fe2O3),发现反应开始时铁锈消失,有气泡产生,溶液颜色为黄色,一段时间后变为浅绿色。
(查阅资料)FeCl3的溶液呈黄色
甲同学认为生成的FeCl3可能与试管中的物质继续反应,进行了下列实验。
实验编号
实验1-1
实验1-2
实验1-3
实验操作



实验现象
长时间放置,溶液颜色始终为黄色
长时间放置,溶液逐渐从黄色变浅绿色
长时间放置,产生红褐色沉淀
(1)、用盐酸除铁锈的化学方程式为。(2)、实验1-1的目的是。(3)、综合分析实验1,溶液从黄色变浅绿色的可能原因是。(4)、乙同学用生锈程度相同的锈铁钉、5mL盐酸探究溶液颜色变化的影响因素。实验编号
所用试剂
实验现象
反应开始时
24h后
2-1
铁锈和2%盐酸
铁锈、溶液均无明显变化
铁锈消失,溶液变黄色
2-2
生锈铁钉和2%盐酸
生锈铁钉、溶液均无明显变化
铁锈消失,溶液变浅绿色
2-3
生锈铁钉和6%盐酸
铁钉表面有少量气泡,铁锈逐渐消失,溶液逐渐由无色变浅黄色
溶液变为浅绿色
2-4
生锈铁钉和10%盐酸
铁钉表面产生大量气泡,铁锈逐渐消失,溶液很快由无色变黄色
溶液变为浅绿色
生锈铁钉与盐酸反应时,溶液的颜色变化与有关。
(5)、2-2中始终未观察到溶液变黄色,结合实验1和实验2推测可能的原因为。(6)、基于上述实验推测,下列关于工业用盐酸除铁锈的说法合理的是______(填字母 序号)。A、除铁锈时,所用盐酸的浓度越大越好 B、在除锈过程中,生成的FeCl3对铁也有腐蚀作用 C、用盐酸除锈时,应注意控制反应的时间四、综合题
-
12. 今年扬州迎来高铁交通发展的高潮。高铁给我们带来的不仅是交通方便,出行快捷,甚至是带来旅游业的繁荣。制造铁轨需要大量的合金钢,新集中学化学兴趣小组为此展开探究:
(一)工业上炼铁炼钢和轧制钢材的主要流程如下图:

已知:生铁的含碳量为2%~4.3%,钢的含碳量为0.03%~2%。
(1)、炼铁的固体原料中加入焦炭的作用是 , (用方程式表示);(2)、炼铁的固体原料需经过粉碎,其目的是;(3)、热空气和高炉气体的主要成分有一种相同,这种气体是(填化学式);(4)、炼钢炉中,通入纯氧而不用空气的目的是。将钢锭轧成钢板,体现了金属的性。(5)、(二)该兴趣小组发现未经处理的钢铁容易生锈。同学们接着探究了铁生锈的相关问题。(知识回顾)铁生锈的条件为铁与、同时接触,为了防止铁制品生锈,应采取的措施是(写出一种)。
(6)、(查阅资料)铁锈成分复杂,化学式可简单表示为Fe2O3•nH2O,在加热时会分步反应,首先失去结晶水,其反应可表示为Fe2O3•nH2O Fe2O3+nH2O。浓硫酸可以吸水,碱石灰可以吸收水和二氧化碳。(提出问题)铁锈(Fe2O3•nH2O)中n的值等于多少呢?
(问题探究)小明发现实验室中有一保管不善的铁粉,大部分已经结块成红褐色,为了探究铁锈(Fe2O3•nH2O)的组成,称取27.0g这种铁粉样品,按如图2所示装置进行实验。

实验前应先;
(7)、为了保证实验安全,实验开始时应先 , 目的是;(8)、D的作用是;(9)、请指出该装置中有一处明显不足;(10)、(数据处理)图3是加热时间和A中固体质量关系图象,下表是B、C中质量不再变化时B中浓硫酸、C中碱石灰装置质量变化情况。
反应前(g)
反应后(g)
B
100
105.4
C
150
163.2
铁锈(Fe2O3•nH2O)中n的值是;
(11)、写出T3﹣T4时间段发生反应的化学方程式;(12)、计算原样品中单质铁的质量分数是。(计算结果保留到0.1%)13. 某兴趣小组从铜器上取下绿色粉末,设计如下实验步骤进行探究铜绿的组成。 (1)、写出:B物质的化学式;铜绿的组成元素。(2)、我国古代有“曾青得铁则化为铜”的记载,这是现代湿法冶金的原理。这与上述实验方案中第步骤相似;化学方程式为。(3)、写出第③步反应的化学方程式是。(4)、在设计方案中有三种冶炼铜的方法,通过比较请从资源、能源或环境等方面,说出其中一种方案所具有的优点:。
(1)、写出:B物质的化学式;铜绿的组成元素。(2)、我国古代有“曾青得铁则化为铜”的记载,这是现代湿法冶金的原理。这与上述实验方案中第步骤相似;化学方程式为。(3)、写出第③步反应的化学方程式是。(4)、在设计方案中有三种冶炼铜的方法,通过比较请从资源、能源或环境等方面,说出其中一种方案所具有的优点:。