备考2020年高考化学二轮专题 17 无机实验综合
试卷更新日期:2020-04-25 类型:二轮复习
一、单选题
-
1. 关于下列各实验装置的叙述,不正确的是( )
 A、装置①可用于实验室制取少量NH3或O2 B、可用从a处加水的方法检验装置②的气密性 C、实验室可用装置③收集H2、NH3 D、利用装置④制硫酸和氢氧化钠,其中b为阳离子交换膜、c为阴离子交换膜2. 利用下列实验装置及药品,能实现相应实验目的的是( )
A、装置①可用于实验室制取少量NH3或O2 B、可用从a处加水的方法检验装置②的气密性 C、实验室可用装置③收集H2、NH3 D、利用装置④制硫酸和氢氧化钠,其中b为阳离子交换膜、c为阴离子交换膜2. 利用下列实验装置及药品,能实现相应实验目的的是( ) A、用图1所示装置除去HCl中含有的少量Cl2 B、用图2所示装置制备胆矾 C、用图3所示装置可以完成“喷泉”实验 D、用图4所示装置制取纯净的NH33. 下列所得溶液中,其物质的量浓度为1.0mol·L-1的是( )A、将20 g NaOH溶解在500m水中 B、将22.4LHCl气体溶于水配制成1L溶液 C、将62.5g胆矾(CuSO4·5H2O)溶解在适量水中,再加入蒸馏水至溶液的体积为250mL D、将100mL10mol·L-的硫酸加入900mL水中4. 下列图示实验合理的是( )
A、用图1所示装置除去HCl中含有的少量Cl2 B、用图2所示装置制备胆矾 C、用图3所示装置可以完成“喷泉”实验 D、用图4所示装置制取纯净的NH33. 下列所得溶液中,其物质的量浓度为1.0mol·L-1的是( )A、将20 g NaOH溶解在500m水中 B、将22.4LHCl气体溶于水配制成1L溶液 C、将62.5g胆矾(CuSO4·5H2O)溶解在适量水中,再加入蒸馏水至溶液的体积为250mL D、将100mL10mol·L-的硫酸加入900mL水中4. 下列图示实验合理的是( )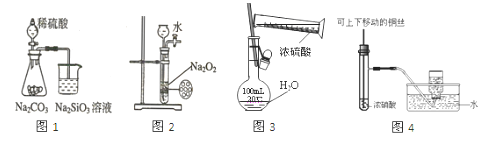 A、图1为证明非金属性强弱:Si<C<S B、图2为制备少量氧气 C、图3为配制一定浓度硫酸溶液 D、图4制备并收集少量NO2气体5. 混合物M中可能含有Al2O3、Fe2O3、Al、Cu,为确定其组成,某同学设计如图所示分析方案。下列分析正确的是( )
A、图1为证明非金属性强弱:Si<C<S B、图2为制备少量氧气 C、图3为配制一定浓度硫酸溶液 D、图4制备并收集少量NO2气体5. 混合物M中可能含有Al2O3、Fe2O3、Al、Cu,为确定其组成,某同学设计如图所示分析方案。下列分析正确的是( ) A、已知m1>m2 , 则混合物M中一定含有Al2O3 B、生成蓝绿色溶液的离子方程式为Cu+Fe3+=Cu2++Fe2+ C、固体P既可能是纯净物,又可能是混合物 D、要确定混合物M中是否含有Al,可取M加入过量NaOH溶液6. 某同学用如图所示的装置及药品进行酸性强弱比较的实验,下列说法不正确.的是( )
A、已知m1>m2 , 则混合物M中一定含有Al2O3 B、生成蓝绿色溶液的离子方程式为Cu+Fe3+=Cu2++Fe2+ C、固体P既可能是纯净物,又可能是混合物 D、要确定混合物M中是否含有Al,可取M加入过量NaOH溶液6. 某同学用如图所示的装置及药品进行酸性强弱比较的实验,下列说法不正确.的是( ) A、①和②中发生的反应均为复分解反应 B、向Na2SiO3饱和溶液中滴酚酞溶液无明显现象 C、一段时间后②中有胶冻状物质生成 D、该实验能证明酸性强弱的顺序是:硫酸>碳酸>硅酸
A、①和②中发生的反应均为复分解反应 B、向Na2SiO3饱和溶液中滴酚酞溶液无明显现象 C、一段时间后②中有胶冻状物质生成 D、该实验能证明酸性强弱的顺序是:硫酸>碳酸>硅酸二、实验探究题
-
7. 实验室需要480mL1 mol·L-1 NaOH溶液,根据溶液配制情况回答下列问题:(1)、实验中除了托盘天平(砝码)、药匙、量筒、烧杯、玻璃棒外还需要的其他仪器有。(2)、下图是某同学在实验室配制该NaOH溶液的过程示意图,其中有不正确的是(填操作序号)。
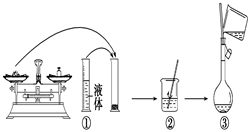
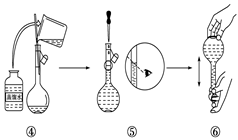 (3)、称取NaOH固体时,所需砝码的质量为____(填写字母)。A、19.2g B、20g C、19.2g ~20g D、大于20g(4)、在溶液的配制过程中,有以下基本实验步骤,其中只需进行一次的操作步骤的是(填写操作步骤的序号) 。
(3)、称取NaOH固体时,所需砝码的质量为____(填写字母)。A、19.2g B、20g C、19.2g ~20g D、大于20g(4)、在溶液的配制过程中,有以下基本实验步骤,其中只需进行一次的操作步骤的是(填写操作步骤的序号) 。①称量 ②溶解 ③转移 ④洗涤 ⑤定容 ⑥摇匀
(5)、下列操作会导致所配溶液的物质的量浓度偏高的是____。A、配制NaOH溶液时,NaOH固体中含有Na2O杂质 B、用蒸馏水溶解NaOH固体后,立即转入容量瓶中定容 C、定容后发现液面高于刻线,可用胶头滴管将多余的水吸出 D、定容时仰视刻度线 E、用托盘天平称量 NaOH 固体时,砝码生锈 F、配制前容量瓶中有少量水滴(6)、若某同学用密度为1.2g/cm3 , 质量分数为36.5%的浓盐酸配制100mL3mol/L的稀盐酸,需要用量筒量取浓盐酸的体积为mL。8. 50 mL 0.50 mol·L-1盐酸与50 mL 0.55 mol·L-1NaOH溶液在图示的装置中进行中和反应。通过测定反应过程中所放出的热量可计算中和热。回答下列问题: (1)、图中环形搅拌棒能否用铜质用品代替 , 原因是(2)、烧杯间填满碎纸条的作用是(3)、每一次平行实验至少需要观察记录几次温度数值(4)、大烧杯上如不盖硬纸板,求得的中和热数值(填“偏大”“偏小”“无影响”)。(5)、实验中改用60 mL 0.50 mol·L-1盐酸跟50 mL 0.55 mol·L-1NaOH溶液进行反应,与上述实验相比,所求中和热(填“相等”“不相等”)。9. 某校化学兴趣小组,在实验室里模拟用N2和H2合成氨,反应的化学方程式为N2+3H2 2NH3。现用未经干燥的N2和H2按体积比V(N2):V(H2)=1:3充分混合后,按如图所示的装置进行有关实验。
(1)、图中环形搅拌棒能否用铜质用品代替 , 原因是(2)、烧杯间填满碎纸条的作用是(3)、每一次平行实验至少需要观察记录几次温度数值(4)、大烧杯上如不盖硬纸板,求得的中和热数值(填“偏大”“偏小”“无影响”)。(5)、实验中改用60 mL 0.50 mol·L-1盐酸跟50 mL 0.55 mol·L-1NaOH溶液进行反应,与上述实验相比,所求中和热(填“相等”“不相等”)。9. 某校化学兴趣小组,在实验室里模拟用N2和H2合成氨,反应的化学方程式为N2+3H2 2NH3。现用未经干燥的N2和H2按体积比V(N2):V(H2)=1:3充分混合后,按如图所示的装置进行有关实验。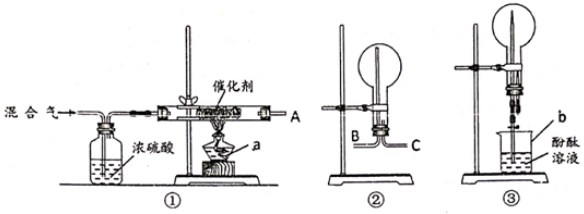
请回答下列问题:
(1)、装置①中浓硫酸的作用是 。(2)、若用装置②收集反应生成的气体,A应连接装置中的(填“B”或“C”);(3)、收集满气体后,再用装置③进行实验,当烧瓶中的液面逐渐上升,溶液呈色。(4)、实验结束时,溶液几乎充满了烧瓶,则溶液的物质的量浓度为mol/L(气体为标准状况下的体积)10. 用0.1320mol/L的HCl溶液滴定未知浓度的NaOH溶液,实验数据如下表所示,实验编号
待测NaOH溶液的体积/mL
HCl溶液的体积/mL
1
25.00
24.41
2
25.00
24.39
3
25.00
24.60

回答下列问题:
(1)、右图中甲为滴定管,乙为滴定管(填“酸式”或“碱式”)(2)、实验中,需要润洗的仪器是:。(3)、取待测液NaOH溶液25.00mL于锥形瓶中,使用酚酞做指示剂。滴定终点的判断依据是。(4)、若滴定前,滴定管尖端有气泡,滴定后气泡消失,将使所测结果 (填“偏高”“偏低”“不变”,下同);若读酸式滴定管读数时,滴定前仰视读数,滴定后正确读数,则所测结果 。(5)、未知浓度的NaOH溶液的物质的量浓度为mol/l。11. 室温下,某同学进行CO2与Na2O2反应的探究实验,回答下列问题。
(1)、用下图装置制备纯净的CO2
①丙装置的名称是 , 乙、丙装置中盛装的试剂分别是、。
②若CO2中混有HCl,则HCl与Na2O2反应的化学方程式为。
(2)、按照下面的装置图进行实验(夹持装置略)。
①先组装仪器,然后 , 再用注射器1抽取100mL纯净的CO2 , 将其连接在K1处,注射器2的活塞推到底后连接在K2处,具支U形管中装入足量的Na2O2粉末与玻璃珠。
②打开止水夹K1、K2,向右推动注射器1的活塞,可观察到的现象是。
③实验过程中,需缓慢推入CO2 , 其目的是 , 为达到相同目的,还可进行的操作是。
(3)、实验结束后,当注射器1的活塞推到底时,测得注射器2中气体体积为65mL,则CO2的转化率是。12. 硝酸银是一种无色晶体,常用于照相、制镜、印刷、医药等。其水溶液和固体常被保存在棕色试剂瓶中。硝酸银不稳定,受热分解生成固体、NO2 和 O2 。为了验证 AgNO3 受热分解的产物,某同学设计了以下实验,实验所用的装置如图(图中加热、夹持仪器等均略去):
实验步骤:
a.仪器连接后,放入AgNO3固体之前,关闭K,微热硬质玻璃管A;
b.称取 AgNO3 固体1.7g 置于A中,先通一段时间N2 , 再关闭K,用酒精灯加热硬质玻璃管A;
c.待样品完全分解,装置A冷却至室温,称量,测得剩余固体的质量为1.08 g。
请回答下列问题:
(1)、使用酒精灯对AgNO3固体加热的操作方法是。(2)、步骤a的操作目的是。(3)、步骤b中先通一段时间的N2的目的是。(4)、装置C瓶中盛装的药品名称为(合理即可),装置D中可观察到的实验现象为。(5)、根据实验现象和称量结果,请写出该装置中AgNO3固体受热分解的化学方程式。(6)、从实验安全角度考虑该装置存在缺陷,应如何改进?。三、综合题
-
13. 甲同学拟通过实验探究同主族元素性质的递变规律,以及影响化学反应速率的因素。其设计的实验方案如下,请你帮他填写完整,并做出评价。
实验室提供的试剂:锌块、锌粉、铁条、铁粉、铜条、NaBr溶液、NaI溶液、新制的氯水、1mol/ 盐酸、3mol/L的盐酸
(1)、探究同主族元素性实验步骤 实验现象 实验结论及离子方程式 
甲
乙离子方程式
甲
乙
结论:卤素单质的氧化性由强到弱的顺序为:Cl2>B2r>I2【评价】甲同学设计的实验方案的合理性是(填序号)
A. 非常合理 B. 完全不合理 C. 部分合理
【补充和完善】上一项若填A,则此项不用再作答,若填B或C,则完成实验还需要的试剂后,有关反应的离子反应方程式为:。
(2)、探究影响化学反应速率的因素实验步骤
实验现象
实验依据和结论

3mL1mol/L 3mL3mol/L
盐酸 盐酸
(金属质量相同,盐酸均过量)
均有气体生成,锌粉先消失,锌块后消失
因为乙试管中的反应更快,所以反应物浓度越大,反应速率越快。
甲同学所得实验依据和结论有明显问题,问题是。
(3)、请你利用原电池原理,设计实验,比较铜和铁的金属活动性。画出实验装置图,标出正负极、电子流动方向,写出电极反应式。装置图
电极反应式 、
14. 现甲、乙两化学小组安装两套如图所示的相同装置,用以探究影响H2O2分解速率的因素。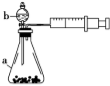 (1)、仪器a的名称。(2)、MnO2催化下H2O2分解的化学方程式是。(3)、甲小组有如下实验设计方案,请帮助他们完成表格中未填部分。
(1)、仪器a的名称。(2)、MnO2催化下H2O2分解的化学方程式是。(3)、甲小组有如下实验设计方案,请帮助他们完成表格中未填部分。实验
编号
实验目的
T/K
催化剂
浓度
甲组
实验Ⅰ
作实验
参照
298
3滴FeCl3
溶液
10 mL 2%
H2O2
甲组
实验Ⅱ
①
298
②
10 mL 5%
H2O2
(4)、甲、乙两小组得出如图数据。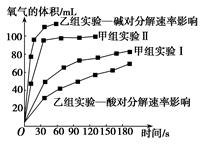
①由甲组实验数据可得出文字结论。
②由乙组研究的酸、碱对H2O2分解影响因素的数据分析:相同条件下,Na2O2和K2O2溶于水放出气体速率较快的是;乙组提出可以用BaO2固体与H2SO4溶液反应制H2O2 , 其化学反应方程式为;支持这一方案的理由是。
15. 某氯化铁(FeCl3)样品含有少量FeCl2杂质。现要测定其中铁元素的质量分数,实验按以下步骤进行,根据流程回答以下问题: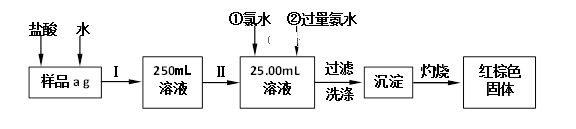 (1)、操作I是配制溶液,所用到的玻璃仪器除烧杯、玻璃棒外,还必须有、。(2)、写出加入氯水发生的离子反应方程式。(3)、写出加入过量氨水发生的离子反应方程式。(4)、写出灼烧发生反应的化学方程式。(5)、检验沉淀是否已经洗涤干净的操作是。(6)、下列操作可能使所配溶液浓度偏小的是(填写序号)。
(1)、操作I是配制溶液,所用到的玻璃仪器除烧杯、玻璃棒外,还必须有、。(2)、写出加入氯水发生的离子反应方程式。(3)、写出加入过量氨水发生的离子反应方程式。(4)、写出灼烧发生反应的化学方程式。(5)、检验沉淀是否已经洗涤干净的操作是。(6)、下列操作可能使所配溶液浓度偏小的是(填写序号)。①未洗涤烧杯和玻璃棒
②定容时俯视容量瓶的刻度线
③配溶液前容量瓶中有少量蒸馏水
④摇匀后,发现液面低于刻度线后继续加水至凹液面与刻度线相切
(7)、若原样品质量a为10g,加热后红棕色固体质量是0.6g,则样品中铁元素的质量分数是。16. 绿矾(FeSO4·7H2O)是自然界存在的一种矿石,翠绿如宝石,很早就引起人们的重视。材料一 《唐本草》和《天工开物》等古籍都记载中国很早就能焙烧绿矾制备铁红(主要成分是Fe2O3)。铁红颜色鲜艳,稳定无毒,是中国传统红色颜料的重要着色剂。
材料二 公元8世纪,阿拉伯炼金家查比尔曾提出,把绿矾焙烧可以蒸馏出“矾精”,它具有比较大的溶解力。绿矾焙烧是一种生产硫酸的古老方法。
(1)、某研究性学习小组用下图所示试验装置对绿矾的焙烧反应进行探究。
①实验过程中,装置A玻管中可观察到的实验现象是。
②装置C的作用是。
③该小组学生设计如下实验方案验证“矾精”是硫酸溶液:取U形管中的溶液少许于试管中,滴入(填试剂名称),溶液呈红色,说明“矾精”中含有H+;检验“矾精”中含有SO42-的方法是。
(2)、某工厂计划用绿矾焙烧工艺生产高纯度铁红(Fe2O3)160 kg,计算理论上所需绿矾的质量,写出计算过程。