山东省泰安市泰山区2016-2017学年九年级上学册化学期中考试试卷
试卷更新日期:2017-09-11 类型:期中考试
一、选择题
-
1. 下列厨房中的物质与水充分混合后不能形成溶液的是( )
A、食盐 B、牛奶 C、蔗糖 D、白醋2. 下列物质的用途中,不正确的是( )
A、氧化钙用于食品干燥剂 B、硝酸用于生产化肥、炸药 C、氢氧化钠用于炼油、造纸、印染等工业 D、用熟石灰和大理石制取烧碱3. 碳酸饮料的pH<7,晃动后打开瓶盖,其是pH将( )
A、不变 B、变大 C、变小 D、无法判断4. 日常生活中除去油污的方法很多,下列现象不属于乳化作用的是( )A、洗面奶洗去皮肤上的油脂 B、洗洁精洗去餐具上的油污 C、用汽油洗去衣服上的油渍 D、洗发精洗去头发上的油脂5. 下列属于复分解反应的是( )
A、Fe+H2SO4=H2↑+FeSO4 B、CaCO3 CaO+CO2↑ C、CO2+2NaOH=Na2CO3+H2O D、HCl+AgNO3=AgCl↓+HNO36. 下列说法正确的是( )A、在滴有石蕊试液的水中通入CO2后溶液变红,说明CO2气体能使石蕊试液变红色 B、铁桶能用来盛氢氧化钠溶液,也能用来盛放稀盐酸 C、熟石灰涂在墙壁表面后变硬,原因是熟石灰与CO2反应生成了坚硬的碳酸钙 D、浓硫酸具有吸水性,因此能用浓硫酸干燥所有气体7.甲、乙的溶解度曲线如下图所示,将t2℃甲、乙的饱和溶液分别降温到t1℃时。下列说法一定正确的是( )
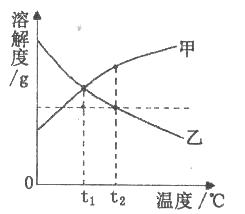 A、两溶液仍饱和 B、甲溶液仍饱和 C、溶质质量分数:甲=乙 D、溶液质量:甲=乙8.
A、两溶液仍饱和 B、甲溶液仍饱和 C、溶质质量分数:甲=乙 D、溶液质量:甲=乙8.要使下图装置中的小气球鼓起来,则使用的固体和液体可以是( )

①硝酸铵和水;
②铁和稀硫酸;
③固体氢氧化钠和水;
④生石灰和水;
⑤石灰石和稀盐酸
A、仅②③④⑤ B、①②③④⑤ C、仅②③⑤ D、仅②④⑤9.如图所示是盐酸滴入氢氧化钠溶液中,有关粒子之间反应的示意图。下列说法错误的是( )
 A、盐酸溶液中只含有氢离子、氯离子 B、两种溶液混合时,氢离子和氢氧根离子结合生成水 C、表示盐酸与氢氧化钠溶液恰好完全中和 D、两种溶液混合前后,钠离子和氯离子没有发生变化
A、盐酸溶液中只含有氢离子、氯离子 B、两种溶液混合时,氢离子和氢氧根离子结合生成水 C、表示盐酸与氢氧化钠溶液恰好完全中和 D、两种溶液混合前后,钠离子和氯离子没有发生变化二、选择填充题
-
10. 下列配制溶液实验操作中,正确的是( )
A、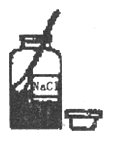 B、
B、 C、
C、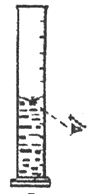 D、
D、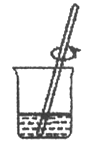 11. 下图是物质X溶于水发生解离的微观示意图,其中能说明X是一种碱的是( )
11. 下图是物质X溶于水发生解离的微观示意图,其中能说明X是一种碱的是( )
A、 B、
B、 C、
C、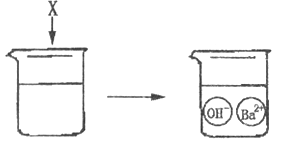 D、
D、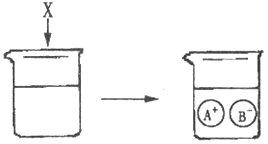 12. 向盛有10mL稀盐酸的烧杯中逐滴滴加氢氧化钠溶液,下列图像能体现溶液pH变化情况的是( )
12. 向盛有10mL稀盐酸的烧杯中逐滴滴加氢氧化钠溶液,下列图像能体现溶液pH变化情况的是( )
A、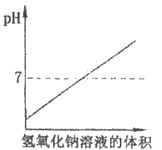 B、
B、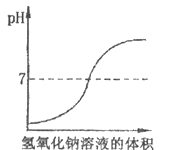 C、
C、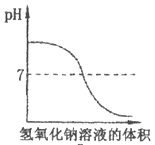 D、
D、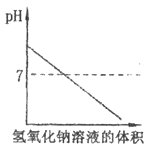
三、填空题
-
13. 化学与我们的生活、生产、科研息息相关。按要求回答下列问题:(1)、改良酸性土壤的碱(填化学式);(2)、胃酸过多,服用胃舒平[Al(OH)3]发生反应的化学方程式:;(3)、有一瓶溶液pH是4.5,如果要使溶液的pH升高,可以用的方法;
(4)、鉴别稀盐酸和稀硫酸最好选用试剂(填名称);发生反应的化学方程式为:;(5)、不同的碱具有相似性质,但性质也存在差异。例如:氢氧化钠不能与碳酸钠溶液反应,而氢氧化钙溶液却能与其反应,原因是;(6)、稀释浓硫酸的方法:.
14. 溶解是生活中常见的现象,不同物质在水中的溶解能力不同。(1)、下表是KNO3、NaCl在不同温度下的溶解度(单位:g/100g水).温度/℃
溶解度/g
0
20
40
60
80
100
KNO3
13.3
31.6
63.9
110
169
246
NaCl
35.7
36.0
36.6
37.3
38.4
39.8
①上表中的两种物质在20℃时,的溶解度较大;请用相应的数据列式表示该温度时该物质的饱和溶液的质量分数(不要求计算);
②若两物质的溶解度相等,此时所对应的温度范围在之间;
③请写出一种将KNO3的不饱和溶液转化为饱和溶液的方法;
④从NaCl溶液中得到NaCl晶体的方法是.
(2)、请根据下列实验和上述溶解度数据回答问题:(已知水的密度约为1g/cm3)实验操作
实验结果
取100mL水,加入25g硝酸钾,搅拌,恢复至20℃
全部溶解,得溶液①
再加wg硝酸钾,搅拌,恢复到20℃
恰好饱和,得溶液②
再加25g硝酸钾,搅拌,恢复到20℃
得溶液③
加热
全部溶解,得溶液④
冷却至20℃
析出晶体,得溶液⑤
I.③中溶液的质量为g;一定属于不饱和溶液的是(填数字序号,下同);溶质的质量分数一定相等的是.
Ⅱ.析出晶体的质量为.( )
A.25g B.(w+25)g C.(w+50)g
15.在学习盐酸与氢氧化钙溶液的化学性质时构建了如下知识网络图,A、B、C、D、E是不同类别的化合物,“—”表示相连的物质在一定条件下可以发生化学反应。请回答下列问题:
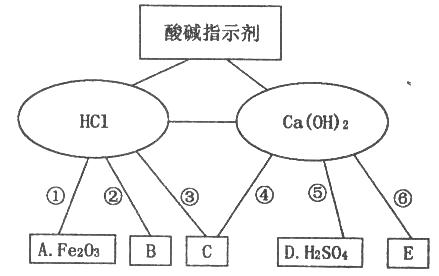 (1)、为验证二者与酸碱指示剂的作用,小亮将紫色石蕊试液滴入HCl溶液中,溶液变成色,滴入Ca(OH)2溶液中,溶液变成色;(2)、反应①的化学方程式为: , 实验现象为;(3)、实现②反应,写出一种B物质的化学式;(4)、写出图中一个中和反应的化学方程式: , 该反应的实质是;(5)、依据反应⑥说明Ca(OH)2溶液长期放置空气会变浑浊,其反应的化学方程式为:;(6)、物质C应具备的条件是。16.
(1)、为验证二者与酸碱指示剂的作用,小亮将紫色石蕊试液滴入HCl溶液中,溶液变成色,滴入Ca(OH)2溶液中,溶液变成色;(2)、反应①的化学方程式为: , 实验现象为;(3)、实现②反应,写出一种B物质的化学式;(4)、写出图中一个中和反应的化学方程式: , 该反应的实质是;(5)、依据反应⑥说明Ca(OH)2溶液长期放置空气会变浑浊,其反应的化学方程式为:;(6)、物质C应具备的条件是。16.实验室有两瓶标签破损的无色溶液甲、乙,只知道它们分别是稀盐酸和氢氧化钠溶液。请同学设计不同方案区别它们。按要求回答下列问题:
 (1)、在不选用酸碱指示剂、pH试纸的情况下,选择不同类别的物质进行区分。
(1)、在不选用酸碱指示剂、pH试纸的情况下,选择不同类别的物质进行区分。所加试剂
实验现象和结论
发生反应的化学方程式
方法一
锌粒
有气泡产生的是稀盐酸,无气泡产生的是氢氧化钠溶液
Zn+2HCl=ZnCl2+H2↑
方法二
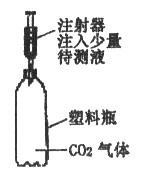
(2)、同学们在交流实验方案时,小刚设计的“用二氧化碳气体做试剂”引起了一场争论。正方观点:可以区别;反方观点:无法区别。小明赞同反方的观点,其理由是;小红则赞同正方的观点,如果你也赞同的话,请你参考下图装置说出验证的方法(简要写出操作、现象、结论):。17.实验室配制50g溶质质量分数为6%的硝酸钾溶液。现准备如下实验用品,请回答下列问题:
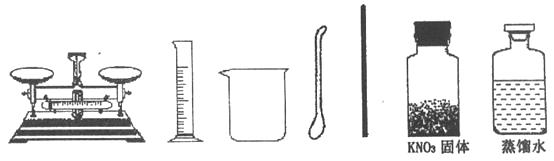 (1)、计算:需要KNO3的质量是g,需要水g;(2)、
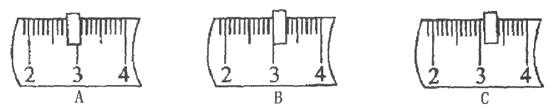
(1)、计算:需要KNO3的质量是g,需要水g;(2)、称量:硝酸钾固体时,药品应放在托盘天平(填“左”或“右”)盘的纸片上,天平上的游码位置应是下图的(填字母序号);
 (3)、
(3)、量取:所用量筒的体积是(填“50mL”或“100mL”),量取所需水时,除上述准备的实验用品外,还需要的一种仪器是(填名称),请在下图中画出水的液面位置;若俯视读数,则所配制的溶液,其溶质的质量分数会(填“偏大”、“偏小”或“不变”);
 (4)、溶解:溶解时要用玻璃棒搅拌,其目的是;(5)、
(4)、溶解:溶解时要用玻璃棒搅拌,其目的是;(5)、装瓶:请在下边标签中填写适合的内容,贴上标签将配好溶液装入试剂瓶中,塞好瓶塞。
 18.
18.如下图是甲、乙两位同学一起在实验室进行的氢氧化钠与盐酸中和反应的实验。
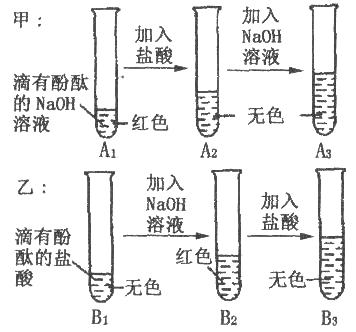
(说明:图中A1、A2、A3、B1、B2、B3均为溶液编号)
根据如图实验,请你与甲、乙同学一起完成下列探究:
探究环节
甲同学的探究
乙同学的探究
提出问题
A3溶液为什么不变红?
B3溶液中溶质成分是什么?(酚酞不计)
做出猜想
实验过程中,酚酞变质了?
猜想一:NaCl 猜想二:NaCl HCl
实验验证
①取少量A3 , 溶液于另一试管中,向其中滴加NaOH溶液,溶液变红,说明甲同学的猜想(填“成立”或“不成立”);
②你认为,在常温下A2溶液测出的pH应(填“>”、“=”或“<”)7。
取少量B3溶液加入盛有少量铁粉的试管中,观察到有无色气泡产生,固体逐渐减少,溶液由无色变 , 据此,你认为乙同学的猜想(填“一”或“二”)成立。
交流反思
①甲、乙同学的实验中,反应均涉及到的化学方程式是;
②A3溶液未变红,你认为原因是A2溶液中较多,加入的NaOH溶液未将其完全中和;
③甲、乙同学经过实验对比探究,一致认为做化学实验时应注意药品用量的控制。
四、计算题
-
19.
如下图是实验室所用盐酸试剂瓶上标签的部分内容,请仔细阅读,根据相关信息计算:
 (1)、欲配制溶质质量分数5%的稀盐酸溶液100g.需要溶质质量分数为37%的浓盐酸多少毫升?(计算结果精确至0.1 mL)
(1)、欲配制溶质质量分数5%的稀盐酸溶液100g.需要溶质质量分数为37%的浓盐酸多少毫升?(计算结果精确至0.1 mL)
(2)、化学兴趣小组的同学,对一造纸厂排放的污水进行检测,发现其主要污染物为氢氧化钠.为了测定污水中氢氧化钠的质量,他们取50g污水于烧杯中,逐滴加入溶质质量分数为5%的稀盐酸至36.5g时恰好完全反应(污水中的其它成分不与盐酸反应).求污水中氢氧化钠的质量分数?(计算结果精确至1%).