湖北省武汉市华中师大一附中2016-2017学年高一上学期化学期末考试试卷
试卷更新日期:2017-09-09 类型:期末考试
一、选择题
-
1. 下列说法不正确的是( )A、钠在空气中燃烧时,先熔化,再燃烧,发出黄色火焰,生成过氧化钠 B、铝是地壳里含量最多的金属元素,在常温下,铝不能与氧气反应 C、青铜是我国使用最早的合金,钢是用量最大、用途最广的合金 D、铁在潮湿的空气中生成的氧化物疏松多孔,不能保护内层金属2. 下列叙述不正确的是( )A、用氢氟酸对玻璃进行刻蚀可制成赏心悦目的雕花玻璃 B、Na2CO3粉末遇水生成含有结晶水的碳酸钠晶体,该晶体一定是Na2CO3•10H2O C、氯水和干燥的氯气均能使鲜花褪色 D、合金的硬度可以大于它的纯金属部分,合金的熔点也可以低于它的成分金属3. NA代表阿伏加德罗常数的值,下列说法正确的是( )A、7.1g氯气与足量的氢氧化钠溶液反应转移的电子数为0.2×6.02×1023 B、50mL 12mol/L盐酸与足量MnO2共热,转移的电子数为0.3NA C、0.1molNa2O2与足量二氧化碳充分反应转移的电子数为0.2NA D、0.1molFe在0.1mol氯气中燃烧,转移的电子数为0.2NA4. 在溶液中加入足量Na2O2后仍能大量共存的离子组是( )A、NH4+、Ba2+、Cl﹣、NO3﹣ B、K+、AlO2﹣、Cl﹣、SO42﹣ C、Ca2+、Mg2+、NO3﹣、HCO3﹣ D、Na+、Cl﹣、CO32﹣、SO32﹣5. 下列离子方程式中正确的是( )A、Na2O2溶于水:Na2O2+H2O═2Na++2OH﹣+O2↑ B、向氧化铁中加入氢碘酸发生反应:Fe2O3+6HI═2Fe2++I2+3H2O+4I﹣ C、氯化铝溶液中加入过量氨水:Al3++4NH3•H2O═AlO2﹣+4NH4++2H2O D、漂白粉溶液中通入过量的CO2:ClO﹣+CO2+H2O═HClO+HCO3﹣6. 下列各组物质中,满足表中图示物质在通常条件下一步转化关系的组合只有( )
序号
X
Y
Z
W
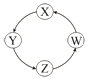
①
Cu
CuSO4
Cu(OH)2
CuO
②
Na
NaOH
Na2CO3
NaCl
③
Cl2
Ca(ClO)2
HClO
HCl
④
Fe
FeCl3
FeCl2
Fe(OH)2
A、①②③ B、①③④ C、②③ D、①④7. 下列实验能成功的是( )①用MgCl2溶液鉴别Na2CO3和NaOH溶液
②用稀盐酸鉴别Na2CO3溶液和NaHCO3溶液
③用观察法区别Na2O和Na2O2
④用澄清石灰水鉴别Na2CO3溶液和NaHCO3固体.
A、①②③④ B、③④ C、②③ D、②③④8. 已知Br2+2Fe2+═2Br﹣+2Fe3+ , 现向含溶质a mol的FeBr2溶液中通入b mol Cl2 , 充分反应.下列说法不正确的是( )A、离子的还原性强弱:Fe2+>Br﹣>Cl﹣ B、当氯气少量时,发生的离子反应:2Fe2++Cl2═2Fe3++2Cl﹣ C、当a=b时,反应后溶液的离子浓度:c(Fe3+):c(Br﹣):c(Cl﹣)=1:2:2 D、当氯气过量时,发生离子反应:2Fe2++4Br﹣+3Cl2═2Fe3++2Br2+6Cl﹣9. 下列氯化物中,既能由金属和氯气直接反应制得,又能由金属和盐酸反应制得的是( )A、FeCl2 B、FeCl3 C、CuCl2 D、MgCl210. 下列不能使红墨水褪色的是( )A、氯水 B、次氯酸钠溶液 C、活性炭 D、氯化钙溶液11. 检验HCl气体中是否混有Cl2 , 可采用的方法是( )A、用干燥的蓝色石蕊试纸 B、用干燥的有色布条 C、将气体通入硝酸银溶液 D、用湿润的有色布条12. 向如图所示装置进行下列实验:将①中溶液滴入②中,预测的现象与实际相符的是( )选项
①
②
现象
A
浓盐酸
二氧化锰
产生黄绿色气体
B
氯化铁溶液
铁氰化钾溶液
产生蓝色沉淀
C
浓硝酸
用砂纸打磨过的铝条
无明显现象
D
偏铝酸钠
稀盐酸
立即产生白色沉淀
 A、A B、B C、C D、D13. 化学在日常生活中有着广泛的应用,下列对应关系不正确的是( )
A、A B、B C、C D、D13. 化学在日常生活中有着广泛的应用,下列对应关系不正确的是( )实际应用
化学原因
A
“84”消毒液和洁厕灵不能混合使用
发生化学反应产生有毒气体
B
FeCl3腐蚀Cu刻制印刷电路板
铁比铜金属性强
C
铝制餐具不宜用来蒸煮或长时间存放酸性、碱性或咸的食物
酸、碱还有盐可直接侵蚀铝的保护膜以及铝制品本身
D
明矾、硫酸铁可作净水剂
溶于水形成胶体从而凝聚水中的悬浮物
A、A B、B C、C D、D14. 下列关于物质的检验,说法正确的是( )A、向无色溶液中加入氯化钡溶液有白色沉淀生成,再加盐酸,沉淀不消失,则溶液中一定含有SO42﹣ B、用铂丝蘸取少量某溶液进行焰色反应,火焰呈黄色,该溶液一定是钠盐溶液 C、滴加硝酸化的AgNO3溶液后产生白色沉淀,说明该溶液一定含有Cl﹣ D、向某溶液中滴加KSCN溶液,溶液不变色,滴加氯水后溶液显红色,该溶液中一定含Fe2+15. 类推的思维方法在化学学习与研究中有时会产生错误结论,因此类推的结论最终要经过实践的检验,才能决定其正确与否,下列几种类推结论中正确的是( )A、NaCl与浓H2SO4加热可制HCl,推测NaBr与浓H2SO4加热可制HBr B、Fe与Cl2反应生成FeCl2 , 推测Fe与I2反应生成FeI3 C、不能电解AlCl3溶液来制取金属铝:推测也不能用电解MgCl2溶液来制取金属镁 D、CO2与Na2O2反应只生成Na2O3和O2 , 故SO2与Na2O2反应只生成Na2SO3和O216. 下列各组物质中,Y是X物质中含有的少量杂质,Z是除杂试剂,其中所加试剂最合理的一组是( )X
Y
Z
A
NaHCO3溶液
Na2CO3
BaCl2溶液
B
FeCl3溶液
CuCl2
Fe
C
Fe2O3
Al2O3
NaOH溶液
D
Na2SO4溶液
Na2CO3
盐酸
A、A B、B C、C D、D17. 下列试剂的贮存方法正确的是( )①NaOH溶液应保存在带有磨口玻璃塞的试剂瓶中;②氯水应保存在棕色试剂瓶中,最好是现用现配;③液溴保存在带有胶塞的试剂瓶中,用水封;④Na2SO3应密封保存,防止被空气中的氧气氧化;⑤浓盐酸和浓氨水都具有挥发性,因此装有二者的试剂瓶应放在同一贮存柜中.
A、①②④ B、②③⑤ C、②④ D、③⑤18. 下列装置所示的实验中,能达到目的是( )A、 长时间看到Fe(OH)2白色沉淀
B、
长时间看到Fe(OH)2白色沉淀
B、 除去Cl2中的HCl杂质
C、
除去Cl2中的HCl杂质
C、 比较NaHCO3、Na2CO3的热稳定性
D、
比较NaHCO3、Na2CO3的热稳定性
D、 分离碘酒中的碘和酒精
19. 某溶液中含有NH4+、Mg2+、Fe2+、Al3+和SO42﹣五种离子,若向其中加入过量的Ba(OH)2溶液,微热并搅拌,再加入过量的氢碘酸,溶液中大量减少的离子有( )A、4种 B、3种 C、2种 D、1种20. 如图表示在某溶液中滴加Ba(OH)2溶液时,沉淀的物质的量随Ba(OH)2的物质的量的变化关系.该溶液的成分可能是( )
分离碘酒中的碘和酒精
19. 某溶液中含有NH4+、Mg2+、Fe2+、Al3+和SO42﹣五种离子,若向其中加入过量的Ba(OH)2溶液,微热并搅拌,再加入过量的氢碘酸,溶液中大量减少的离子有( )A、4种 B、3种 C、2种 D、1种20. 如图表示在某溶液中滴加Ba(OH)2溶液时,沉淀的物质的量随Ba(OH)2的物质的量的变化关系.该溶液的成分可能是( ) A、NH4Al(SO4)2 B、KAl(SO4)2 C、Al2(SO4)3 D、NaAlO221. 甲、乙、丙、丁、戊五种物质是中学化学常见的物质,其中甲、乙均为单质,它们的转化关系如图所示(某些条件和部分产物已略去).下列说法正确的是( )
A、NH4Al(SO4)2 B、KAl(SO4)2 C、Al2(SO4)3 D、NaAlO221. 甲、乙、丙、丁、戊五种物质是中学化学常见的物质,其中甲、乙均为单质,它们的转化关系如图所示(某些条件和部分产物已略去).下列说法正确的是( )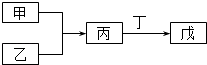 A、若甲可以与NaOH溶液反应放出H2 , 则丙一定是两性氧化物 B、若甲为短周期中最活泼的金属,且戊为碱,则丙生成戊一定是氧化还原反应 C、若丙、丁混合产生大量白烟,则乙可能具有漂白性 D、若甲、丙、戊都含有同一种元素,则三种物质中,该元素的化合价由低到高的顺序可能为甲<丙<戊22. 已知在碱性溶液中可发生如下反应:Fe(OH)3+ClO﹣+OH﹣═Fe4n﹣+Cl﹣+H2O(未配平).则下列有关叙述错误的是( )A、已知FeO4n﹣中Fe的化合价是+6价,则n=2 B、每产生1molCl﹣ , 转移2mol电子 C、FeO4n﹣具有强氧化性,一般其还原产物为Fe3+ , 可用作新型自来水消毒剂和净水剂 D、若n=2,则该反应中氧化剂与还原剂的物质的量之比为2:323. 向含Fe2(SO4)3、CuCl2、H2SO4的混合溶液中投入足量的Fe粉,充分反应后,剩余的固体物质经干燥,称得其质量比加入的铁粉质量减轻16g,此时溶液中c(Fe2+)是原混合液中c(Cu2+)的3倍(反应前后体积没有变化),溶液中c(SO42﹣)与c(Cl﹣)之比是( )A、1:2 B、2:1 C、1:3 D、1:124. PbO2是褐色固体,受热分解为Pb的+4和+2价的混合氧化物,+4价的Pb能氧化浓盐酸生成Cl2;现将1mol PbO2加热分解得到O2 , 向剩余固体中加入足量的浓盐酸得到Cl2 , O2和Cl2的物质的量之比为3:2,则剩余固体的组成及物质的量比是( )A、1:2混合的Pb3O4、PbO B、1:2混合的PbO2、Pb3O4 C、1:4:1混合的PbO2、Pb3O4、PbO D、1:1:4混合的PbO2、Pb3O4、PbO
A、若甲可以与NaOH溶液反应放出H2 , 则丙一定是两性氧化物 B、若甲为短周期中最活泼的金属,且戊为碱,则丙生成戊一定是氧化还原反应 C、若丙、丁混合产生大量白烟,则乙可能具有漂白性 D、若甲、丙、戊都含有同一种元素,则三种物质中,该元素的化合价由低到高的顺序可能为甲<丙<戊22. 已知在碱性溶液中可发生如下反应:Fe(OH)3+ClO﹣+OH﹣═Fe4n﹣+Cl﹣+H2O(未配平).则下列有关叙述错误的是( )A、已知FeO4n﹣中Fe的化合价是+6价,则n=2 B、每产生1molCl﹣ , 转移2mol电子 C、FeO4n﹣具有强氧化性,一般其还原产物为Fe3+ , 可用作新型自来水消毒剂和净水剂 D、若n=2,则该反应中氧化剂与还原剂的物质的量之比为2:323. 向含Fe2(SO4)3、CuCl2、H2SO4的混合溶液中投入足量的Fe粉,充分反应后,剩余的固体物质经干燥,称得其质量比加入的铁粉质量减轻16g,此时溶液中c(Fe2+)是原混合液中c(Cu2+)的3倍(反应前后体积没有变化),溶液中c(SO42﹣)与c(Cl﹣)之比是( )A、1:2 B、2:1 C、1:3 D、1:124. PbO2是褐色固体,受热分解为Pb的+4和+2价的混合氧化物,+4价的Pb能氧化浓盐酸生成Cl2;现将1mol PbO2加热分解得到O2 , 向剩余固体中加入足量的浓盐酸得到Cl2 , O2和Cl2的物质的量之比为3:2,则剩余固体的组成及物质的量比是( )A、1:2混合的Pb3O4、PbO B、1:2混合的PbO2、Pb3O4 C、1:4:1混合的PbO2、Pb3O4、PbO D、1:1:4混合的PbO2、Pb3O4、PbO二、填空题
-
25. 根据要求回答问题:(1)、.据报道,某地化工厂的贮氯罐意外发生泄漏,为了厂区和周围地区群众的安全,有关方面采取了相关措施:
①依据厂区实际情况,处理钢瓶的方法正确的是
A.钢瓶推到坡下的小河里
B.把钢瓶丢到深坑里,用石灰填埋
C.把钢瓶扔到农田
②钢瓶处理后,工人应立即
A.转移到坡下 B.转移到坡上
③同时,迅速赶到的消防员向贮氯罐周围空中喷洒稀NaOH溶液,写出相关的离子方程式
(2)、.将下列硅酸盐改写成氧化物的形式①高岭石Al2(Si2O5)(OH)4:
②正长石KAlSi3O8: .
26. 某工厂的工业废水中含有大量的FeSO4、较多的Cu2+和少量的Na+ . 为了减少污染并变废为宝,工厂计划从该废水中回收硫酸亚铁和金属铜.请根据流程图,在方框和括号内填写物质名称(或主要成分的化学式)或操作方法,完成回收硫酸亚铁和铜的简单实验方案. (1)、操作②的名称为 , 所需要的玻璃仪器为、、烧杯.(2)、试剂⑤的化学式为 , 所发生的化学方程式为 .27. A,B,C,D均为中学化学常见的纯净物,A是单质.它们之间有如下的反应关系:
(1)、操作②的名称为 , 所需要的玻璃仪器为、、烧杯.(2)、试剂⑤的化学式为 , 所发生的化学方程式为 .27. A,B,C,D均为中学化学常见的纯净物,A是单质.它们之间有如下的反应关系: (1)、若D物质具有两性,②③反应均要用强碱溶液,④反应是通入过量的一种引起温室效应的主要气体.写出②反应的离子方程式;④反应离子方程式 .(2)、若A是应用最广泛的金属.④反应用到A,②⑤反应均用到同一种黄绿色气体单质.写出A与水反应的化学方程式 . ④反应的离子方程式 . D中加入氢氧化钠的现象 .(3)、若A是太阳能电池用的光伏材料.C、D为钠盐,且溶液均显碱性.④反应也是通入一种引起温室效应的主要气体.写出②反应的化学方程式 . ⑤反应用到B,反应条件为高温,则⑤的化学方程式为 .28. 蛇纹石矿可以看作由MgO、Fe2O3、Al2O3、SO2组成,由蛇纹石制取碱式碳酸镁的实验步骤如图1:
(1)、若D物质具有两性,②③反应均要用强碱溶液,④反应是通入过量的一种引起温室效应的主要气体.写出②反应的离子方程式;④反应离子方程式 .(2)、若A是应用最广泛的金属.④反应用到A,②⑤反应均用到同一种黄绿色气体单质.写出A与水反应的化学方程式 . ④反应的离子方程式 . D中加入氢氧化钠的现象 .(3)、若A是太阳能电池用的光伏材料.C、D为钠盐,且溶液均显碱性.④反应也是通入一种引起温室效应的主要气体.写出②反应的化学方程式 . ⑤反应用到B,反应条件为高温,则⑤的化学方程式为 .28. 蛇纹石矿可以看作由MgO、Fe2O3、Al2O3、SO2组成,由蛇纹石制取碱式碳酸镁的实验步骤如图1: (1)、蛇纹石矿加盐酸溶解后,溶液里除了Mg2+外,还含有的金属离子是 .(2)、进行I操作时,控制溶液的pH=7.8(有关氢氧化物沉淀的pH见下表),Ca(OH)2不能过量,若Ca(OH)2过量可能会导致溶解,产生沉淀.
(1)、蛇纹石矿加盐酸溶解后,溶液里除了Mg2+外,还含有的金属离子是 .(2)、进行I操作时,控制溶液的pH=7.8(有关氢氧化物沉淀的pH见下表),Ca(OH)2不能过量,若Ca(OH)2过量可能会导致溶解,产生沉淀.氢氧化物
Fe(OH)3
Al(OH)3
Mg(OH)2
开始沉淀pH
1.9
3.3
9.4
沉淀完全时PH
3.2
5.4
12.4
(3)、从沉淀混合物A中提取红色氧化物作为颜料,先向沉淀物A中加入(填所加物质的化学式),然后、、灼烧(填实验操作名称).灼烧操作需在中进行(填写仪器名称),上述实验中,可以循环利用的物质是(填化学式).(4)、现设计实验,确定产品aMgCO3•bMg(OH)2•cH2O中a、b、c的值,请写出下列实验步骤中所需要测定的项目(可用试剂:浓硫酸、碱石灰、氢氧化钠溶液、澄清石灰水):①样品称量,②高温分解,③测出水蒸气的质量,④ , ⑤称量MgO的质量.(5)、从下列仪器图2中(装有必要的试剂)中选择完成上述实验所必需的仪器,连接一套装置(选择仪器代号,可重复使用,用“A→B→…→”表示)(6)、18.2g产品完全分解后.产生6.6gCO2和8.0gMgO,由此可知,产品的化学式中 a= , b= , c= .三、计算题
-
29. 实验室里通常用MnO2与浓盐酸反应制取氯气,为进行有关氯气的性质实验,需要4瓶容积为100mL的氯气.(常温下,氯气的密度为2.91g/L)(1)、写出制取氯气的离子方程式.(2)、制取4瓶氯气,理论上需要MnO2固体的质量是多少?(3)、制取4瓶氯气,被氧化的HCl的物质的量是多少?