浙教版科学九年级上册第二章第2节 金属的化学性质同步练习
试卷更新日期:2016-04-20 类型:同步测试
一、单选题
-
1. 下列四个图象分别对应四个变化过程,其中正确的是( )A、服用胃舒平[主要成分Al(OH)3]治疗胃酸过多(胃液pH随时间变化图)
 B、向氢氧化钠和碳酸钠的混合溶液中加入稀盐酸溶液直至过量
B、向氢氧化钠和碳酸钠的混合溶液中加入稀盐酸溶液直至过量
 C、常温下,相同质量的锌和铁分别与足量的溶质质量分数相同的稀硫酸反应
C、常温下,相同质量的锌和铁分别与足量的溶质质量分数相同的稀硫酸反应
 D、将一定质量的硝酸钾不饱和溶液恒温蒸发水份,直至有少量晶体析出
D、将一定质量的硝酸钾不饱和溶液恒温蒸发水份,直至有少量晶体析出
 2. 初中化学的很多反应可以表示为:甲+乙→丙+丁,其中甲、乙、丙、丁及可能是单质,也可能是化合物,下列说法中,正确的是( )
2. 初中化学的很多反应可以表示为:甲+乙→丙+丁,其中甲、乙、丙、丁及可能是单质,也可能是化合物,下列说法中,正确的是( )
A、若甲、乙、丙分别是酸、碱、盐,则丁一定是水 B、甲、乙、丙、丁均是化合物,则该反应一定是复分解反应 C、若甲是一氧化碳,乙是金属氧化物,则丙一定是二氧化碳 D、若甲是锌,丙是氢气,则乙一定是稀硫酸3. 初中化学的很多反应可以表示为:甲+乙→丙+丁,其中甲、乙、丙、丁及可能是单质,也可能是化合物,下列说法中,正确的是( )
A、若甲、乙、丙分别是酸、碱、盐,则丁一定是水 B、甲、乙、丙、丁均是化合物,则该反应一定是复分解反应 C、若甲是一氧化碳,乙是金属氧化物,则丙一定是二氧化碳 D、若甲是锌,丙是氢气,则乙一定是稀硫酸4. 下列有关金属材料的叙述错误的是( )
A、回收利用废金属可减少对环境的污染 B、铝块能制成铝箔是利用了铝的延展性 C、铝比铁更容易跟氧气和其他物质反应,因而铝的抗腐蚀性能比铁差 D、焊锡(锡铅合金)比锡熔点低5. 下列有关金属的说法错误的是( )
A、金属的回收利用是保护金属资源的有效途径之一 B、炒完菜后应及时除掉锅底的水,这样可以防止铁锅生锈 C、铝在空气中易生成一层致密的氧化物保护膜,故铝制品性质不稳定 D、生铁和钢是含碳量不同的铁合金,其中生铁的含碳量大于钢的含碳量6. 下列整理归纳得出的规律合理的是( )
A、溶液中有溶剂,所以溶液中一定有水 B、含有碳元素的化合物一定是有机物 C、金属都能与酸反应产生氢气 D、酸、碱中一定含有氢元素7. 在生产、生活中,下列做法不正确的是( )
A、工业用汽油或烧碱溶液等擦洗机器表面油污 B、用天然棉纤维做内衣比用合成纤维做内衣穿着更舒适 C、农业上用铁桶配制农药波尔多液 D、焙制糕点时可在面中加入适量的碳酸氢钠8. 某化学兴趣小组设计了验证Fe、Cu、Ag的金属活动性顺序的多种方案,每种方案所需的试剂如下:①Fe、Ag、CuSO4溶液;②Cu、FeCl2溶液、AgNO3溶液;③Fe、Cu、稀盐酸、AgNO3溶液;④Fe、Cu、AgNO3溶液;⑤Cu、Ag、FeSO4溶液,你认为可行的方案是( )
A、①②③④ B、①②③⑤ C、只有①②⑤ D、只有①②③9. 为验证锌、铜、银三种金属的活动性顺序,某小组同学设计采用下列三组试剂进行探究:①锌、银、硫酸铜溶液②银、硫酸铜溶液、硫酸锌溶液③铜、硫酸锌溶液、硝酸银溶液,你认为其中可行的是( )A、只有③ B、①和② C、①和③ D、②和③10. 有M、N、R三种金属,将M和N浸入稀盐酸中,N溶解,M不溶解;将M浸入R的硫酸盐溶液中,在M的表面有R析出,则M、N、R的金属活动性由强到弱可排列为( )A、R>M>N B、N>R>M C、R>N>M D、N>M>R11.如图所示:将铁钉置于水中,则铁钉三个不同部位,最先生锈的是( )
 A、a处 B、b处 C、c处 D、以上都有可能12. 某研究性学习小组设计下列实验方案,验证铁、铜、银三种金属的活动性顺序,每种方案所需试剂如下(反应所得产物可用作试剂进一步反应),其中不可行的方案是( )A、铜、硝酸银溶液、氯化亚铁溶液 B、银、铜、氯化亚铁溶液 C、铁、银、氯化铜溶液 D、铁、硝酸银溶液、氯化铜溶液13. 用实验证明铜、银两种金属的化学活动性顺序,应选用的试剂是( )A、硫酸钠溶液 B、硝酸银溶液 C、硫酸锌溶液 D、稀硫酸14. A、B、C三种金属,它们与有关溶液的反应可用如下化学方程式表示:
A、a处 B、b处 C、c处 D、以上都有可能12. 某研究性学习小组设计下列实验方案,验证铁、铜、银三种金属的活动性顺序,每种方案所需试剂如下(反应所得产物可用作试剂进一步反应),其中不可行的方案是( )A、铜、硝酸银溶液、氯化亚铁溶液 B、银、铜、氯化亚铁溶液 C、铁、银、氯化铜溶液 D、铁、硝酸银溶液、氯化铜溶液13. 用实验证明铜、银两种金属的化学活动性顺序,应选用的试剂是( )A、硫酸钠溶液 B、硝酸银溶液 C、硫酸锌溶液 D、稀硫酸14. A、B、C三种金属,它们与有关溶液的反应可用如下化学方程式表示:①A+BSO4=ASO4+B ②C+H2SO4=CSO4+H2
③C+BSO4=CSO4+B ④A+H2SO4→不反应
则A、B、C三种金属的活动性顺序是( )
A、A>B>C B、A>C>B C、C>B>A D、C>A>B15. 某化学兴趣小组为测定Fe、Cu、Ag三种金属的活动性顺序,选用下列各组试剂,你认为不可行的是( )A、Cu、FeCl2溶液,AgNO3溶液 B、Cu、Ag、FeSO4溶液 C、Fe、Ag、CuSO4溶液 D、Fe、Cu、稀硫酸,AgNO3溶液二、填空题
-
16. 防止铁制品生锈的常用措施有(写一点即可),也可在铁片表面镀上一层锌,表面会形成一层保护薄膜,其中含有Zn2(OH)2CO3 . 若该物质通过化合反应生成,试推断,反应物除了Zn、水和氧气外,还应有 .17.
人类的生产生活离不开金属,铁是目前使用最广泛的金属.
(1)如图是铁元素在元素周期表中的相关信息,则铁元素的原子序数为 .
(2)铁在空气中锈蚀,实际上是铁跟等物质作用,发生一系列复杂的化学反应,转化为铁的化合物的过程.
(3)工业上可用赤铁矿(主要成分是三氧化二铁)炼铁,其主要反应原理是 (用化学方程式表示).
 18. 铁是一种化学性质的金属,铁生锈实际上是铁和、等物质相互作用,发生一系列复杂的化学反应.铁锈的主要成分是 .19. 将下面5个选项分别填在横线上,每项只用一次
18. 铁是一种化学性质的金属,铁生锈实际上是铁和、等物质相互作用,发生一系列复杂的化学反应.铁锈的主要成分是 .19. 将下面5个选项分别填在横线上,每项只用一次A、缓慢氧化;B、疏松多孔;C、受空气和水共同作用;D、铁器与空气隔绝;E、没有水分存在铁不易生锈.
(1)钢铁锈蚀条件 ;
(2)钢铁锈蚀的过程属于 ;
(3)铁锈的状态 ;
(4)使铁器保持干燥的原因是 ;
(5)铁器表面喷漆的目的是 .
20.将同一个土豆先后放入甲、乙两杯盐水中,观察到如图所示的现象,请回答下列问题.
(1)根据观察到的现象,你能得到一些结论吗?,请任写一条 .
(2)把几枚小铁钉完全插入乙土豆内,再把土豆放回乙盐水中,此时土豆在乙盐水中将 ,请简要说明理由: .

三、探究题
-
21.
兴趣小组欲探究Zn、Cu、Ag、R四种金属的活动性顺序(R为未知金属),进行了如下实验:
 (1)、如图A所示,将四根金属丝同时插入烧杯中,则甲中发生反应的化学方程式为 ,乙中的现象为 .(2)、一段时间后,将烧杯中四根金属丝依次替换为R、Ag、R、Cu,如图B所示.
(1)、如图A所示,将四根金属丝同时插入烧杯中,则甲中发生反应的化学方程式为 ,乙中的现象为 .(2)、一段时间后,将烧杯中四根金属丝依次替换为R、Ag、R、Cu,如图B所示.①若甲中出现气泡,乙中无明显现象,则烧杯乙中的物质是 ,可得出Zn、Cu、Ag、R的活动性顺序由强到弱为 ;
②若甲中无明显现象,乙中R表面出现红色固体,则不能推出的结论是 .
a. R>Ag b. R>Cu c.R>Zn d.R<H.
22.我国第四套人民币硬币中使用到镍(Ni)、铜、铁等金属.某兴趣小组决定探究Ni、Fe、Cu的金属活动性顺序.
 (1)、实验一:分别进行如图所示的实验.
(1)、实验一:分别进行如图所示的实验.实验现象:甲中没有现象,乙和丙中产生气泡,且乙中产生气泡比丙中的快.
①写出铁与稀硫酸反应的化学方程式 .
②根据实验现象,(填“能”或“不能”)比较出Ni、Fe、Cu的金属活动性强弱.
(2)、实验二:(所用金属片均已用砂纸打磨)
实验步骤
实验现象
实现结论

相同浓度的
NiSO4溶液
铁片表面有固体析出,
铜片表面
.
三种金属活动性
由强到弱的顺序为:
.
(3)、迁移应用:用镍片、硫酸亚铁溶液和溶液,通过实验也能证明Fe、Ni、Cu的金属活动性顺序.23. 为了测定铁和铜两种金属的活动性顺序,请用提供的下列药品设计实验方案.铁片 铜片 稀硫酸 FeSO4溶液 CuSO4溶液
(1)、利用上述药品,你最多可以设计 种实验方案.(2)、请选择一种实验方案叙述如下: .[实验现象] .
[化学方程式] .
[实验结论] .
24.含锌废渣和各种锌矿(如菱锌矿)都有着重要的用途.
Ⅰ.以含锌废渣(主要成分为ZnO,杂质为FeO、CuO)为原料制备七水硫酸锌(ZnSO4•7H2O)的流程如图1.
 (1)、粉碎的目的是 .(2)、若实验室用质量分数为98%的硫酸配制200g 25%的硫酸,需要的玻璃仪器有胶头滴管、玻璃棒、和 , 此处玻璃棒的作用是 .(3)、物质X是 , 滤渣中含有金属单质有 , 除铜时发生的反应属于反应(填基本反应类型)(4)、流程中获得七水硫酸锌前省略的操作是、冷却结晶、、洗涤和低温烘干.(5)、某温度下,Fe(OH)3分解得到一种铁、氧质量比为21:8的氧化物,该氧化物的化学式是 .(6)、除铁过程中,温度、pH对除铁效果的影响分别如图2所示.由图可知,除铁时温度应控制在 ℃为宜,pH应控制在 为宜.(7)、
(1)、粉碎的目的是 .(2)、若实验室用质量分数为98%的硫酸配制200g 25%的硫酸,需要的玻璃仪器有胶头滴管、玻璃棒、和 , 此处玻璃棒的作用是 .(3)、物质X是 , 滤渣中含有金属单质有 , 除铜时发生的反应属于反应(填基本反应类型)(4)、流程中获得七水硫酸锌前省略的操作是、冷却结晶、、洗涤和低温烘干.(5)、某温度下,Fe(OH)3分解得到一种铁、氧质量比为21:8的氧化物,该氧化物的化学式是 .(6)、除铁过程中,温度、pH对除铁效果的影响分别如图2所示.由图可知,除铁时温度应控制在 ℃为宜,pH应控制在 为宜.(7)、以某菱锌矿(ZnCO3含量为62.5%)为原料制备锌的原理如下(假设杂质不参加反应):
ZnCO3
 ZnO+CO2↑ ZnO+CO
ZnO+CO2↑ ZnO+CO Zn+CO2 .
Zn+CO2 . 则100吨这样的菱锌矿理论上最多可制得锌多少吨?(写出计算过程)
25.连云港碱厂年产纯碱120万吨,是我国三大纯碱生产企业之一.它的产品除了纯碱外,还有氧化钙和碳酸氢钠.该厂生产纯碱的工艺流程可简单表示如图1:

其生产过程中涉及到的主要化学反应有:
①NaCl+NH3+CO2+H2O=NH4Cl+NaHCO3↓ ②2NaHCO3
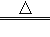 Na2CO3+CO2↑+H2O
Na2CO3+CO2↑+H2O请回答:
(1)、①“碳化”过程中需要的CO2 , 可由石灰石高温煅烧得到,该反应的化学方程式为 .②实验室中,通常用稀盐酸与石灰石反应制取CO2气体,不选用浓盐酸的理由是 ;干燥CO2气体,可用的干燥剂是 (填字母).
A.浓硫酸 B.固体氢氧化钠 C.生石灰
(2)、①该厂“过滤”所得的NH4Cl可作化肥中的 肥,它也可与Ca(OH)2在加热时发生反应生成产品CaCl2 , 同时还有NH3和H2O生成,写出该反应的化学方程式: .该厂的另一种产品碳酸氢钠俗称 ,它的重要用途有 (只写一种).②实验室进行“过滤”操作时,下列说法正确的有 (填字母) .
A.使用的漏斗叫长颈漏斗 B.液面应低于滤纸边缘
C.玻璃棒应不停搅拌 D.漏斗下端的管口要紧靠烧杯内壁
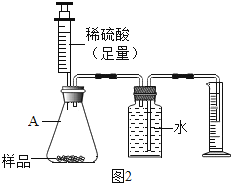
(3)、某化学兴趣小组的同学为了测定该厂生产的纯碱是否属于优等品(国家规定:优等品中碳酸钠的质量分数不低于99.2%),试剂了如下两种实验方案:方案一:称取样品10.65g,加水完全溶解,向其中加入足量的氯化钡溶液,充分反应后,过滤、洗涤、干燥得固体19.70g.通过计算(写出计算过程)判断该厂的产品是否属于优等品.(杂质可溶于水且不与氯化钡反应)
(4)、方案二:用图2所示的装置,通过准确测量排出水的体积,也可计算样品的纯度.该装置中仪器A的名称是 ,但实验后同学们发现所测的碳酸钠的纯度偏低,造成此结果的原因可能是 .(装置气密性良好)