浙教版科学九年级上册第一章第2节 物质的酸碱性同步练习
试卷更新日期:2016-04-20 类型:同步测试
一、单选题
-
1. 推理是化学学习中常用的思维方法.下列推理正确的是( )
A、酸性溶液的pH小于7.食醋是酸性溶液,所以食醋的pH小于7 B、向硫酸钠溶液中加入硝酸钡溶液产生白色沉淀.所以凡是加入硝酸钡溶液有上述现象的一定是硫酸盐溶液 C、碱溶液一定显碱性,所以显碱性的溶液一定是碱溶液 D、中和反应有盐和水生成,所以有盐和水生成的反应一定是中和反应2. 下列是人体中几种体液的正常pH,酸性最强的是( )
A、胃液(0.8﹣1.5) B、唾液(6.6﹣7.1) C、血液(7.35﹣7.45) D、胆汁(6.8﹣7.4)3. 下列数据是一些物质的pH,其中呈碱性的是 ( )A、(8﹣9)牙膏
B、(6﹣7)胡萝卜
B、(6﹣7)胡萝卜 
C、(3﹣4)橘子
C、(3﹣4)橘子
D、(2﹣3)食醋
D、(2﹣3)食醋
4. 化学与生活密切相关.下列叙述中正确的是( )A、紫罗兰花瓣早晚颜色深浅不同,与花瓣中的CO2含量有关 B、动物蛋白中富含维生素C C、人体缺钙会引起骨质疏松症,因此钙元素摄入的越多越好 D、活性炭能把自来水变成纯净水5. 类推是化学学习中常用的思维方法,以下推理正确的是( )A、碱性溶液能使酚酞试液变红,所以能使酚酞试液变红的溶液一定呈碱性 B、离子是带电荷的粒子,所以带电荷的粒子一定是离子 C、有机物都含有碳元素,所以含碳元素的化合物一定是有机物 D、单质由同种元素组成,所以由同种元素组成的物质一定是单质6. 取三种植物的花瓣分别放在研钵中,加入酒精研磨,得到花汁.各取少许花汁,用稀酸和稀碱进行检验,结果如下表所示:
4. 化学与生活密切相关.下列叙述中正确的是( )A、紫罗兰花瓣早晚颜色深浅不同,与花瓣中的CO2含量有关 B、动物蛋白中富含维生素C C、人体缺钙会引起骨质疏松症,因此钙元素摄入的越多越好 D、活性炭能把自来水变成纯净水5. 类推是化学学习中常用的思维方法,以下推理正确的是( )A、碱性溶液能使酚酞试液变红,所以能使酚酞试液变红的溶液一定呈碱性 B、离子是带电荷的粒子,所以带电荷的粒子一定是离子 C、有机物都含有碳元素,所以含碳元素的化合物一定是有机物 D、单质由同种元素组成,所以由同种元素组成的物质一定是单质6. 取三种植物的花瓣分别放在研钵中,加入酒精研磨,得到花汁.各取少许花汁,用稀酸和稀碱进行检验,结果如下表所示:花的种类
花汁在酒精中的颜色
花汁在酸溶液中的颜色
花汁在碱溶液中的颜色
大红花
粉红色
橙色
绿色
万寿菊
黄色
黄色
黄色
雏菊
无色
无色
黄色
则下列说法不正确的是( )
A、研磨花瓣时加入酒精是为了溶解其中的色素 B、在pH=10的溶液中大红花汁会变成橙色 C、万寿菊花汁不能用作酸碱指示剂 D、可用雏菊花汁来区别稀盐酸和氢氧化钠溶液7. 下列溶液中,能使酚酞溶液变红的是( )A、烧碱溶液 B、稀硫酸 C、稀盐酸 D、食盐水8. 推理是化学学习中常用的思维方法,下列推理正确的是( )A、酸溶液能使紫色石蕊试液变红,能使紫色石蕊试液变红的一定是酸 B、氢氧化钠能与二氧化碳反应生成盐和水.所以属于中和反应 C、碱溶液的pH>7,碳酸钠溶液的pH也大于7.所以碳酸钠属于碱 D、NaOH溶液中的OH﹣能与酸反应,则KOH溶液中的OH﹣也能与酸反应9. 推理是学习化学的一种重要方法.根据下列实验事实推理出结论正确的是( )编号
实验事实
实验结论
A
某溶液使石蕊溶液变红
该溶液一定是稀盐酸
B
经测定某物质中含有氧元素
该物质一定是氧化物
C
常温下,测定某溶液的pH=12
该溶液一定呈碱性
D
某粒子带有电荷
该粒子一定是离子
A、A B、B C、C D、D10. 分析推理是化学学习中常用的思维方法.下列说法正确的是( )A、酸性溶液能使紫色石蕊试液变红,所以能使紫色石蕊试液变红的溶液一定是酸 B、有机物都含有碳元素,所以含有碳元素的化合物一定是有机物 C、单质是由同种元素组成的,但同种元素组成的物质不一定是单质 D、复分解反应中有沉淀或气体或水生成,所以有上述物质生成的反应就是复分解反应11. 下列物质的溶液能使酚酞试液变红色的是( )A、Na2CO3 B、HCl C、NaCl D、CO2的水溶液12. 下列推理正确的是( )A、向某无色溶液中滴加酚酞试液无现象,则该溶液一定呈中性 B、酸雨一定呈酸性,pH小于7的雨水不一定是酸雨 C、在同一化合物中,金属元素显正价,则非金属元素一定显负价 D、酸碱中和反应生成盐和水,则生成盐和水的反应一定是中和反应13. 对下列实验过程的评价,正确的是( )A、某无色溶液中滴入酚酞试液变红色,该溶液不一定是碱溶液 B、将燃着的木条放入一瓶气体中熄灭,证明该气体是二氧化碳 C、检验氢气纯度时,将试管口移近火焰,有爆鸣声,表明氢气纯净 D、稀有气体制成的霓虹灯通电后可发出各种有色光,证明稀有气体通电后能发生化学反应14. 下列溶液或悬浊液中滴加无色酚酞试液一定变成淡红色的是( )A、稀盐酸 B、食盐水 C、氢氧化钠溶液 D、浓肥皂水15. 下列物质能使紫色石蕊试液变红的是( )A、Fe2O3 B、KOH C、NaCl D、H2SO4二、填空题
-
16.
小明在家中自制紫甘蓝汁,并测试其在酸性、中性、碱性条件下颜色(如图).他找到饮水机清洁剂(含盐酸)、食盐水、纯碱水、小苏打水和石灰水,开始了他的家庭实践活动.
资料:
物质
碳酸钠
碳酸氢钠
20℃溶解度/g
21.5
9.6
水溶液的pH
11
9
(1)纯碱的化学式为 .
(2)将紫甘蓝汁滴入溶液A中,紫甘蓝汁显红色,则A溶液是 .
(3)将B溶液滴入A中,无明显现象,由此得出的结论是 .
(4)将C溶液滴入D、E中,均有沉淀产生,该过程的反应之一是(用化学方程式表示) .
(5)为进一步区别D、E,小明试着向其溶液中分别通入CO2 , 观察到D中有沉淀产生,E中无明显现象,试推测D的成分并说明理由 .
 17.
17.如图所示装置的U形管左侧管内固定一支小试管.
(1)若右侧管内挂的是滴有酚酞试液的滤纸条,向小试管中滴加浓氨水,可观察到滤纸条的颜色变化是 ;
(2)若右侧管内挂的是紫色石蕊试液浸泡过的滤纸条,其中一条是湿润的,一条是干燥的.向装有碳酸钠粉末的小试管中滴加稀硫酸,写出小试管中发生反应的化学方程式: ;证明二氧化碳可与水反应的现象是 ;要让气球明显变瘪,可用针筒向U形管内注入足量的 溶液,反应的化学方程式: .
 18.
18.用熟石灰中和一定量的盐酸时,溶液的pH与加入的熟石灰质量的关系如图所示.当加入熟石灰mg时,溶液中的溶质为 .若改用ng氢氧化钠与相同量盐酸反应,所得溶液的pH 7.(填“>“、“<“或“=”).
 19. 在盛有氢氧化钠溶液的烧杯里滴入几滴酚酞溶液,溶液呈色,pH ;再用慢慢满加稀硫酸,同时用不断搅拌,直到溶液时,pH ,证明酸、碱正好完全反应,这个反应称为反应.20. 向盛有氢氧化钠溶液的烧杯中滴入几滴酚酞试液,试液变为色,此时溶液的pH ,向此溶液中逐滴加入稀盐酸,并不断振荡,直至溶液刚好无色时,溶液呈性,pH ;继续滴入稀盐酸,溶液呈色,pH ,在整个实验过程中,溶液发生了反应,化学方程式为 .
19. 在盛有氢氧化钠溶液的烧杯里滴入几滴酚酞溶液,溶液呈色,pH ;再用慢慢满加稀硫酸,同时用不断搅拌,直到溶液时,pH ,证明酸、碱正好完全反应,这个反应称为反应.20. 向盛有氢氧化钠溶液的烧杯中滴入几滴酚酞试液,试液变为色,此时溶液的pH ,向此溶液中逐滴加入稀盐酸,并不断振荡,直至溶液刚好无色时,溶液呈性,pH ;继续滴入稀盐酸,溶液呈色,pH ,在整个实验过程中,溶液发生了反应,化学方程式为 .三、探究题
-
21. 请回忆你和老师共同完成的酸和碱反应的实验探究,并按下列要求进行实验设计与分析:
【实验探究】
(1)、请你依据图设计一个酸和碱反应的探究实验:

实验步骤
实验现象
结论
①向烧杯中加入10mL氢氧化钠溶液,并滴入几滴酚酞试液
①溶液颜色;
酸和碱发生了中和反应
②再用滴管慢慢滴入稀硫酸,并不断搅拌溶液.
②不断搅拌溶液至溶液颜色变成色.
(2)、为探究上述酸、碱反应后硫酸是否过量,甲、乙、丙三位同学设计了以下方案:实验方案
实验步骤
实验现象
实验结论
甲同学的方案
取样,滴入适量的氯化钡溶液
出现白色沉淀
硫酸过量
乙同学的方案
取样,滴入几滴无色酚酞溶液
酚酞溶液不变色
酸、碱恰好完全反应
丙同学的方案
取样,滴入几滴紫色石蕊溶液
溶液变红
硫酸过量
【实验评价】
①设计的三个方案中,有一个正确的方案,是(填“甲”、“乙”、“丙”)同学的方案.
②请分析另外两个同学方案错误的原因:一个同学方案错误的原因是 .
【实验反思】探究硫酸和氢氧化钠反应后硫酸是否有剩余,还可选择一种试剂 .
22.将0.4%的氢氧化钠溶液滴加到2mL0.4%的盐酸中,测得混合液的pH变化曲线如图.某学习小组对加入0~VmL氢氧化钠过程中,所得混合液pH增大原因进行了如下探究:
 (1)、【猜想假设】
(1)、【猜想假设】猜想Ⅰ:pH增大是因为;
猜想Ⅱ:pH增大是因为发生了反应,写出反应方程式 .
(2)、【实验探究】为验证猜想Ⅱ,请你帮助该小组完成下列实验.(可供选择的实验用品有:pH计、0.4%的氢氧化钠溶液、0.4%的盐酸、水)
(1)向2mL0.4%的盐酸中加入VmL0.4%的氢氧化钠溶液,用pH计测得混合液的pH=7.
(2)向2mL0.4%的盐酸中加入VmL , 用pH计测得混合液的pH7(填“>”、“=”或“<”).
综合(1)和(2)证明猜想Ⅱ成立.
23.某校同学开展了如图所示“溶液酸碱性的检验”的实验活动:
 (1)、把自制的紫色紫薯汁按图1所示分别滴加到试管中,观察到的现象如表所示:
(1)、把自制的紫色紫薯汁按图1所示分别滴加到试管中,观察到的现象如表所示:溶液
白醋
盐酸
蔗糖水
草木灰水
石灰水
加入紫薯汁后的颜色
红色
红色
紫色
绿色
绿色
①图1中存放紫薯汁的仪器名称是;
②由表可知,紫薯汁能做酸碱指示剂,遇到稀硫酸溶液显示的颜色是.
(2)、用pH试纸测定图1中部分溶液的酸碱度:草木灰水pH>7,属于(填“酸性”、“中性”或“碱性”)溶液,白醋pH(填“>”、“<”或“=”)7(3)、图2是三位同学分别测定某溶液酸碱度的操作示意图,其中正确的是 (填“A”、“B”或“C”,下同),可能导致被测溶液的pH数值发生改变的错误操作是 .24.探究学习小组在制作“叶脉书签”时,需要将树叶放在质量分数为10%的氢氧化钠溶液中煮沸,如图1所示为该小组配制10%的氢氧化钠溶液的操作过程:
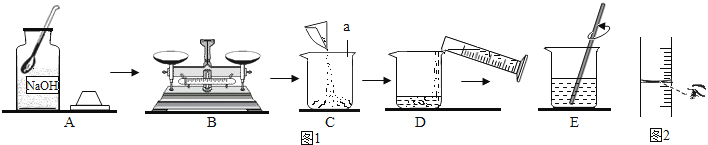 (1)、图1中仪器a的名称是 , 写出该仪器的另一种用途 .(2)、操作B中,必须将氢氧化钠固体放在里,并置于托盘天平盘(填“左”或“右”)进行称量.(3)、操作D中,用量筒量取所需体积的蒸馏水时还用到(填写仪器名称),某同学在读取量筒读数时的视线如图2所示,若其他操作正确,则会造成所配制氢氧化钠溶液的质量分数(填写“偏大”、“偏小”或“无影响”).(4)、如果不慎将氢氧化钠溶液沾到皮肤上,要先用大量水冲洗,再涂上 .(5)、制作“叶脉书签”结束后,刘强同学想继续测定废液的酸碱度,下列用品不需要的是 (填写字母标号).
(1)、图1中仪器a的名称是 , 写出该仪器的另一种用途 .(2)、操作B中,必须将氢氧化钠固体放在里,并置于托盘天平盘(填“左”或“右”)进行称量.(3)、操作D中,用量筒量取所需体积的蒸馏水时还用到(填写仪器名称),某同学在读取量筒读数时的视线如图2所示,若其他操作正确,则会造成所配制氢氧化钠溶液的质量分数(填写“偏大”、“偏小”或“无影响”).(4)、如果不慎将氢氧化钠溶液沾到皮肤上,要先用大量水冲洗,再涂上 .(5)、制作“叶脉书签”结束后,刘强同学想继续测定废液的酸碱度,下列用品不需要的是 (填写字母标号).a.玻璃棒 b.pH试纸 c.酚酞试液 d.白瓷板(或玻璃片)
25.某小组在学习“二氧化碳制取的研究”课题时,探究了二氧化碳气体的收集方法.
【查阅资料】
通常状况下,1体积水约能溶解1 体积二氧化碳,所得溶液pH约为5.6.
【提出问题】
二氧化碳能不能用排水法收集?
【实验设计与操作】
实验一、在通常状况下,测定二氧化碳溶液水所得溶液调查pH,判断二氧化碳在水中溶解度的体积.

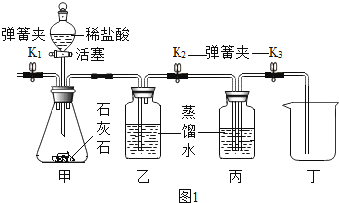 (1)、如图1甲装置中反应的化学方程式是 .(2)、实验时,需先将甲装置中的空气排尽.其操作是:开启弹簧夹 、关闭弹簧夹 ,打开活塞,滴加稀盐酸至空气排尽.检验空气已排尽的方法是 .(3)、关闭K1 , 打开K2 , K3 . 待丙装置中收集半瓶气体时,关闭活塞K2 和K3 , 充分振荡丙装置.然后用pH 计测得如下数据:
(1)、如图1甲装置中反应的化学方程式是 .(2)、实验时,需先将甲装置中的空气排尽.其操作是:开启弹簧夹 、关闭弹簧夹 ,打开活塞,滴加稀盐酸至空气排尽.检验空气已排尽的方法是 .(3)、关闭K1 , 打开K2 , K3 . 待丙装置中收集半瓶气体时,关闭活塞K2 和K3 , 充分振荡丙装置.然后用pH 计测得如下数据:物质
丁装置中溶液
丙装置中溶液
pH
6.50
5.60
分析可知,在丙和丁装置中所溶解二氧化碳的体积(填“大于”“小于”“等于”) 丙和丁装置中溶液的总体积.
(4)、实验中,乙装置的作用是 .若没有乙装置,则测出的溶液pH 会 .实验二:在通常状况下分别测定排空气法和排水法收集的气体中氧气的体积分数,从而得到二氧化碳的体积分数.
(5)、积分数都以21%计),则最终两种方法收集的气体中二氧化碳体积分数较大的是 (填“排空气”或“排水”)法,两种方法收集的气体中二氧化碳体积分数的差值是 .(6)、【结论与反思】由实验一、二分析,你认为二氧化碳 (填“能”或“不能”)用排水法收集,能减少二氧化碳在水中溶解度的措施是 (写一条即可).