浙教版科学八年级上册第一章第5节 物质的溶解同步练习
试卷更新日期:2016-04-20 类型:同步测试
一、单选题
-
1. 下列四个图象分别对应四个变化过程,其中正确的是( )A、服用胃舒平[主要成分Al(OH)3]治疗胃酸过多(胃液pH随时间变化图)
 B、向氢氧化钠和碳酸钠的混合溶液中加入稀盐酸溶液直至过量
B、向氢氧化钠和碳酸钠的混合溶液中加入稀盐酸溶液直至过量
 C、常温下,相同质量的锌和铁分别与足量的溶质质量分数相同的稀硫酸反应
C、常温下,相同质量的锌和铁分别与足量的溶质质量分数相同的稀硫酸反应
 D、将一定质量的硝酸钾不饱和溶液恒温蒸发水份,直至有少量晶体析出
D、将一定质量的硝酸钾不饱和溶液恒温蒸发水份,直至有少量晶体析出
 2. 为完全中和某一强酸溶液,需用10克溶质的质量分数为4%的NaOH溶液.如果改用10克溶质的质量分数为4%的KOH溶液,反应后,溶液的pH( )A、大于7 B、小于7 C、等于7 D、无法判断3. 下列图象关系合理的是( )
2. 为完全中和某一强酸溶液,需用10克溶质的质量分数为4%的NaOH溶液.如果改用10克溶质的质量分数为4%的KOH溶液,反应后,溶液的pH( )A、大于7 B、小于7 C、等于7 D、无法判断3. 下列图象关系合理的是( )
A、向pH=10的NaOH溶液中不断加入稀盐酸
B、用木炭还原氧化铜
B、用木炭还原氧化铜
C、镁在氧气中燃烧
C、镁在氧气中燃烧
D、从冰箱里拿出汽水打开瓶盖后有大量气泡冒出
D、从冰箱里拿出汽水打开瓶盖后有大量气泡冒出
4. 推理是一种重要的学习方法.下列推理中正确的是( )
4. 推理是一种重要的学习方法.下列推理中正确的是( )
A、酸和碱发生中和反应生成盐和水,则生成盐和水的化学反应一定是中和反应 B、酸性溶液能使紫色石蕊溶液变红,则能使紫色石蕊溶液变红的一定是酸性溶液 C、饱和溶液不能继续溶解某种溶质.则其它物质也不能继续溶解在该饱和溶液中 D、同种分子构成的物质一定是纯静物,则纯净物一定都是由同种分子构成的5. “节能减排,我有责任”.下列实验操作不符合节约原则的是( )A、甲同学做完金属与酸的反应实验后,把多余的金属回收 B、乙同学配制50g5%的氯化钠溶液,把配好的溶液装入试剂瓶中 C、丙同学用氯酸钾和二氧化锰制氧气时,先点燃酒精灯,再去组装仪器 D、丁同学用废弃的包装药物胶囊的铝塑板凹槽替代试管,进行酸、碱溶液与指示剂反应的实验6. 有人设计下列实验步骤,用氯化钠固体配制50g5%氯化钠溶液,其中不必要的是( )A、计算:确定所需要的氯化钠和水的质量 B、称量:按计算结果称取氯化钠的质量,量取水的体积 C、溶解:将称量好的氯化钠溶解于所量取的水中 D、验算:计算所配制溶液的质量分数7. 用氯化钠固体配制一定质量分数的氯化钠溶液,不需要用到的仪器是( )A、托盘天平 B、烧杯
B、烧杯 C、蒸发皿
C、蒸发皿  D、量筒
D、量筒 8.
8.用如图的浓盐酸配制一定质量20%稀盐酸,实验时不需要的仪器是( )
 A、胶头滴管 B、量筒 C、烧杯 D、电子天平9.
A、胶头滴管 B、量筒 C、烧杯 D、电子天平9.制作“叶脉书签”时需要配制100g10%的氢氧化钠溶液.下列说法中,不正确的是( )
 A、配制时需要氢氧化钠质量为10g B、溶解固体氢氧化钠时放出大量的热 C、配制时所需实验仪器有铁架台、量筒、托盘天平、烧杯、酒精灯 D、若用20%的氢氧化钠溶液和水配制,需要20%的氢氧化钠溶液50g10. 在配置50g 10%的氯化钠溶液时,下列情况可能导致溶液中氯化钠质量分数小于10%的是( )
A、配制时需要氢氧化钠质量为10g B、溶解固体氢氧化钠时放出大量的热 C、配制时所需实验仪器有铁架台、量筒、托盘天平、烧杯、酒精灯 D、若用20%的氢氧化钠溶液和水配制,需要20%的氢氧化钠溶液50g10. 在配置50g 10%的氯化钠溶液时,下列情况可能导致溶液中氯化钠质量分数小于10%的是( )①用量筒量取水时俯视读数;②配制溶液的烧杯用少量蒸馏水润洗;③在托盘天平的左盘放砝码右盘放氯化钠;④将水倒入烧杯时,有少量水溅出;⑤溶解时,用玻璃棒搅拌过快,使少量溶液溅出.
A、①②③④⑤ B、只有②③ C、只有①②③ D、只有②③⑤11. 实验室配制50g质量分数为6%的氯化钠溶液,下列描述不正确的是( )、A、计算需氯化钠3g、水47g B、将氯化钠固体放于纸上称量 C、将氯化钠固体放入量筒中溶解 D、将配好的氯化钠溶液装瓶并贴好标签12. 某实验小组欲配制一定溶质质量分数的NaOH溶液.进行的下面操作中,造成所得溶液溶质质量分数偏小的是( )A、选用空气中久置的NaOH固体 B、称取NaOH时,天平指针略向左倾斜 C、量取水时,俯视量筒刻度读取数据 D、转移配得溶液时,少量溶液洒落瓶外13. 配制100克10%的氯化钠溶液,下列仪器选用不当的是( )A、10mL量筒 B、电子天平 C、玻璃棒 D、烧杯14. 下列说法不正确的是( )A、配制5%的硝酸钾溶液的一般步骤依次是计算、称量和溶解 B、氢氧化钠溶液要密封保存,因为其会与空气中的二氧化碳反应 C、消除路面上的积雪可以撒些粗盐,这样可以使雪较快的溶解 D、粗盐提纯实验中,蒸发结晶时一定要在滤液蒸干时再停止加热15. 现配制溶质质量分数为5%的NaCl溶液100g,下列操作错误的图示是( )A、取用氯化钠固体 B、量取蒸馏水
B、量取蒸馏水 C、氯化钠溶解
C、氯化钠溶解  D、溶液装瓶贴签
D、溶液装瓶贴签
二、填空题
-
16.
下图是小梅配制100g溶质质量分数为12%的NaCl溶液的实验操作示意图:

(1)计算:需要NaCl的质量为 g,需要水的体积为 mL.
(2)上图中的玻璃仪器分别是广口瓶、量筒、 、 .
(3)指出图中的一处错误操作 .
(4)配制时应选择 mL(10mL或50mL或100mL)的量筒量取所需要的水.用上述图示的序号表示配制溶液的操作顺序 .
17.实验室一瓶新购进的浓硫酸,其标签的部分内容如图所示.
(1)若该瓶硫酸还没有开封使用,瓶内溶液的质量为 g.
(2)若要配制9.8%的稀硫酸400g,则需用该浓硫酸 mL(计算结果保留至0.1).
(3)配制稀硫酸的过程中,除了用到量筒、胶头滴管、烧杯外,还需要用到的仪器可能有 .
(4)若量取浓硫酸时采用仰视的方法,则配制的溶液溶质质量分数 9.8%(填“>”、“=”或“<”).
(5)若取该9.8%的稀硫酸100g与足量的镁充分反应后,所得溶液的质量为 g.
 18. 某实验需要稀释98%的浓硫酸,一同学用100mL的量筒量取了5mL浓硫酸,就准备在量筒里加水稀释,老师见了见了马上制止了同学的实验.请指出上述已完成的和未完成的实验操作中:
18. 某实验需要稀释98%的浓硫酸,一同学用100mL的量筒量取了5mL浓硫酸,就准备在量筒里加水稀释,老师见了见了马上制止了同学的实验.请指出上述已完成的和未完成的实验操作中:存在的错误有 ; ; .
19. 在配制10%NaCl水溶液的实验中,称取的NaCl固体应放在托盘天平的 盘中,若最终所得的NaCl溶液的溶质质量分数小于10%,则可能出现的情况之一是 .20. 要配制30%稀硝酸500mL(密度是1.18g/cm3),需要质量分数为65%的浓硝酸(密度为1.4g/cm3) mL(保留到小数点后一位).配制过程中不需要使用天平,但必须要使用的玻璃仪器有(至少两种).三、探究题
-
21.
请你和同学们一起完成下列实验.
 (1)、用浓盐酸(溶质质量分数为37%,密度为1.18g/mL)配制200g 10%的稀盐酸.
(1)、用浓盐酸(溶质质量分数为37%,密度为1.18g/mL)配制200g 10%的稀盐酸.①配制的主要步骤为:计算、、溶解.
②设需浓盐酸的体积为V,请列出V的计算式 (不必算出结果).
③现提供甲图仪器,仪器a的名称为;配制过程中还需要的仪器有 .
(2)、现提供乙图装置.①实验室制取CO2 , 发生和收集装置应选用 (填序号),发生反应的化学方程式为 .实验结束,从反应残留物中提取固体溶质时,按如丙图流程操作.此流程中,操作Ⅰ的名称是 , 操作Ⅱ的名称是 .
②如选用另一发生装置制取某种气体,发生反应的化学方程式为 .
22. 某化学社团的同学发现,不同物质的变化常伴随着相同的实验现象,但从化学的角度去研究,会发现其有本质的区别.(1)、【现象分析】实验一:向盛有一定量氢氧化钠固体的试管里加入一定量的水,迅速用带导管的橡皮塞塞紧试管口,并将导管另一端通入盛有水的试管中,振荡左侧试管(如图).
实验二:用氧化钙代替氢氧化钠重复一次上述实验.
上述两个实验的相同现象之一是 ;
上述两个实验中,其中一个实验发生了化学变化,其化学方程式是 ;
另一个实验没有发生化学变化.
(2)、【本质归纳】
相同的实验现象,既可以由物理变化引起,也可以由化学变化引起.
【探究运用】
在探究白色粉末的组成时,要研究相同实验现象的本质区别.
实验三:有一包白色粉末可能含有硫酸钡、碳酸钾和氢氧化钡中的一种或几种,取一定量该粉末加入到盛有足量水的烧杯中,搅拌、静置,观察到烧杯中有白色不溶物.
小明同学认为,白色粉末中一定含有硫酸钡;
小意同学认为,小明的结论不准确,其理由可用化学方程式表示为 .
针对上述两位同学的观点,小燕同学进一步设计如下实验方案进行探究:

(1)步骤②中发生化学反应的方程式是 .
(2)步骤③中,加入酚酞溶液后,若溶液E为无色,则原白色粉末的组成是 (填化学式,下同);
步骤③中加入酚酞溶液后,若溶液E为红色,则滤液A中一定含有的溶质是 ,原白色粉末的可能组成是 ;
(3)小鹏同学认为,只需取少量滤渣B,加入过量的稀硝酸,若看到的现象是 ,就足以说明原白色粉末中只含有碳酸钾和氢氧化钡.
 23.
23.如图是实验室常用气体制备装置,据图回答问题:
 (1)、实验室用高锰酸钾制氧气的化学方程式是 ,应选择的收集装置是 (填字母代号),如果选用如图2装置收集氧气,气体应从 (填“a”或“b”)端导入.(2)、实验室用过氧化氢溶液和二氧化锰制取氧气的化学方程式为 .某化学小组同学用20%的过氧化氢溶液和二氧化锰,并选用B装置来制氧气.实验中,同学们发现不能得到平稳的氧气流.大家提出从两个方面加以改进:
(1)、实验室用高锰酸钾制氧气的化学方程式是 ,应选择的收集装置是 (填字母代号),如果选用如图2装置收集氧气,气体应从 (填“a”或“b”)端导入.(2)、实验室用过氧化氢溶液和二氧化锰制取氧气的化学方程式为 .某化学小组同学用20%的过氧化氢溶液和二氧化锰,并选用B装置来制氧气.实验中,同学们发现不能得到平稳的氧气流.大家提出从两个方面加以改进:一是把发生装置由B改为C,其理由是 ;
二是将过氧化氢溶液加水稀释,溶液的稀释须要经过计算,量取,搅匀三个步骤.
如果把50g质量分数为20%的过氧化氢溶液稀释成5%的过氧化氢溶液,需加水的质量为 g;在稀释过程中,除了烧杯外,还需要用到的仪器有 (填数字序号).
①量筒 ②药匙 ③试管 ④酒精灯 ⑤滴管 ⑥玻璃棒.
24.探究学习小组在制作“叶脉书签”时,需要将树叶放在质量分数为10%的氢氧化钠溶液中煮沸,如图1所示为该小组配制10%的氢氧化钠溶液的操作过程:
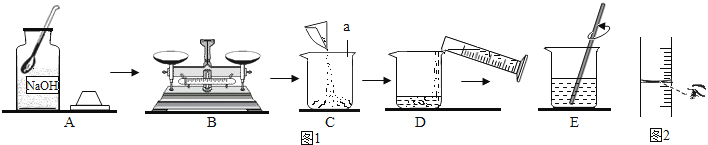 (1)、图1中仪器a的名称是 , 写出该仪器的另一种用途 .(2)、操作B中,必须将氢氧化钠固体放在里,并置于托盘天平盘(填“左”或“右”)进行称量.(3)、操作D中,用量筒量取所需体积的蒸馏水时还用到(填写仪器名称),某同学在读取量筒读数时的视线如图2所示,若其他操作正确,则会造成所配制氢氧化钠溶液的质量分数(填写“偏大”、“偏小”或“无影响”).(4)、如果不慎将氢氧化钠溶液沾到皮肤上,要先用大量水冲洗,再涂上 .(5)、制作“叶脉书签”结束后,刘强同学想继续测定废液的酸碱度,下列用品不需要的是 (填写字母标号).
(1)、图1中仪器a的名称是 , 写出该仪器的另一种用途 .(2)、操作B中,必须将氢氧化钠固体放在里,并置于托盘天平盘(填“左”或“右”)进行称量.(3)、操作D中,用量筒量取所需体积的蒸馏水时还用到(填写仪器名称),某同学在读取量筒读数时的视线如图2所示,若其他操作正确,则会造成所配制氢氧化钠溶液的质量分数(填写“偏大”、“偏小”或“无影响”).(4)、如果不慎将氢氧化钠溶液沾到皮肤上,要先用大量水冲洗,再涂上 .(5)、制作“叶脉书签”结束后,刘强同学想继续测定废液的酸碱度,下列用品不需要的是 (填写字母标号).a.玻璃棒 b.pH试纸 c.酚酞试液 d.白瓷板(或玻璃片)
四、材料分析题
-
25.
探究氢氧化钠溶于水后液体温度的变化的实验如下表所示.请回答问题:
 (1)、使用氢氧化钠固体时必须注意安全,其原因是 。(2)、图示中的操作存在一处错误,应改正为 。(3)、图示中的错误操作改正后,上述实验能否测得氢氧化钠溶解前后液体温度的改变,为什么? 。
(1)、使用氢氧化钠固体时必须注意安全,其原因是 。(2)、图示中的操作存在一处错误,应改正为 。(3)、图示中的错误操作改正后,上述实验能否测得氢氧化钠溶解前后液体温度的改变,为什么? 。