备考2020年高考化学二轮专题 15 无机物的转化鉴别
试卷更新日期:2020-04-08 类型:二轮复习
一、单选题
-
1. a、b、c、d是HCl、BaCl2、AgNO3、Na2CO3四种溶液中的一种,现将它们两两混合,现象如下表所示:
反应物
a+b
a+c
b+c
c+d
b+d
现象
白色沉淀
白色沉淀
白色沉淀
白色沉淀
无色气体
由上述现象可推知a、b、c、d依次是( )
A、HCl、BaCl2、AgNO3、Na2CO3 B、AgNO3、HCl、Na2CO3、BaCl2 C、BaCl2、Na2CO3、AgNO3、HCl D、AgNO3、HCl、BaCl2、Na2CO32. 短周期主族元素W、X、Y、Z的原子序数依次增大,W的简单氢化物可用作制冷剂,Y的原子半径是所有短周期主族元素中最大的。由X、Y和Z三种元素形成的一种盐溶于水后,加入稀盐酸,有黄色沉淀析出,同时有刺激性气体产生。下列说法正确的是( )A、原子半径:Y>Z>X>W B、简单氢化物的热稳定性:W>X>Z C、Y、Z形成的化合物溶于水会促进水的电离 D、上述刺激性气体通入紫色石蕊溶液,溶液先变红后褪色3. 下列物质提纯的方法正确的是( )A、除去混在NO2中的NO:将气体与足量O2混合 B、除去Cl2中的HCl:将混合气体通入装有饱和NaOH溶液的洗气瓶 C、除去KCl溶液中的K2CO3:加入过量BaCl2溶液后过滤 D、除去混在CO2中的SO2:将气体依次通过足量酸性KMO4溶液和浓硫酸4. 下列物质的转化在给定条件下能实现的是( )①盐卤(含MgCl2) Mg(OH)2 MgCl2溶液 无水MgCl2
②铝土矿 AlO2- Al(OH)3 Al2O3
③NH3 NO NO2 HNO3
④NaCl溶液 Cl2 无水FeCl2
⑤S SO3 H2SO4
⑥SiO2 Na2SiO3溶液 H2SiO3
A、③⑥ B、③⑤⑥ C、①④⑤ D、①③⑥5. 下表所列各组物质中,物质之间通过一步反应不能实砚如下图所示转化的是( )选项
X
Y
Z
A
Na
NaOH
NaCl
B
Si
SiO2
Na2SiO3
C
Cl2
HClO
NaClO
D
NO
NO2
HNO3
 A、A B、B C、C D、D6. 一定条件下A、B、C有如图所示的转化关系,且△H=△H1+△H2符合上述转化关系的A、C可能是( )
A、A B、B C、C D、D6. 一定条件下A、B、C有如图所示的转化关系,且△H=△H1+△H2符合上述转化关系的A、C可能是( )①Fe、FeCl3 ②C、CO2 ③AlCl3、NaAlO2 ④NaOH、NaHCO3 ⑤S、SO3 ⑥Na2CO3、CO2
 A、只有②③④⑥ B、除①外 C、除⑤外 D、全部7. 在给定条件下,下列选项所示的物质间转化均能实现的是( )A、 B、 C、 D、
A、只有②③④⑥ B、除①外 C、除⑤外 D、全部7. 在给定条件下,下列选项所示的物质间转化均能实现的是( )A、 B、 C、 D、二、综合题
-
8. 探究无机盐X(仅含三种短周期元素)的组成和性质,设计并完成如下实验:

请回答:
(1)、X的化学式是。(2)、白色粉末溶于氢氧化钠溶液的离子方程式是。(3)、高温条件下白色粉末与焦炭发生置换反应,写出该反应的化学方程式。9. 氮元素的单质和常见的化合物在工、农业生产中用途广泛。(1)、工业上利用分离空气的方法得到氮气.空气各主要成分的沸点如下:N2
O2
Ar
CO2
-196℃
-183℃
-186℃
-78℃
现将空气深度冷却液化,然后缓慢升温,则最先分离出来的气体是。
(2)、雷雨时空气中的N2转化为NO,生成物NO是色的气体,(填“易”或“难”)溶于水;NO在空气中很容易被氧化成NO2 , NO2能与水发生化学反应.NO2与水反应的化学方程式为。(3)、实验室可用固体NH4Cl与固体Ca(OH)2加热反应制取氨气。①制取氨气的化学方程式为;
②要制取标准状况下4.48L的氨气,至少需要称取固体NH4Cl的质量为g。
(4)、已知:4NH3+6NO = 5N2+6H2O 化学研究性学习小组的同学在技术人员的指导下,按下列流程,探究不同催化剂对NH3还原NO反应的催化性能。
若控制其他实验条件均相同,在催化反应器中装载不同的催化剂,将经催化反应后的混合气体,通过一定体积滴有酚酞的稀硫酸溶液(溶液的体积、浓度均相同)。
①NH3与稀硫酸溶液反应的离子方程式为;
②为了比较不同催化剂的催化性能,需要测量并记录的数据是。10. 有一包白色固体粉末,其中可能含有KCl、BaCl2、Cu(NO3)2、K2CO3中的一种或几种,现做以下实验:①将部分粉末加入水中,振荡,有白色沉淀生成,过滤,溶液呈无色:
②向①的沉淀物中加入足量稀硝酸,固体完全溶解,并有气泡产生;
③取少量②的溶液,滴入稀硫酸,有白色沉淀产生;
④另取①中过滤后的溶液加入足量AgNO3溶液,产生白色沉淀。
试根据上述实验事实,回答下列问题:
(1)、写出原白色粉末中一定含有的物质的化学式(2)、写出原白色粉末中一定不含有的物质的电离方程式(3)、写出下列各步变化的离子方程式:②
④
11. 有一包白色固体粉末,其中可能含有NaCl、Ba(NO3)2、CuSO4、Na2CO3中的一种或几种,现做以下实验:①取少量白色固体粉末于烧杯中,加水搅拌,有白色不溶物,过滤,滤液呈无色透明状。
②取①的白色不溶物少量于试管中,加入足量稀硝酸,固体完全溶解,并有无色气泡产生。
③取②所得的溶液2 mL于试管中,滴入几滴稀硫酸,有白色沉淀产生。
④另取①得到的无色透明溶液少量于试管中,加入足量AgNO3溶液,产生白色沉淀。
根据上述实验事实,回答下列问题:
(1)、原白色粉末中一定含有的物质是 , 一定不含有的物质是 , 可能含有的物质是。(写化学式)(2)、写出各步变化的离子方程式。①;
②;
③;
④。
12. 实验室用氧化锌矿粉(主要含ZnO、FeCO3、CuO等)制备碱式碳酸锌[Zn2(OH)2CO3],并将其用于合成氨工艺脱硫研究。 (1)、“酸浸”时保持H2SO4过量的目的是。(2)、已知:Mn2+开始沉淀的pH=8.1。
(1)、“酸浸”时保持H2SO4过量的目的是。(2)、已知:Mn2+开始沉淀的pH=8.1。①写出加入KMnO4溶液除铁的离子方程式:。
②流程中调节pH=5.4所加试剂X为(填化学式);试剂X、KMnO4溶液加入顺序能否互换?请判断并说明理由。
(3)、上述流程中滤渣的成分为(写化学式);“滤液”可以用作化肥,该滤液的主要成分为(填化学式)。(4)、检验Zn2(OH)2CO3是否洗涤干净的方法是。(5)、合成氨原料气脱硫原理如图,碱式碳酸锌吸收硫化氢的化学方程式为。
三、推断题
-
13. 已知A是一种常见金属,部分反应物或生成物已略去。试根据图中转化关系,回答下列问题。
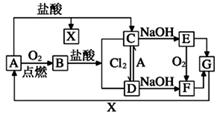 (1)、B的俗名为。(2)、保存C溶液时需加入少量A的原因是 , A与水蒸气反应的化学方程式为 , 该反应类型属于(填基本反应类型)(3)、E生成F可观察到的现象 , 化学方程式为。(4)、写出B→C化学方程式为 , C→D的离子方程式为。14. 有关物质的转化关系如下图所示(部分物质和条件已略去)。B、C、E是常见气体;A、Ⅹ、Y是常见金属单质,其中Y既能与强酸反应,又能与强碱反应;G的焰色反应显黄色;I的溶液呈黄色。
(1)、B的俗名为。(2)、保存C溶液时需加入少量A的原因是 , A与水蒸气反应的化学方程式为 , 该反应类型属于(填基本反应类型)(3)、E生成F可观察到的现象 , 化学方程式为。(4)、写出B→C化学方程式为 , C→D的离子方程式为。14. 有关物质的转化关系如下图所示(部分物质和条件已略去)。B、C、E是常见气体;A、Ⅹ、Y是常见金属单质,其中Y既能与强酸反应,又能与强碱反应;G的焰色反应显黄色;I的溶液呈黄色。
请回答下列问题:
(1)、A的原子结构示意图为;(2)、写出气体C的一种用途;(3)、Y和D溶液反应的离子方程式为;(4)、实验室检验Ⅰ中所含的金属阳离子的试剂是(填化学式);(5)、Ⅰ溶液常用于腐蚀印刷电路铜板,请写出相关的离子方程式。15. 已知A为淡黄色固体,R是地壳中含量最多的金属元素的单质,T为生活中使用最广泛的金属单质,D是具有磁性的黑色晶体,C、F是无色无味的气体,H是白色沉淀,W溶液中滴加KSCN溶液出现血红色。 (1)、物质A的化学式为 , F化学式为;(2)、B和R在溶液中反应生成F的离子方程式为;(3)、H在潮湿空气中变成M的实验现象是 , 化学方程式为。(4)、A和水反应生成B和C的离子方程式为 , 由此反应可知A有作为的用途。(5)、M投入盐酸中的离子方程式。
(1)、物质A的化学式为 , F化学式为;(2)、B和R在溶液中反应生成F的离子方程式为;(3)、H在潮湿空气中变成M的实验现象是 , 化学方程式为。(4)、A和水反应生成B和C的离子方程式为 , 由此反应可知A有作为的用途。(5)、M投入盐酸中的离子方程式。