备考2020年高考化学二轮专题 12 物质结构与性质
试卷更新日期:2020-04-08 类型:二轮复习
一、单选题
-
1. 下列变化过程中无化学键断裂或生成的是( )A、石墨转化为金刚石 B、NaCl晶体溶于水 C、干冰升华 D、氮的固定2. 下列化学用语书写正确的是( )A、过氧化钠的电子式是
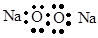 B、乙烷的结构式是
B、乙烷的结构式是 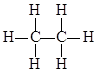 C、氯原子的结构示意图是
C、氯原子的结构示意图是  D、中子数为7的碳原子是
D、中子数为7的碳原子是 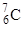 3. 下列物质含有离子键的是( )A、CO2 B、N2 C、KCl D、H2O4. X、Y、Z和R分别代表四种元素。若aXm+、bYn+、cZn-、dRm-四种离子的核外电子排布相同,且m>n , 则下列关系正确的是( )A、a-c=m-n B、b-d=m+n C、a>b>d>c D、a<b<c<d5. 下列表示不正确的是( )A、次氯酸的电子式
3. 下列物质含有离子键的是( )A、CO2 B、N2 C、KCl D、H2O4. X、Y、Z和R分别代表四种元素。若aXm+、bYn+、cZn-、dRm-四种离子的核外电子排布相同,且m>n , 则下列关系正确的是( )A、a-c=m-n B、b-d=m+n C、a>b>d>c D、a<b<c<d5. 下列表示不正确的是( )A、次氯酸的电子式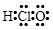 B、丁烷的球棍模型
B、丁烷的球棍模型 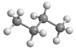 C、乙烯的结构简式CH2=CH2
D、原子核内有8个中子的碳原子C
6. 下列说法不正确的是( )A、纯碱和烧碱熔化时克服的化学键类型相同 B、加热蒸发氯化钾水溶液的过程中有分子间作用力的破坏 C、CO2溶于水和干冰升华都只有分子间作用力改变 D、石墨转化为金刚石既有共价键的断裂和生成,也有分子间作用力的破坏7. 下列说法不正确的是( )A、含有离子键和共价键的化合物一定是离子化合物 B、Na投入到水中,有共价键的断裂与形成 C、液态水转变为气态水需要吸热,说明旧键断裂吸收的能量大于新键形成放出的能量 D、N2和NCl3两种分子中,每个原子的最外层都具有8电子稳定结构8. Co是γ放射源,可用于农作物诱变育种。 Co原子的核内中子数为( )A、60 B、33 C、87 D、279. 下列说法错误的是( )A、CO2溶于水的过程中既有共价键的断裂,也有共价键的生成 B、在SF2、PCl5、CCl4的分子中,所有原子均达到了8电子稳定结构 C、H2NCH2COOH和CH3CH2NO2熔化时克服的微粒间作用力不同,导致熔点相差较大 D、N2比O2分子稳定,与分子间作用力无关10. 下列五种烃①2-甲基丁烷 ②2,2-二甲基丙烷 ③戊烷 ④丙烷 ⑤丁烷,按沸点由高到低的顺序排列的是( )A、①>②>③>④>⑤ B、②>③>⑤>④>① C、③>①>②>⑤>④ D、④>⑤>②>①>③
C、乙烯的结构简式CH2=CH2
D、原子核内有8个中子的碳原子C
6. 下列说法不正确的是( )A、纯碱和烧碱熔化时克服的化学键类型相同 B、加热蒸发氯化钾水溶液的过程中有分子间作用力的破坏 C、CO2溶于水和干冰升华都只有分子间作用力改变 D、石墨转化为金刚石既有共价键的断裂和生成,也有分子间作用力的破坏7. 下列说法不正确的是( )A、含有离子键和共价键的化合物一定是离子化合物 B、Na投入到水中,有共价键的断裂与形成 C、液态水转变为气态水需要吸热,说明旧键断裂吸收的能量大于新键形成放出的能量 D、N2和NCl3两种分子中,每个原子的最外层都具有8电子稳定结构8. Co是γ放射源,可用于农作物诱变育种。 Co原子的核内中子数为( )A、60 B、33 C、87 D、279. 下列说法错误的是( )A、CO2溶于水的过程中既有共价键的断裂,也有共价键的生成 B、在SF2、PCl5、CCl4的分子中,所有原子均达到了8电子稳定结构 C、H2NCH2COOH和CH3CH2NO2熔化时克服的微粒间作用力不同,导致熔点相差较大 D、N2比O2分子稳定,与分子间作用力无关10. 下列五种烃①2-甲基丁烷 ②2,2-二甲基丙烷 ③戊烷 ④丙烷 ⑤丁烷,按沸点由高到低的顺序排列的是( )A、①>②>③>④>⑤ B、②>③>⑤>④>① C、③>①>②>⑤>④ D、④>⑤>②>①>③二、综合题
-
11. 祖母绿被称为绿宝石之王,是国际珠宝世界公认的四大名贵宝石之一,其化学式为Be3Al2Si6O18。回答下列问题:(1)、基态Be原子的电子排布图为 , 基态Al原子核外电子占据个轨道,其中能量最高能级的原子轨道的形状为。(2)、Al、Si、O的第一电离能由大到小的排序为。(3)、SO3分子中硫原子的杂化类型是 , SO3分子的空间构型是。(4)、工业上,电解制取金属铝,不能用熔融的AlCl3 , AlCl3的晶体类型是 , 将Be3Al2Si6O18写为氧化物的式子是。(5)、LiAlH4在有机合成中可将羧基还原成羟基。甲酸和乙醇的熔、沸点如图所示:

1mol甲酸分子中σ键与π键的比值为 , 甲酸和乙醇的熔点相差较大的主要原因是。
 (6)、碳化硅的晶体类型类似金刚石,晶胞结构如图所示。已知:碳化硅的晶体密度为ag/cm3 , NA代表阿伏加德罗常数的数值。该晶胞边长为pm。12. X、Y、Z、W是元素周期表中前四周期中的四种元素,其中X的原子中不存在中子,Y原子的最外层电子数是其内层电子数的2倍,Z原子基态时2p原子轨道上有3个未成对的电子,W的原子序数为29。请回答下列问题:(1)、写出Y原子基态时的价电子排布式:。(2)、X和Y可以形成Y2X4分子,1个Y2X4分子中含有σ键的数目为 , 其中Y原子的杂化轨道类型为。(3)、元素Y的一种氧化物与元素Z的一种氧化物互为等电子体,则元素Z的这种氧化物的分子式是
(6)、碳化硅的晶体类型类似金刚石,晶胞结构如图所示。已知:碳化硅的晶体密度为ag/cm3 , NA代表阿伏加德罗常数的数值。该晶胞边长为pm。12. X、Y、Z、W是元素周期表中前四周期中的四种元素,其中X的原子中不存在中子,Y原子的最外层电子数是其内层电子数的2倍,Z原子基态时2p原子轨道上有3个未成对的电子,W的原子序数为29。请回答下列问题:(1)、写出Y原子基态时的价电子排布式:。(2)、X和Y可以形成Y2X4分子,1个Y2X4分子中含有σ键的数目为 , 其中Y原子的杂化轨道类型为。(3)、元素Y的一种氧化物与元素Z的一种氧化物互为等电子体,则元素Z的这种氧化物的分子式是 (4)、图2表示某种含Z有机化合物的结构,其分子内4个Z原子分别位于正四面体的4个顶点(见图3),分子内存在空腔,能嵌入某离子或分子并形成4个氢键予以识别。
(4)、图2表示某种含Z有机化合物的结构,其分子内4个Z原子分别位于正四面体的4个顶点(见图3),分子内存在空腔,能嵌入某离子或分子并形成4个氢键予以识别。下列分子或离子中,能被该有机化合物识别的是_________(填标号)。
A、CF4 B、CH4 C、NH4+ D、H2O(5)、元素W的一种氯化物晶体的晶胞结构如图4所示,该氯化物的化学式是。已知其晶胞边长为anm,则其晶体密度为 (列出算式即可)。该氯化物可与浓盐酸发生非氧化还原反应,生成配合物HnWCl3 , 则反应的化学方程式为 (6)、元素金(Au)与W形成的一种合金晶体具有立方最密堆积的结构,在晶胞中W原子处于面心,Au原子处于顶点位置。该晶体中原子之间的作用力是;该晶体具有储氢功能,氢原子可进入到由W原子与Au原子构成的四面体空隙中。若将W原子与Au原子等同看待,该晶体储氢后的晶胞结构与CaF2的结构相似,该晶体储氢后的化学式应为
(6)、元素金(Au)与W形成的一种合金晶体具有立方最密堆积的结构,在晶胞中W原子处于面心,Au原子处于顶点位置。该晶体中原子之间的作用力是;该晶体具有储氢功能,氢原子可进入到由W原子与Au原子构成的四面体空隙中。若将W原子与Au原子等同看待,该晶体储氢后的晶胞结构与CaF2的结构相似,该晶体储氢后的化学式应为 13. 微量元素硼对植物生长及人体健康有着十分重要的作用,也广泛应用于新型材料的制备。(1)、基态硼原子的价电子轨道表达式是。与硼处于同周期且相邻的两种元素和硼的第一电离能由大到小的顺序为。(2)、晶体硼单质的基本结构单元为正二十面体,其能自发地呈现多面体外形,这种性质称为晶体的。(3)、B的简单氢化物BH3不能游离存在,常倾向于形成较稳定的B2H6或与其他分子结合。
13. 微量元素硼对植物生长及人体健康有着十分重要的作用,也广泛应用于新型材料的制备。(1)、基态硼原子的价电子轨道表达式是。与硼处于同周期且相邻的两种元素和硼的第一电离能由大到小的顺序为。(2)、晶体硼单质的基本结构单元为正二十面体,其能自发地呈现多面体外形,这种性质称为晶体的。(3)、B的简单氢化物BH3不能游离存在,常倾向于形成较稳定的B2H6或与其他分子结合。
①B2H6分子结构如图,则B原子的杂化方式为
②氨硼烷(NH3BH3)被认为是最具潜力的新型储氢材料之一,分子中存在配位键,提供孤电子对的成键原子是 , 写出一种与氨硼烷互为等电子体的分子(填化学式)。
(4)、以硼酸(H3BO3)为原料可制得硼氢化钠(NaBH4),它是有机合成中的重要还原剂。BH4-的立体构型为。(5)、磷化硼(BP)是受高度关注的耐磨材料,可作为金属表面的保护层,其结构与金刚石类似,晶胞结构如图所示。
磷化硼晶胞沿z轴在平面的投影图中,B原子构成的几何形状是。
14. 黄铜矿是主要的炼铜原料,CuFeS2是其中铜的主要存在形式。回答下列问题:(1)、CuFeS2中存在的化学键类型是。其组成的三种元素中电负性较强的是 。(2)、下列基态原子或离子的价层电子排布图正确的。 (3)、在较低温度下CuFeS2与浓硫酸作用时,有少量臭鸡蛋气味的气体X产生。
(3)、在较低温度下CuFeS2与浓硫酸作用时,有少量臭鸡蛋气味的气体X产生。①X分子的立体构型是 , 中心原子杂化类型为 , 属于(填“极性”或“非极性”)分子。
②X的沸点比水低的主要原因是。
(4)、CuFeS2与氧气反应生成SO2 , 其结构式为 ,则SO2中共价键类型有。 (5)、四方晶系CuFeS2晶胞结构如图所示。
,则SO2中共价键类型有。 (5)、四方晶系CuFeS2晶胞结构如图所示。
①Cu+的配位数为 ,
②已知:a=b=0.524 nm,c=1.032 nm,NA为阿伏加德罗常数的值,CuFeS2晶体的密度是g•cm3(列出计算式)。