备考2020年高考化学二轮专题 11 水溶液中的离子平衡
试卷更新日期:2020-04-08 类型:二轮复习
一、单选题
-
1. 下列应用与盐类的水解无关的是( )A、热的纯碱溶液可去除油污 B、FeCl3饱和溶液滴入沸水中制Fe(OH)3胶体 C、TiCl4溶于大量水加热制备TiO2 D、NaCl可用作防腐剂和调味剂2. 在下列溶液中,BaSO4的溶解度最大的是( )A、1mol/LH2SO4溶液 B、2mol/LNa2SO4溶液 C、0.1mol/ L BaCl2溶液 D、纯水3. 某温度下,水的离子积KW=10-13 , 关于该温度下水电离的说法正确的是( )A、pH=2的盐酸与pH=12的NaOH溶液中水电离出的H+浓度之比为10:1 B、向水中加入少量硫酸氢钠固体或氯化铁固体,水的电离平衡均逆向移动 C、纯水的pH=6.5,显酸性 D、pH均为2的CH3COOH溶液与H2SO4溶液中水电离出的H+浓度不同4. 25 ℃时,0.01 mol/L的HCl溶液中水电离出的H+的浓度是( )A、1×10-10 mol/L B、1×10-2 mol/L C、1×10-7 mol/L D、1×10-12 mol/L5. 下列化学用语书写正确的是( )A、次氯酸的电离方程式:HClO=H++ClO- B、硫化钠水解的离子方程式:S2-+2H2O H2S+2OH- C、电解精炼铜的阴极反应式:Cu-2e-=Cu2+ D、碳酸钙的溶解平衡:CaCO3(s) Ca2+(aq)+CO32-(aq)6. 25℃时,将0.1mol·L-1氨水溶液加水稀释,下列数值变大的是( )A、c(OH-) B、pH C、Kb D、n(H+)·n(OH-)7. 检验某溶液X中是否含有 Na+、K+、Fe3+、Mg2+、Iˉ、Cl-、CO32ˉ、SO42ˉ,限用的试剂有:盐酸、硫酸、硝酸银溶液、硝酸钡溶液。设计如下实验步骤,并记录相关现象。下列叙述不正确的是 ( )
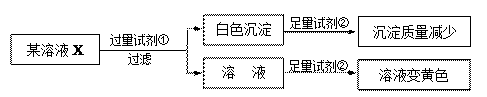 A、溶液X中一定含有Iˉ、CO32ˉ、SO42ˉ B、通过在黄色溶液中加入硝酸银溶液可以检验溶液X中是否存在Cl- C、试剂①为硝酸钡溶液 D、通过焰色反应,可确认溶液X中阳离子的种类8. 某同学利用菱镁矿(主要含 MgCO3 , FeCO3 杂质)制取碱式氯化镁[Mg(OH)Cl]的流程。已知:MgO 用于调节沉淀池中溶液的 pH 值。
A、溶液X中一定含有Iˉ、CO32ˉ、SO42ˉ B、通过在黄色溶液中加入硝酸银溶液可以检验溶液X中是否存在Cl- C、试剂①为硝酸钡溶液 D、通过焰色反应,可确认溶液X中阳离子的种类8. 某同学利用菱镁矿(主要含 MgCO3 , FeCO3 杂质)制取碱式氯化镁[Mg(OH)Cl]的流程。已知:MgO 用于调节沉淀池中溶液的 pH 值。
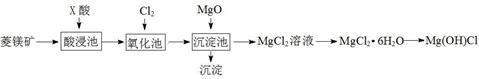
下列说法不正确的是:( )
A、酸浸池中加入的 X 酸可以是硫酸 B、加入 MgO后的沉淀一定含有 Fe(OH)3 C、氧化池中通入氯气的目的是将 Fe2+氧化为 Fe3+ D、制得碱式氯化镁的方程式为:MgCl2·6H2O Mg(OH)Cl + HCl↑ + 5H2O↑9. 常温下,将1.0 mol·L-1的氨水滴入10 mL1.0 mol·L-1盐酸中,溶液pH和温度随加入氨水体积变化曲线如图所示,下列有关说法正确的是( )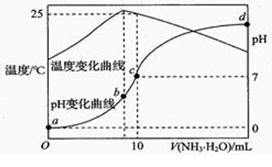 A、KW的比较:a点>b点 B、水的电离程度:a>b>c>d C、b点时溶液中c(NH4+)>c(Cl-)>c(H+)>c(OH-) D、c点时溶液中c(NH4+)=c(Cl-)>c(H+)=c(OH-)10. 25℃时,水的电离达到平衡:H2O H++ OH- ΔH > 0 ,下列叙述正确的是( )A、向水中加入稀氨水,平衡逆向移动,c(OH-)降低 B、向水中加入少量固体NaHSO4 , c(H+)增大,Kw不变 C、向水中加入少量固体CH3COONa ,平衡逆向移动,c(H+)降低 D、将水加热,Kw增大,pH不变11. 下列图示与对应的叙述相符的是( )
A、KW的比较:a点>b点 B、水的电离程度:a>b>c>d C、b点时溶液中c(NH4+)>c(Cl-)>c(H+)>c(OH-) D、c点时溶液中c(NH4+)=c(Cl-)>c(H+)=c(OH-)10. 25℃时,水的电离达到平衡:H2O H++ OH- ΔH > 0 ,下列叙述正确的是( )A、向水中加入稀氨水,平衡逆向移动,c(OH-)降低 B、向水中加入少量固体NaHSO4 , c(H+)增大,Kw不变 C、向水中加入少量固体CH3COONa ,平衡逆向移动,c(H+)降低 D、将水加热,Kw增大,pH不变11. 下列图示与对应的叙述相符的是( )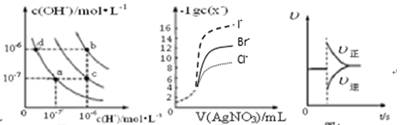

图1 图2 图3 图4
A、图1中在b点对应温度下,将pH=2的H2SO4溶液与pH=12的NaOH溶液等体积混合后,溶液显中性 B、用0.0100 mol/L硝酸银标准溶液,滴定浓度均为0.1000 mol/L Cl-、Br-及I-的混合溶液,由图2曲线,可确定首先沉淀的是Cl- C、图3表示在N2(g)+3H2(g) 2NH3(g)达到平衡后,减小NH3浓度时速率的变化 D、图4表示常温下,稀释HA,HB两种酸的稀溶液时,溶液pH随加水量的变化,则等物质的量浓度的NaA和NaB混合溶液中:c(Na+)>c(A-)>c(B-)>c(OH-)>c(H+)12. 25℃时,下列有关溶液中微粒的物质的量浓度关系正确的是( )A、pH=1的NaHSO4溶液:c(H+)=c(SO42-)+c(OH-) B、0.1mol/LNH4Cl与0.1mol/L氨水等体积混合(pH>7):c(NH3·H2O)>c(NH4+)>c(Cl-)>c(OH-) C、0.1mol/LNa2C2O4与0.1mol/LHCl溶液等体积混合(H2C2O4为二元弱酸):2c(C2O42-)+c(HC2O4-)+c(OH-)=c(Na+)+c(H+) D、0.1mol/LNa2CO3与0.1mol/LNaHCO3溶液等体积混合:3c(Na+)=2[c(CO32-)+c(HCO3-)+c(H2CO3)]13. 已知298K时下列物质的溶度积(单位略)
下列说法正确的是( )
A、等体积,浓度均为0.02 mol·L-1的CH3COONa和AgNO3溶液混合能产生沉淀 B、离子浓度均为0.01 mol·L-1的CrO42-和Cl-混合溶液中慢慢滴入AgNO3溶液时,CrO42-先沉淀 C、在CH3COOAg悬浊液中加入盐酸发生反应的离子方程式为:CH3COOAg+H++Cl-=CH3COOH+AgCl↓ D、298K时,上述四种饱和溶液的物质的量浓度:c(CH3COOAg)>c(AgCl)>c(Ag2CrO4)>c(Ag2S)二、综合题
-
14. 某小组探究影响金属与水反应剧烈程度的因素。(1)、分别将等质量的 Na块和 Mg 条(打磨光亮)投入水中,记录现象如下:

补全 Na 与水反应的实验现象:。
(2)、探究 Mg 与水反应缓慢的原因。资料:Mg 水反应时,Mg 表面覆盖了致密的 Mg(OH)2 导致反应缓慢;NH4+ 和 HCO3-可以加快 Mg 与水反应。
同学们为了验证 NH4+ 和 HCO3-对 Mg 与水反应的促进作用,用与水反应后的 Mg条与 4 种盐溶液进行对比实验,结果如下
实验序号
a
b
c
d
盐溶液(均为 0.1 mol/L)
NH4Cl
NaHCO3
NaCl
NH4HCO3
溶液起始 pH
5.1
8.3
7.0
7.8
30min 时产生气体体积(mL)
1.5
0.7
<0.1
1.4
气体的主要成分
H2
30min 时镁条表面情况
大量固体附着(固体可溶于盐酸)
① 根据 Mg(OH)2 的溶解平衡可解释 NH4+ 和 HCO3- 的作用。Mg(OH)2 的溶解平衡表达式是。
② 经检验,a中还生成少量其他气体,可进一步证明 NH4促进 Mg与水反应。检验该气体的方法是。
③ 上表中能够说明 HCO3-对 Mg 与水反应起促进作用的证据是。
④ b、d 所得固体中还检验出碱式碳酸镁[用 Mg2(OH)2CO3 表示],写出生成该固体的离子方程式。
综合实验 a~d 可以得到的结论是: NH4+ 和 HCO3-都能与 Mg(OH)2 作用加快 Mg与水反应,(补充两点)。
(3)、实验表明:与水反应的剧烈程度 K>Na>Ca>Mg。结合上述实验说明影响金属与水 反应剧烈程度的因素有。15. 物质在水中可能存在电离平衡、盐的水解平衡和沉淀的溶解平衡,它们都可看做化学平衡。请根据所学的知识回答:(1)、0.1 mol·L-1的NH4Cl溶液,在该溶液中各种离子的浓度由大到小顺序为。(2)、0.1 mol·L-1 NaHCO3溶液,请分析NaHCO3溶液显碱性的原因:。(3)、FeCl3溶液,实验室中配制FeCl3溶液时常加入以抑制其水解。(4)、向含有AgI固体的饱和溶液中:①加入固体AgNO3 , 则c(I-)(填“变大”、“ 变小”或“不变”,下同),c(Ag+) 。
②若改加更多的AgI,则c(Ag+)将。
③若改加Na2S固体,则c(I-) , c(Ag+)。
16. 已知草酸镍晶体(NiC2O4·2H2O)难溶于水,工业上从废镍催化剂(主要成分为Ni,含有一定量的Al2O3、FeO、SiO2、CaO等)制备草酸镍晶体的流程如图所示: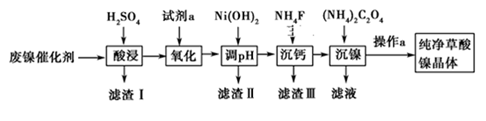
已知:①相关金属离子生成氢氧化物沉淀的pH见表中数据:
金属离子
Fe3+
Fe2+
Al3+
Ni2+
开始沉淀的pH
1.1
5.8
3.0
6.8
完全沉淀的pH
3.2
8.8
5.0
9.5
②Ksp(CaF2)=1.46×10-10;
③当某物质浓度小于1.0×10-5 mol·L-1时,视为完全沉淀。
请回答下列问题:
(1)、请写出一种能提高“酸浸”速率的措施:。(2)、试剂a是一种绿色氧化剂,写出“氧化”时反应的离子方程式:。(3)、“调pH”时pH的调控范围为。(4)、写出“沉镍”时发生反应的离子方程式: , 当Ca2+沉淀完全时,溶液中 c(F-)>mol·L-1(写出计算式即可)。(5)、操作a的内容是。17. 镁在航空航天、国防工业等领域有广泛应用。某小组利用某工厂废弃物(主要含MgCO3、MgSiO3、Al2O3和Fe2O3)设计回收镁的工艺流程如下: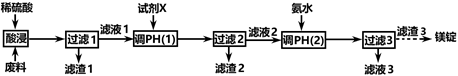 (1)、酸浸过程中采用“粉碎废料、加热和搅拌、适当提高稀硫酸的浓度”等措施的目的是。
(1)、酸浸过程中采用“粉碎废料、加热和搅拌、适当提高稀硫酸的浓度”等措施的目的是。为了提高产品纯度,试剂X宜选择()(填代号)。
A.CuO
B.MgO
C.MgCO3
D.氨水
(2)、滤渣1的主要成分是:滤渣2的主要成分是(填化学式)。(3)、写出生成滤渣3的离子方程式。(4)、已知:298K,时,Ksp[Al(OH)3]=3.0 × 10-34 , Ksp[Fe(OH)3]=4.0 × 10-38 , 加入试剂X,当Al3+开始沉淀时,溶液中c(Al3+)∕c(Fe3+)=。(5)、若废料中镁元素的质量分数为a% ,利用mkg这种废料按上述流程生产,最终回收到质量分数为b%的镁锭wkg,则它的产率为% 。(6)、参照海水提镁的某些步骤和上述流程图,设计经三步由滤渣3得到镁锭的路线。