备考2020年高考化学二轮专题 09 化学反应速率与化学平衡
试卷更新日期:2020-04-08 类型:二轮复习
一、单选题
-
1. 已知:X(g)+2Y(g) 3Z(g) ∆H=﹣a kJ·molˉ1(a>0),下列说法不正确的是( )A、0.1 mol X和0.2 mol Y充分反应生成Z,放出能量一定小于0.1 a kJ B、Y的起始浓度不能为零,平衡浓度也不能为零 C、在其他条件不变的情况下,降低反应温度,正、逆反应速率均减小 D、当反应达到平衡状态时,一定存在3v(Y)正=2v(Z)逆2. 在2L的密闭容器中充入2 molX(g)和1 mol Y(g),发生反应2X(g) +Y(g) 3Z(g) △H,反应过程中持续升高温度,测得混合体系中X的体积分数与温度的关系如图所示,下列推断正确的是( )
 A、升高温度.平衡常数增大 B、W点Y的正反应速率等于M点Y的正反应速率 C、Q点时,Y的转化率最大 D、平衡时充入3molZ,达到新平衡时Z的体积分数比原平衡时大3. 在相同的密闭容器中,用高纯度纳米级Cu2O分别进行催化分解水的实验:2 H2O(g) 2 H2(g) + O2(g) ∆H>0,实验测得反应体系中水蒸气浓度(mol·L-1)的变化结果如下:
A、升高温度.平衡常数增大 B、W点Y的正反应速率等于M点Y的正反应速率 C、Q点时,Y的转化率最大 D、平衡时充入3molZ,达到新平衡时Z的体积分数比原平衡时大3. 在相同的密闭容器中,用高纯度纳米级Cu2O分别进行催化分解水的实验:2 H2O(g) 2 H2(g) + O2(g) ∆H>0,实验测得反应体系中水蒸气浓度(mol·L-1)的变化结果如下:序号
时间/min
0
10
20
30
40
60
①
温度T1 / 1号Cu2O
0.0500
0.0492
0.0486
0.0482
0.0480
0.0480
②
温度T1 / 2号Cu2O
0.0500
0.0490
0.0483
0.0480
0.0480
0.0480
③
温度T2 / 2号Cu2O
0.0500
0.0480
0.0470
0.0470
0.0470
0.0470
下列说法不正确的是( )
A、实验时的温度T2高于T1 B、2号Cu2O的催化效率比1号Cu2O的催化效率高 C、实验①前20 min的平均反应速率v(O2) = 7×10ˉ5 mol·Lˉ1·minˉ1 D、等质量纳米级Cu2O比微米级Cu2O催化效率高,这与Cu2O的粒径大小有关4. 反应COCl2(g) CO(g)+Cl2(g) ΔH>0,达到平衡时,下列措施能提高COCl2转化率的是( )①升温 ②恒容通入惰性气体 ③增加CO浓度 ④减压 ⑤加催化剂 ⑥恒压通入惰性气体
A、①②④ B、①④⑥ C、②③⑤ D、③⑤⑥5. 少量铁粉与10mL 0.1mol·L-1的稀盐酸反应速率太慢。为了加快此反应速率而不改变H2的产量可以使用如下方法中的( )①加H2O ②加NaOH固体 ③滴入几滴浓盐酸
④加 CH3COONa固体 ⑤加NaCl溶液 ⑥滴入几滴CuSO4溶液
⑦升高温度(不考虑盐酸挥发) ⑧改用10mL 1mol·L-1盐酸
A、①⑥⑦ B、③⑤⑧ C、③⑦⑧ D、⑤⑦⑧6. 在体积均为1.0 L的两恒容密闭容器中加入足量的相同的碳粉,再分别加入0.1 mol CO2和0.2 mol CO2 , 在不同温度下反应CO2(g)+C(s) 2CO(g)达到平衡,平衡时CO2的物质的量浓度c(CO2)随温度的变化如图所示(图中Ⅰ、Ⅱ、Ⅲ点均处于曲线上)。下列说法正确的是( )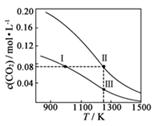 A、反应CO2(g)+C(s) 2CO(g)的ΔS>0、ΔH<0 B、体系的总压强p总:p总(状态Ⅱ)<2p总(状态Ⅰ) C、体系中c(CO):c(CO,状态Ⅱ)<2c(CO,状态Ⅲ) D、逆反应速率:v逆(状态Ⅰ)>v逆(状态Ⅲ )7. 将一定量氨基甲酸铵(NH2COONH4)加入密闭容器中,发生反应NH2COONH4(S) 2NH3(g)+CO2(g)。该反应的平衡常数的负对数(-lgK)值随温度(T)的变化曲线如图所示,下列说法错误的是( )
A、反应CO2(g)+C(s) 2CO(g)的ΔS>0、ΔH<0 B、体系的总压强p总:p总(状态Ⅱ)<2p总(状态Ⅰ) C、体系中c(CO):c(CO,状态Ⅱ)<2c(CO,状态Ⅲ) D、逆反应速率:v逆(状态Ⅰ)>v逆(状态Ⅲ )7. 将一定量氨基甲酸铵(NH2COONH4)加入密闭容器中,发生反应NH2COONH4(S) 2NH3(g)+CO2(g)。该反应的平衡常数的负对数(-lgK)值随温度(T)的变化曲线如图所示,下列说法错误的是( ) A、C点对应状态的平衡常数K(C)=10-3.638 B、该反应的ΔH>0 C、NH3的体积分数不变时,该反应一定达到平衡状态 D、30℃时,B点对应状态的v(正)<v(逆)8. 对于反应A(g)+2B(g) 2C(g),在压强相同的条件下,若生成物C的含量w(C)与时间T的关系如图所示。则下列结论正确的是( )
A、C点对应状态的平衡常数K(C)=10-3.638 B、该反应的ΔH>0 C、NH3的体积分数不变时,该反应一定达到平衡状态 D、30℃时,B点对应状态的v(正)<v(逆)8. 对于反应A(g)+2B(g) 2C(g),在压强相同的条件下,若生成物C的含量w(C)与时间T的关系如图所示。则下列结论正确的是( ) A、T1>T2 , 正反应放热 B、T1<T2 , 正反应放热 C、T1>T2 , 正反应吸热 D、T1<T2 , 正反应吸热9. 一定条件下,在密闭容器中发生反应4NH3(g)+6NO(g) 5N2(g)+6H2O(g)△H<0并建立平衡,在t1和t3时分别改变一个条件,在t2和t4时反应达到新的平衡状态。图1是正反应速率随时间变化的图像,图2是NO的浓度随时间变化的图像,下列说法错误的是( )
A、T1>T2 , 正反应放热 B、T1<T2 , 正反应放热 C、T1>T2 , 正反应吸热 D、T1<T2 , 正反应吸热9. 一定条件下,在密闭容器中发生反应4NH3(g)+6NO(g) 5N2(g)+6H2O(g)△H<0并建立平衡,在t1和t3时分别改变一个条件,在t2和t4时反应达到新的平衡状态。图1是正反应速率随时间变化的图像,图2是NO的浓度随时间变化的图像,下列说法错误的是( ) A、t1时改变的条件是减小生成物浓度 B、t3时正、逆反应速率均增大 C、t3时改变的条件可能是加压或者升温 D、t4时的平衡常数小于t1时的平衡常数10. 对于A2+3B2 2C的反应来说,以下化学反应速率的表示中,反应速率最快的是( )A、v(A2)=0.4mol·L-1·s-1 B、v(B2)=0.8mol·L-1·s-1 C、v(C)=0.6mol·L-1·s-1 D、v(B2)=4.2mol·L-1·min-111. 某密闭容器中发生如下反应:X(g)+3Y(g)⇌2Z(g);△H<0.上图表示该反应的速率(v)随时间(t)变化的关系,t2、t3、t5时刻外界条件有所改变,但都没有改变各物质的初始加入量。下列说法中错误的是( )
A、t1时改变的条件是减小生成物浓度 B、t3时正、逆反应速率均增大 C、t3时改变的条件可能是加压或者升温 D、t4时的平衡常数小于t1时的平衡常数10. 对于A2+3B2 2C的反应来说,以下化学反应速率的表示中,反应速率最快的是( )A、v(A2)=0.4mol·L-1·s-1 B、v(B2)=0.8mol·L-1·s-1 C、v(C)=0.6mol·L-1·s-1 D、v(B2)=4.2mol·L-1·min-111. 某密闭容器中发生如下反应:X(g)+3Y(g)⇌2Z(g);△H<0.上图表示该反应的速率(v)随时间(t)变化的关系,t2、t3、t5时刻外界条件有所改变,但都没有改变各物质的初始加入量。下列说法中错误的是( ) A、 时加入了催化剂 B、 时降低了温度 C、 时增大了压强 D、 时间内转化率最高12. 已知甲为恒压容器、乙为恒容容器。相同条件下充入等物质的量的NO2气体,且起始时体积相同。发生反应:2NO2(g) N2O4(g)△H<0。一段时间后达到平衡状态,下列说法中正确的是( )
A、 时加入了催化剂 B、 时降低了温度 C、 时增大了压强 D、 时间内转化率最高12. 已知甲为恒压容器、乙为恒容容器。相同条件下充入等物质的量的NO2气体,且起始时体积相同。发生反应:2NO2(g) N2O4(g)△H<0。一段时间后达到平衡状态,下列说法中正确的是( ) A、该反应的平衡常数表达式K= B、达到平衡所需时间,甲与乙相等 C、平衡时NO2体积分数:甲<乙 D、若两容器内气体的压强保持不变,均说明反应已达到平衡状态
A、该反应的平衡常数表达式K= B、达到平衡所需时间,甲与乙相等 C、平衡时NO2体积分数:甲<乙 D、若两容器内气体的压强保持不变,均说明反应已达到平衡状态二、实验探究题
-
13. 甲醇是一种用途非常广泛的基础化工原料,可通过下列反应合成:
Ⅰ.CO(g)+2H2(g) CH3OH(g)△H1
Ⅱ.CO2(g)+3H2(g) CH3OH(g)+H2O(g)△H2
Ⅲ.CO(g)+H2O(g) CO2(g)+H2(g)△H3
回答下列问题
(1)、反应(Ⅰ)的△S(填“>”或“<”)0,△H1=(用△H2、△H3表示)。(2)、上述反应的平衡常数的自然对数值lnKP(KP为以分压表示的平衡常数)与温度的关系如图甲所示
①反应(Ⅱ)的△H(填“>”或“<”)0。
②480K时,lnKP(Ⅰ)+lnKp(Ⅱ)+lnKp(Ⅲ)=。
③某温度下,向某恒容密闭容器中充入0.1 molCO和0.2molH2发生反应(Ⅰ),达到平衡时,CO的转化率为90%,若平衡时总压强5MPa,则KP=(KP为以分压表示的平衡常数,分压=总压×物质的量分数)。
(3)、若用CO和CO2混合气体合成甲醇,起始时均控制 =2.60,CO的平衡转化率X(CO)与温度及压强的关系如图乙所示。下列说法正确的是 (填字母)。A、p1<p2<p3 B、升高温度,反应速率和X(CO)均减小 C、起始时若p2=7.2MPa,则H2的分压为5.2MPa D、其他条件不变,增大 ,X(CO)增大三、综合题
-
14. 一定温度下,反应3Fe(s)+4H2O(g) Fe3O4(s)+4H2(g),在一密闭容器中进行达平衡后,试回答:(1)、增加Fe的物质的量,其正反应速率。
(A.变快 B.不变 C.变慢,填字母代号)。
(2)、将容器的体积缩小一半,其正反应速率 ,逆反应速率。(3)、若保持体积不变,充入Ar,其逆反应速率。(4)、保持压强不变,充入Ar,其正反应速率 。15. 已知可逆反应M(g)+N(g) P (g)+Q(g) ,请回答下列问题:(1)、在某温度下,反应物的起始浓度分别为:c(M)= 1 mol•L-1 , c(N)=2.4 mol•L-1 , 达到平衡后,M的转化率为60%,此时N的转化率为 ;该温度时K=。(2)、若温度升高K值增大,则该反应为反应。(填“吸热”或“放热”)。理由。(3)、若反应温度升高,M的转化率(填“增大”“减小”或“不变”;)(4)、若反应温度不变,反应物的起始浓度分别为:c(M)= 4mol•L-1, c(N)=a mol•L-1;达到平衡后,c(P)=2 mol•L-1,a=。(5)、若反应温度不变,反应物的起始浓度为:c(M) = c(N)= b mol•L-1 , 达到平衡后,M的转化率为。16. 火力发电厂释放出大量氮氧化合物(NOx)、SO2和CO2等气体会造成环境问题。对燃煤废气进行脱硝、脱硫和脱碳等处理,可实现绿色环保、节能减排、废物利用等目的。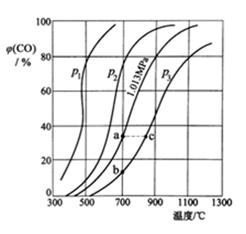 (1)、脱硝。利用甲烷催化还原NOx:
(1)、脱硝。利用甲烷催化还原NOx:CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g) △H1=-574 kJ/mol
CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g) △H2=-1160 kJ/mol
写出CH4(g)与NO2(g)反应生成N2(g)、CO2(g)和H2O(g)的热化学方程式:。
(2)、脱碳。方法一:在恒容密闭容器中将CO2转化为甲醇:CO2(g)+3H2(g) CH3OH(g)+H2O(g)
①下列条件可以判定该反应到达平衡状态的是(填字母)。
A.2v正(H2)=v逆(CH3OH) B.容器内气体的密度不变
C.容器内压强不变 D.反应不再释放热量
方法二:让一定量的CO2与足量碳在体积可变的密闭容器中反应:C(s)+CO2(g) 2CO(g) ∆H,测得压强、温度对CO的体积分数[φ(CO)%]的影响如图所示,回答下列问题:
② 图中p1、p2、p3的大小关系是 , 图中a、b、c三点对应的平衡常数Ka、Kb、Kc大小关系是。
③ 900 ℃、1.013 MPa时,1 mol CO2与足量碳反应达平衡后容器的体积为V L,CO2的转化率为(保留一位小数),该反应的平衡常数K=。
方法三:用NaOH溶液吸收CO2。
④在NaOH溶液中通入一定量的CO2气体,所得溶液中c(HCO32-):c(CO32-)=4:1,此时溶液的pH=。(已知:室温下,H2CO3的K1=4×10-7 , K2=5×10-11。lg2=0.3)
(3)、脱硫。燃煤废气经脱硝、脱碳后,与一定量氨气、空气反应,生成(NH4)2SO4。(NH4)2SO4水溶液呈酸性的原因是(用离子方程式表示);室温时,向(NH4)2SO4溶液中滴入NaOH溶液至溶液呈中性,则所得溶液中微粒浓度大小关系c(Na+)c(NH3·H2O)(填“>”、“<”或“=”)。17. 已知化学反应①:Fe(s)+CO2(g) FeO(s)+CO(g),其化学平衡常数为K1;化学反应②:Fe(s)+H2O(g) FeO(s)+H2(g),其化学平衡常数为K2 , 在温度973 K和1 173 K的情况下,K1、K2的值分别如下:温度
K1
K2
973 K
1.47
2.38
1 173 K
2.15
1.67
请填空:
(1)、反应①的K1表达式是。(2)、现有反应③:CO2(g)+H2(g) CO(g)+H2O(g),该反应的平衡常数K3 , 根据反应①与②可推导出K1、K2与K3之间的关系式为 , 据此关系式及上表数据,能推断出反应③是(填“吸热”或“放热”)反应。(3)、能判断反应③一定处于化学平衡状态的依据是 (填写字母序号)。A、压强不随时间改变 B、气体密度不随时间改变 C、H2的体积分数不随时间改变 D、单位时间内生成H2和H2O(g)的物质的量相等(4)、图甲、乙分别表示反应③在t1时刻达到平衡,在t2时刻因改变某个条件而发生变化的情况:
①图甲中t2时刻发生改变的条件是。
②图乙中t2时刻发生改变的条件是。
(5)、一定条件下处于化学平衡状态的反应③当使CO2和CO的浓度同时增大为原来的两倍时,该反应的化学平衡向移动(填“不”、“逆反应方向”或“正反应方向”)
-