备考2020年高考化学二轮专题 08 元素周期表和元素周期律
试卷更新日期:2020-04-08 类型:二轮复习
一、单选题
-
1. 化学学科中有很多的“规律”,下列规律运用正确的是( )A、酸性:H2CO3<H3PO4<H2SO4<HClO4 , 所以非金属性C<P<S<Cl B、依据强酸能制弱酸的原理,H2SO4能与CuS反应制取H2S C、任何方式下的氧化还原反应,氧化剂的氧化性一定强于氧化产物 D、任何条件下,体积大的气体的物质的量一定比体积小的气体多2. W、X、Y、Z为四种短周期主族元素,在光照条件下W的简单氢化物与氯气反应生成油状液体,X的气态氢化物的水溶液呈碱性,Y原子半径是短周期主族元素原子中最大的,Z2-的电子层结构与氩相同。下列说法错误的是( )A、简单氢化物的稳定性:W<X B、Y与Z形成的化合物的水溶液可使蓝色石蕊试纸变红 C、工业上常用电解熔融Y的氯化物制取Y的单质 D、简单离子半径:Z>X>Y3. X、Y、Z均为短周期主族元素,它们原子的最外层电子数之和为10。X与Z同族,Y最外层电子数等于X次外层电子数,且Y原子半径大于Z。下列叙述正确的是( )。A、熔点:X的氧化物比Y的氧化物高 B、Y的单质与Z的单质均能溶于浓硝酸 C、热稳定性:X的氢化物大于Z的氢化物 D、X与Z可形成离子化合物ZX4. 有A,B,C,D,E,F六种短周期主族元素,它们的相对原子质量依次增大,A是元素周期表中原子半径最小的元素,B的最高正价和最低负价的代数和为0,C和E能形成两种二元化合物,且E的原子序数是C的2倍,D分别和C、E、F反应,产物均是常见离子化合物,且它们都能溶于水或能和水反应。下列叙述正确的是( )A、原子半径D>F>E>B>C>A B、E和F可以用多种方法判断非金属性的强弱 C、E的氧化物都能使品红溶液褪色,加热后又恢复红色 D、含D和F的化合物溶于水,溶液一定显中性5. 2019年是元素周期表诞生150周年,目前周期表七个周期均已排满,共118种元素。短周期元素W、X、Y、Z在周期表中的相对位置如图所示,且四种元素的原子最外层电子数之和为24。
下列说法错误的是( )
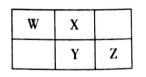 A、最高价氧化物对应水化物的酸性:Z>Y B、W的氢化物与Z的氢化物反应,产物的水溶液呈碱性 C、在元素周期表中,117号元素与Z元素位于同一主族 D、工业上常用YX2漂白纸浆、毛、丝等6. 有X、Y、Z、W、M五种短周期元素,其中X、Y、Z、W同周期,Z、M同主族;X+与M2−具有相同的电子层结构;离子半径:Z2−>W−;Y的单质晶体熔点高、硬度大,是一种重要的半导体材料。下列说法中正确的是( )A、X、M两种元素只能形成X2M型化合物 B、由于W、Z、M元素的氢化物的相对分子质量依次减小,所以其沸点依次降低 C、元素X、Z、W的单质晶体中含相同类型的化学键 D、元素W和M的某些单质可作为水处理中的消毒剂7. 今年是门捷列夫发现元素周期律150周年。下表是元素周期表的一部分,W、X、Y、Z为短周期主族元素,W与X的最高化合价之和为8。下列说法错误的是( )
A、最高价氧化物对应水化物的酸性:Z>Y B、W的氢化物与Z的氢化物反应,产物的水溶液呈碱性 C、在元素周期表中,117号元素与Z元素位于同一主族 D、工业上常用YX2漂白纸浆、毛、丝等6. 有X、Y、Z、W、M五种短周期元素,其中X、Y、Z、W同周期,Z、M同主族;X+与M2−具有相同的电子层结构;离子半径:Z2−>W−;Y的单质晶体熔点高、硬度大,是一种重要的半导体材料。下列说法中正确的是( )A、X、M两种元素只能形成X2M型化合物 B、由于W、Z、M元素的氢化物的相对分子质量依次减小,所以其沸点依次降低 C、元素X、Z、W的单质晶体中含相同类型的化学键 D、元素W和M的某些单质可作为水处理中的消毒剂7. 今年是门捷列夫发现元素周期律150周年。下表是元素周期表的一部分,W、X、Y、Z为短周期主族元素,W与X的最高化合价之和为8。下列说法错误的是( )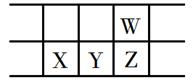 A、原子半径:Y>W B、Y原子通常得失电子都不容易,但在自然界中,Y元素不存在游离态 C、最低价氢化物的沸点:W<Z D、X的最高价氧化物的水化物既能与酸反应又能与碱反应
A、原子半径:Y>W B、Y原子通常得失电子都不容易,但在自然界中,Y元素不存在游离态 C、最低价氢化物的沸点:W<Z D、X的最高价氧化物的水化物既能与酸反应又能与碱反应二、综合题
-
8. 请阅读下列材料,回答问题。
联合国将2019年定为“国际化学元素周期表年”,以纪念门捷列夫发现元素周期律150周年。元素周期律把元素及其化合物纳入一个统一的理论体系,为系统研究元素及其化合物提供了科学方法,为发现和探索新元素、新物质提供了有效思路。
(1)、为纪念门捷列夫,科学家将1955年人工合成的一种新元素用符号“Md”表示,中文命名为“钔”。核素 Md的质量数为( )A、101 B、157 C、258 D、359(2)、Mg和Si都属于元素周期表第3周期元素,它们原子结构中相同的是( )A、质子数 B、电子层数 C、核外电子数 D、最外层电子数(3)、判断Cl的非金属性比S的强,可依据的事实是( )A、HCl的热稳定性比H2S的强 B、氯气能溶于水,硫难溶于水 C、常温下,氯单质呈气态,硫单质呈固态 D、AgCl是白色固体,Ag2S是黑色固体(4)、锂是第2周期ⅠA族元素,下列有关锂元素性质推测正确的是( )A、最高化合价为+2 B、原子半径比钠的大 C、单质与水的反应比钠更剧烈 D、最高价氧化物对应的水化物碱性比钠的弱9. 下表是元素周期表的一部分,请用化学符号回答有关问题:
周期
主族
ⅠA
ⅡA
ⅢA
ⅣA
ⅤA
ⅥA
ⅦA
0
1
①
2
②
③
④
⑤
3
⑥
⑦
⑧
⑨
⑩
(1)、表中化学性质最不活泼的元素,其原子结构示意图为 。(2)、②、⑧、⑨、⑩四种元素的简单气态氢化物稳定性由强到弱的顺序是 , 最高价氧化物的水化物中酸性最强的是 。(3)、第三周期元素形成的简单离子中半径最小的微粒是 , 写出该元素的单质分别与⑥、⑩最高价氧化物的水化物反应的离子方程式、 。(4)、元素③的氢化物的电子式是;该氢化物与元素⑩的氢化物发生反应的化学方程式。(5)、用电子式分别写出元素⑩与元素②、⑥形成化合物过程 、。
10. X、Y、Z是阳离子,K是阴离子,M、N 是中性分子。它们都由短周期组成,且具有以下结构特征和性质:①它们核外电子总数都相同;
②N 溶于M中,滴入酚酞,溶液变红;
③Y和K都由A、B两元素组成,Y 核内质子总数比K多两个;
④X和N 都由A、C两元素组成,X和Y核内质子总数相等;
⑤X和K的浓溶液在加热情况下生成M和N;
⑥Z为单核离子,向含有Z的溶液中加入少量K溶液,有白色沉淀生成,再加入过量的K或Y的溶液,沉淀消失
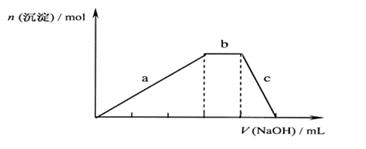
(1)、Y的化学式为 检验X 的离子的方法 (用离子方程式表示)(2)、试比较M和N 的稳定性:M N(3)、写出Z和N 的水溶液反应的离子方程式(4)、上述六种微粒中的两种阳离子可与硫酸根形成一种复盐,向该盐的浓溶液中逐滴加入 0.1mol/L 的NaOH 溶液,出现了如右图中a、b、c三个阶段的图象,根据图象判断该盐的化学式为
(5)、将1.92g铜投入到一定量由A、B、C三种元素形成的一种常见化合物的溶液中,共收集到672mL气体(标准状况下),将盛有此气体的容器倒扣在水槽中,通入一定量的氧气,恰好使气体完全溶于水,则通入氧气在标准状况下的体积 mL
 11. 已知X、Y、Z、M、G、Q是六种短周期主族元素,原子序数依次增大。X、Z、Q的单质在常温下呈气态,Y的原子最外层电子数是其电子层数的2倍,X与M同主族,Z的气态氢化物能与其最高价氧化物的水化物反应,G是地壳中含量最高的金属元素。清回答下列问题:(1)、Q的元素符号为 , Y、Z、M、G四种元素原子半径由大到小的顺序是(写元素符号)。(2)、Y在元素周期表中的位置为 , Y与硫元素形成的二元化合物的电子式为。(3)、上述元素的最高价氧化物对应的水化物酸性最强的是(写化学式)。(4)、单质Y和元素Z的最高价氧化物对应水化物的浓溶液发生反应的化学方程式为。(5)、Z和G组成的化合物GZ,被大量用于制造电子元件。工业上用G的氧化物、Y单质和Z单质在高温下制备GZ,其中G的氧化物和Y单质的物质的量之比为1∶3,则该反应的化学方程式为。12. 下表是元素周期表的一部分,表中的每个字母表示一种短周期元素,回答下列问题:
11. 已知X、Y、Z、M、G、Q是六种短周期主族元素,原子序数依次增大。X、Z、Q的单质在常温下呈气态,Y的原子最外层电子数是其电子层数的2倍,X与M同主族,Z的气态氢化物能与其最高价氧化物的水化物反应,G是地壳中含量最高的金属元素。清回答下列问题:(1)、Q的元素符号为 , Y、Z、M、G四种元素原子半径由大到小的顺序是(写元素符号)。(2)、Y在元素周期表中的位置为 , Y与硫元素形成的二元化合物的电子式为。(3)、上述元素的最高价氧化物对应的水化物酸性最强的是(写化学式)。(4)、单质Y和元素Z的最高价氧化物对应水化物的浓溶液发生反应的化学方程式为。(5)、Z和G组成的化合物GZ,被大量用于制造电子元件。工业上用G的氧化物、Y单质和Z单质在高温下制备GZ,其中G的氧化物和Y单质的物质的量之比为1∶3,则该反应的化学方程式为。12. 下表是元素周期表的一部分,表中的每个字母表示一种短周期元素,回答下列问题: (1)、画出A的原子结构示意图。(2)、A、B、E、F、G五种元素所形成的气态氢化物最稳定的是 (填化学式)。(3)、D在元素周期表中的位置是第3周期族。(4)、E、F元素的最高价氧化物对应水化物的酸性较强的是: (用化学式表示)。(5)、写出C和G形成化合物的电子式。13. X、Y、Z、M四种短周期元素,原子半径M>Z>X>Y,其中X、Y处在同一周期,X、Z处在同一主族。Z原子核内质子数等于X、Y原子核内质子数之和,原子核外最外层上的电子数是M原子核外最外层电子数的4倍。请回答:(1)、这两种元素名称分别是X , M。(2)、Y的简单离子结构示意图是;Z在周期表中的位置是 。(3)、X、Y、Z这三种元素的气态氢化物的稳定性由大而小的顺序是。(4)、X与Y形成的三原子分子甲的结构式是 , Y与M形成的原子个数比为1:1的化合物乙的电子式是 , 甲与乙反应的化学方程式是 。14. 氮、磷、砷 、锑 、铋 、镆 为元素周期表中原子序数依次增大的同族元素。回答下列问题:(1)、砷在元素周期表中的位置。 的中子数为。
(1)、画出A的原子结构示意图。(2)、A、B、E、F、G五种元素所形成的气态氢化物最稳定的是 (填化学式)。(3)、D在元素周期表中的位置是第3周期族。(4)、E、F元素的最高价氧化物对应水化物的酸性较强的是: (用化学式表示)。(5)、写出C和G形成化合物的电子式。13. X、Y、Z、M四种短周期元素,原子半径M>Z>X>Y,其中X、Y处在同一周期,X、Z处在同一主族。Z原子核内质子数等于X、Y原子核内质子数之和,原子核外最外层上的电子数是M原子核外最外层电子数的4倍。请回答:(1)、这两种元素名称分别是X , M。(2)、Y的简单离子结构示意图是;Z在周期表中的位置是 。(3)、X、Y、Z这三种元素的气态氢化物的稳定性由大而小的顺序是。(4)、X与Y形成的三原子分子甲的结构式是 , Y与M形成的原子个数比为1:1的化合物乙的电子式是 , 甲与乙反应的化学方程式是 。14. 氮、磷、砷 、锑 、铋 、镆 为元素周期表中原子序数依次增大的同族元素。回答下列问题:(1)、砷在元素周期表中的位置。 的中子数为。已知: ( ,白磷)= ( ,黑磷) ;
( ,白磷)= ( ,红磷) ;
由此推知,其中最稳定的磷单质是。
(2)、氮和磷氢化物性质的比较:热稳定性: (填“>”“<”)。
沸点: (填“>”“<”),判断依据是。
(3)、 和 与卤化氢的反应相似,产物的结构和性质也相似。下列对 与 反应产物的推断正确的是(填序号)。a.不能与 反应 b.含离子键、共价键 c.能与水反应
(4)、 能发生较强烈的水解,生成难溶的 ,写出该反应的化学方程式 , 因此,配制 溶液应注意。
(5)、在1L真空密闭容器中加入a mol PH4I固体,时发生如下反应:
①②
③
达平衡时,体系中 , , ,则 ℃时反应①的平衡常数 值为(用字母表示)。