2017年高考真题分类汇编(化学):专题7 原电池、电解池工作原理及其应用
试卷更新日期:2017-09-05 类型:二轮复习
一、单选题
-
1.
一种电化学制备NH3的装置如图所示,图中陶瓷在高温时可以传输H+。下列叙述错误的是( )
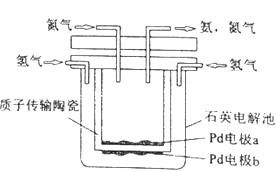 A、Pb电极b为阴极 B、阴极的反应式为:N2+6H++6e−=2NH3 C、H+由阳极向阴极迁移 D、陶瓷可以隔离N2和H22. 下列能量转化过程与氧化还原反应无关的是( )A、硅太阳能电池工作时,光能转化成电能 B、锂离子电池放电时,化学能转化成电能 C、电解质溶液导电时,电能转化成化学能 D、葡萄糖为人类生命活动提供能量时,化学能转化成热能3.
A、Pb电极b为阴极 B、阴极的反应式为:N2+6H++6e−=2NH3 C、H+由阳极向阴极迁移 D、陶瓷可以隔离N2和H22. 下列能量转化过程与氧化还原反应无关的是( )A、硅太阳能电池工作时,光能转化成电能 B、锂离子电池放电时,化学能转化成电能 C、电解质溶液导电时,电能转化成化学能 D、葡萄糖为人类生命活动提供能量时,化学能转化成热能3.全固态锂硫电池能量密度高、成本低,其工作原理如图所示,其中电极a常用掺有石墨烯的S8材料,电池反应为:16Li+xS8=8Li2Sx(2≤x≤8).下列说法错误的是( )
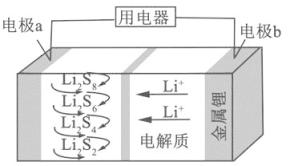 A、电池工作时,正极可发生反应:2Li2S6+2Li++2e﹣=3Li2S4 B、电池工作时,外电路中流过0.02 mol电子,负极材料减重0.14 g C、石墨烯的作用主要是提高电极a的导电性 D、电池充电时间越长,电池中的Li2S2量越多4. 用电解氧化法可以在铝制品表面形成致密、耐腐蚀的氧化膜,电解质溶液一般为H2SO4﹣H2C2O4混合溶液.下列叙述错误的是( )A、待加工铝质工件为阳极 B、可选用不锈钢网作为阴极 C、阴极的电极反应式为:Al3++3e﹣═Al D、硫酸根离子在电解过程中向阳极移动5.
A、电池工作时,正极可发生反应:2Li2S6+2Li++2e﹣=3Li2S4 B、电池工作时,外电路中流过0.02 mol电子,负极材料减重0.14 g C、石墨烯的作用主要是提高电极a的导电性 D、电池充电时间越长,电池中的Li2S2量越多4. 用电解氧化法可以在铝制品表面形成致密、耐腐蚀的氧化膜,电解质溶液一般为H2SO4﹣H2C2O4混合溶液.下列叙述错误的是( )A、待加工铝质工件为阳极 B、可选用不锈钢网作为阴极 C、阴极的电极反应式为:Al3++3e﹣═Al D、硫酸根离子在电解过程中向阳极移动5.支撑海港码头基础的钢管柱,常用外加电流的阴极保护法进行防腐,工作原理如图所示,其中高硅铸铁为惰性辅助阳极.下列有关表述不正确的是( )
 A、通入保护电流使钢管桩表面腐蚀电流接近于零 B、通电后外电路电子被强制从高硅铸铁流向钢管桩 C、高硅铸铁的作用是作为损耗阳极材料和传递电流 D、通入的保护电流应该根据环境条件变化进行调整
A、通入保护电流使钢管桩表面腐蚀电流接近于零 B、通电后外电路电子被强制从高硅铸铁流向钢管桩 C、高硅铸铁的作用是作为损耗阳极材料和传递电流 D、通入的保护电流应该根据环境条件变化进行调整二、综合题
-
6.
(14分)某混合物浆液含有Al(OH)3、MnO2和少量Na2CrO4 . 考虑到胶体的吸附作用使Na2CrO4不易完全被水浸出,某研究小组利用设计的电解分离装置(见图),使浆液分离成固体混合物和含铬元素溶液,并回收利用.回答Ⅰ和Ⅱ中的问题.

Ⅰ.固体混合物的分离和利用(流程图中的部分分离操作和反应条件未标明)
(1)、反应①所加试剂NaOH的电子式为 . B→C的反应条件为 , C→Al的制备方法称为 .(2)、该小组探究反应②发生的条件.D与浓盐酸混合,不加热,无变化;加热有Cl2生成,当反应停止后,固体有剩余,此时滴加硫酸,又产生Cl2 . 由此判断影响该反应有效进行的因素有(填序号) .a.温度 b.Cl﹣的浓度 c.溶液的酸度
(3)、0.1mol Cl2与焦炭、TiO2完全反应,生成一种还原性气体和一种易水解成TiO2•xH2O的液态化合物,放热4.28kJ,该反应的热化学方程式为 .Ⅱ含铬元素溶液的分离和利用
(4)、用惰性电极电解时,CrO42﹣能从浆液中分离出来的原因是 , 分离后含铬元素的粒子是;阴极室生成的物质为(写化学式).7. 铝是应用广泛的金属.以铝土矿(主要成分为Al2O3 , 含SiO2和Fe2O3等杂质)为原料制备铝的一种工艺流程如下: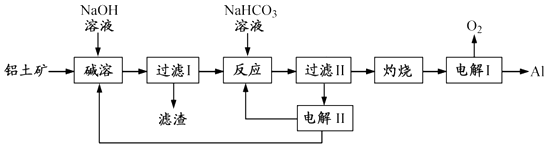
注:SiO2在“碱溶”时转化为铝硅酸钠沉淀.
(1)、“碱溶”时生成偏铝酸钠的离子方程式为 .(2)、向“过滤Ⅰ”所得滤液中加入NaHCO3溶液,溶液的pH (填“增大”、“不变”或“减小”).(3)、“电解Ⅰ”是电解熔融 Al2O3 , 电解过程中作阳极的石墨易消耗,原因是 .(4)、“电解Ⅱ”是电解Na2CO3溶液,原理如图所示.
阳极的电极反应式为 , 阴极产生的物质A的化学式为 .
(5)、铝粉在1000℃时可与N2反应制备AlN.在铝粉中添加少量NH4Cl固体并充分混合,有利于AlN的制备,其主要原因是 .8. 某小组在验证反应“Fe+2Ag+=Fe2++2Ag”的实验中检测到Fe3+ , 发现和探究过程如下.向硝酸酸化的0.05mol•L﹣1硝酸银溶液(pH≈2)中加入过量铁粉,搅拌后静置,烧杯底部有黑色固体,溶液呈黄色.
(1)、检验产物①取少量黑色固体,洗涤后,(填操作和现象),证明黑色固体中含有Ag.
②取上层清液,滴加K3[Fe(CN)6]溶液,产生蓝色沉淀,说明溶液中含有 .
(2)、针对“溶液呈黄色”,甲认为溶液中有Fe3+ , 乙认为铁粉过量时不可能有Fe3+ , 乙依据的原理是(用离子方程式表示).针对两种观点继续实验:
①取上层清液,滴加KSCN溶液,溶液变红,证实了甲的猜测.同时发现有白色沉淀产生,且溶液颜色变浅、沉淀量多少与取样时间有关,对比实验记录如下:
序号
取样时间/min
现象
ⅰ
3
产生大量白色沉淀;溶液呈红色
ⅱ
30
产生白色沉淀;较3min时量小;溶液红色较3min时加深
ⅲ
120
产生白色沉淀;较30min时量小;溶液红色较3 0min时变浅
(资料:Ag+与SCN﹣生成白色沉淀AgSCN)
②对Fe3+产生的原因作出如下假设:
假设a:可能是铁粉表面有氧化层,能产生Fe3+;
假设b:空气中存在O2 , 由于(用离子方程式表示),可产生Fe3+;
假设c:酸性溶液中NO3﹣具有氧化性,可产生Fe3+;
假设d:根据现象,判断溶液中存在Ag+ , 可产生Fe3+ .
③下列实验Ⅰ可证实假设a、b、c不是产生Fe3+的主要原因.实验Ⅱ可证实假设d成立.
实验Ⅰ:向硝酸酸化的溶液(pH≈2)中加入过量铁粉,搅拌后静置,不同时间取上层清液滴加KSCN溶液,3min时溶液呈浅红色,30min后溶液几乎无色.
实验Ⅱ:装置如图.其中甲溶液是 , 操作现象是 .
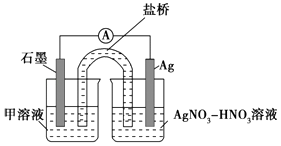 (3)、根据实验现象,结合方程式推测实验ⅰ~ⅲ中Fe3+浓度变化的原因: .
(3)、根据实验现象,结合方程式推测实验ⅰ~ⅲ中Fe3+浓度变化的原因: .