2017年高考真题分类汇编(化学):专题3 化学计量与计算 NA
试卷更新日期:2017-09-05 类型:二轮复习
一、单选题
-
1. NA为阿伏加德罗常数的值。下列叙述错误的是( )A、1 mol 乙烯分子中含有的碳氢键数为4NA B、1 mol 甲烷完全燃烧转移的电子数为8NA C、1 L 0.1 mol·L−1的乙酸溶液中含H+的数量为0.1NA D、1 mol 的CO和N2混合气体中含有的质子数为14NA2. 在酸性条件下,可发生如下反应:
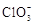 +2M3++4H2O=
+2M3++4H2O= 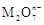 +Cl+8H+ ,
+Cl+8H+ , 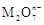 中M的化合价是( ) A、+4 B、+5 C、+6 D、+73. NA为阿伏加德罗常数的值.下列说法正确的是( )A、0.1 mol 的11B中,含有0.6NA个中子 B、pH=1的H3PO4溶液中,含有0.1NA个H+ C、2.24L(标准状况)苯在O2中完全燃烧,得到0.6NA个CO2分子 D、密闭容器中1 mol PCl3与1 mol Cl2反应制备 PCl5(g),增加2NA个P﹣Cl键4. 阿伏加德罗常熟的值为NA . 下列说法正确的是( )A、1L0.1mol•L﹣1NH4CL溶液中,NH4+的数量为0.1NA B、2.4gMg与H2SO4完全反应,转移的电子数为0.1NA C、标准状况下,2.24LN2和O2的混合气体中分子数为0.2NA D、0.1mol H2和0.1mol I2于密闭容器中充分反应后,其分子总数为0.2NA
中M的化合价是( ) A、+4 B、+5 C、+6 D、+73. NA为阿伏加德罗常数的值.下列说法正确的是( )A、0.1 mol 的11B中,含有0.6NA个中子 B、pH=1的H3PO4溶液中,含有0.1NA个H+ C、2.24L(标准状况)苯在O2中完全燃烧,得到0.6NA个CO2分子 D、密闭容器中1 mol PCl3与1 mol Cl2反应制备 PCl5(g),增加2NA个P﹣Cl键4. 阿伏加德罗常熟的值为NA . 下列说法正确的是( )A、1L0.1mol•L﹣1NH4CL溶液中,NH4+的数量为0.1NA B、2.4gMg与H2SO4完全反应,转移的电子数为0.1NA C、标准状况下,2.24LN2和O2的混合气体中分子数为0.2NA D、0.1mol H2和0.1mol I2于密闭容器中充分反应后,其分子总数为0.2NA二、综合题
-
5. (14分)H2S和SO2会对环境和人体健康带来极大的危害,工业上采取多种方法减少这些有害气体的排放,回答下列方法中的问题.
Ⅰ.H2S的除去
方法1:生物脱H2S的原理为:
H2S+Fe2(SO4)3═S↓+2FeSO4+H2SO4
4FeSO4+O2+2H2SO4 2Fe2(SO4)3+2H2O
(1)、硫杆菌存在时,FeSO4被氧化的速率是无菌时的5×105倍,该菌的作用是 .(2)、由图1和图2判断使用硫杆菌的最佳条件为 . 若反应温度过高,反应速率下降,其原因是 .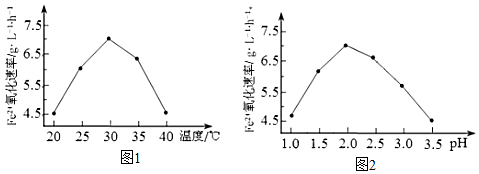 (3)、方法2:在一定条件下,用H2O2氧化H2S
(3)、方法2:在一定条件下,用H2O2氧化H2S随着参加反应的n(H2O2)/n(H2S)变化,氧化产物不同.当n(H2O2)/n(H2S)=4时,氧化产物的分子式为 .
(4)、Ⅱ.SO2的除去方法1(双碱法):用NaOH吸收SO2 , 并用CaO使NaOH再生
NaOH溶液 Na2SO3溶液
写出过程①的离子方程式:;CaO在水中存在如下转化:
CaO(s)+H2O (l)═Ca(OH)2(s)⇌Ca2+(aq)+2OH﹣(aq)
从平衡移动的角度,简述过程②NaOH再生的原理 .
(5)、方法2:用氨水除去SO2已知25℃,NH3•H2O的Kb=1.8×10﹣5 , H2SO3的Ka1=1.3×10﹣2 , Ka2=6.2×10﹣8 . 若氨水的浓度为2.0mol•L﹣1 , 溶液中的c(OH﹣)=mol•L﹣1 . 将SO2通入该氨水中,当c(OH﹣)降至1.0×10﹣7 mol•L﹣1时,溶液中的c(SO32﹣)/c(HSO3﹣)= .
6. (15分)重铬酸钾是一种重要的化工原料,一般由铬铁矿制备,铬铁矿的主要成分为FeO•Cr2O3 , 还含有硅、铝等杂质.制备流程如图所示: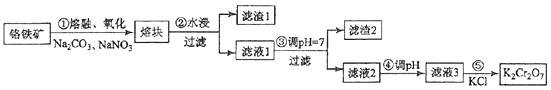
回答下列问题:
(1)、步骤①的主要反应为:FeO•Cr2O3+Na2CO3+NaNO3 Na2CrO4+Fe2O3+CO2+NaNO2上述反应配平后FeO•Cr2O3与NaNO3的系数比为 . 该步骤不能使用陶瓷容器,原因是 .(2)、滤渣1中含量最多的金属元素是 , 滤渣2的主要成分是及含硅杂质.(3)、步骤④调滤液2的pH使之变(填“大”或“小”),原因是(用离子方程式表示).(4)、有关物质的溶解度如图所示.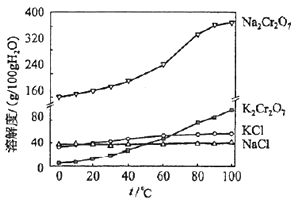
向“滤液3”中加入适量KCl,蒸发浓缩,冷却结晶,过滤得到K2Cr2O7固体.冷却到(填标号)得到的K2Cr2O7固体产品最多.
a.80℃ b.60℃ c.40℃ d.10℃
步骤⑤的反应类型是 .
(5)、某工厂用m1 kg 铬铁矿粉(含Cr2O3 40%)制备K2Cr2O7 , 最终得到产品 m2 kg,产率为 .7. (14分)Li4Ti3O12和LiFePO4都是锂离子电池的电极材料,可利用钛铁矿(主要成分为Fe TiO3 , 还含有少量MgO、SiO2等杂质)来制备,工艺流程如下: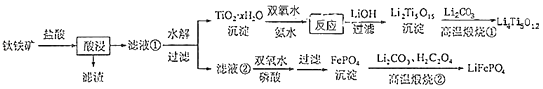
回答下列问题:
(1)、“酸浸”实验中,铁的浸出率结果如下图所示.由图可知,当铁的净出率为70%时,所采用的实验条件为 .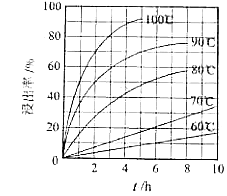 (2)、“酸浸”后,钛主要以TiOCl42﹣形式存在,写出相应反应的离子方程式 .(3)、TiO2•xH2O沉淀与双氧水、氨水反应40min所得实验结果如下表所示:
(2)、“酸浸”后,钛主要以TiOCl42﹣形式存在,写出相应反应的离子方程式 .(3)、TiO2•xH2O沉淀与双氧水、氨水反应40min所得实验结果如下表所示:温度/℃
30
35
40
45
50
TiO2•xH2O转化率/%
92
95
97
93
88
分析40℃时TiO2•xH2O转化率最高的原因 .
(4)、Li2Ti5O15中Ti的化合价为+4,其中过氧键的数目为 .(5)、若“滤液②”中c(Mg2+)=0.02mol•L﹣1 , 加入双氧水和磷酸(设溶液体积增加1倍),使Fe3+恰好沉淀完全即溶液中c(Fe3+)=1.0×10﹣5 , 此时是否有Mg3(PO4)2沉淀生成?(列式计算).FePO4、Mg3(PO4)2的分别为1.3×10﹣22、1.0×10﹣24(6)、写出“高温煅烧②”中由FePO4制备LiFePO4的化学方程式 .8. SCR和NSR技术可有效降低柴油发动机在空气过量条件下的NOx排放.(1)、SCR(选择性催化还原)工作原理: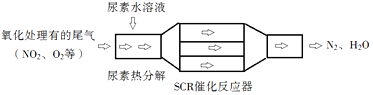
①尿素[CO(NH2)2]水溶液热分解为NH3和CO2 , 该反应的化学方程式: .
②反应器中NH3还原NO2的化学方程式: .
③当燃油中含硫量较高时,尾气中SO2在O2作用下会形成(NH4)2SO4 , 使催化剂中毒.用化学方程式表示(NH4)2SO4的形成: .
④尿素溶液浓度影响NO2的转化,测定溶液中尿素(M=60g•mol﹣1)含量的方法如下:取a g尿素溶液,将所含氮完全转化为NH3 , 所得NH3用过量的v1 mL c1 mol•L﹣1H2SO4溶液吸收完全,剩余H2SO4用v2mL c2 mol•L﹣1NaOH溶液恰好中和,则尿素溶液中溶质的质量分数是 .
(2)、NSR(NOx储存还原)工作原理:NOx的储存和还原在不同时段交替进行,如图a所示.
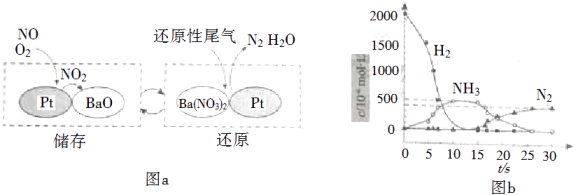
①通过BaO和Ba(NO3)2的相互转化实验NOx的储存和还原.储存NOx的物质是 .
②用H2模拟尾气中还原性气体研究了Ba(NO3)2的催化还原过程,该过程分两步进行,图b表示该过程相关物质浓度随时间的变化关系.第一步反应消耗的H2与Ba(NO3)2的物质的量之比是 .
③还原过程中,有时会产生笑气(N2O).用同位素示踪法研究发现笑气的产生与NO有关.在有氧条件下15NO与NH3以一定比例反应时,得到的笑气几乎都是15NNO.将该反应的化学方程式补充完整: .