2017年高考真题分类汇编(化学):专题2 物质的组成变化和性质用途、化学用语
试卷更新日期:2017-09-05 类型:二轮复习
一、单选题
-
1.
2016年IUPAC命名117号元素为Ts(中文名“
 ”,tián),Ts的原子核外最外层电子数是7,下列说法不正确的是( )A、Ts是第七周期第ⅦA族元素 B、Ts的同位素原子具有相同的电子数 C、Ts在同族元素中非金属性最弱 D、中子数为176的TS核素符号是 Ts2. 下列分子中,其中子总数为24的是( )A、18O3 B、2H217O2 C、14N16O2 D、14C16O2
”,tián),Ts的原子核外最外层电子数是7,下列说法不正确的是( )A、Ts是第七周期第ⅦA族元素 B、Ts的同位素原子具有相同的电子数 C、Ts在同族元素中非金属性最弱 D、中子数为176的TS核素符号是 Ts2. 下列分子中,其中子总数为24的是( )A、18O3 B、2H217O2 C、14N16O2 D、14C16O2二、综合题
-
3. X、Y、L、M为核电荷数依次增大的前20号主族元素。X2是最轻的气体,Y、L与M三种元素的质子数均为5的倍数。回答下列问题:(1)、X与L组成的最简单化合物的电子式为。(2)、X与M组成的物质为(填“共价”或“离子”)化合物,该物质可作为野外工作的应急燃料,其与水反应的化学方程式为。(3)、Y在周期表中的位置是 , 其含氧酸的化学式为。(4)、L与M形成的化合物中L的化合价是。4.
(14分)某混合物浆液含有Al(OH)3、MnO2和少量Na2CrO4 . 考虑到胶体的吸附作用使Na2CrO4不易完全被水浸出,某研究小组利用设计的电解分离装置(见图),使浆液分离成固体混合物和含铬元素溶液,并回收利用.回答Ⅰ和Ⅱ中的问题.

Ⅰ.固体混合物的分离和利用(流程图中的部分分离操作和反应条件未标明)
(1)、反应①所加试剂NaOH的电子式为 . B→C的反应条件为 , C→Al的制备方法称为 .(2)、该小组探究反应②发生的条件.D与浓盐酸混合,不加热,无变化;加热有Cl2生成,当反应停止后,固体有剩余,此时滴加硫酸,又产生Cl2 . 由此判断影响该反应有效进行的因素有(填序号) .a.温度 b.Cl﹣的浓度 c.溶液的酸度
(3)、0.1mol Cl2与焦炭、TiO2完全反应,生成一种还原性气体和一种易水解成TiO2•xH2O的液态化合物,放热4.28kJ,该反应的热化学方程式为 .Ⅱ含铬元素溶液的分离和利用
(4)、用惰性电极电解时,CrO42﹣能从浆液中分离出来的原因是 , 分离后含铬元素的粒子是;阴极室生成的物质为(写化学式).5. (15分)研究发现,在CO2低压合成甲醇反应(CO2+3H2=CH3OH+H2O)中,Co氧化物负载的Mn氧化物纳米粒子催化剂具有高活性,显示出良好的应用前景.回答下列问题:(1)、Co基态原子核外电子排布式为 . 元素Mn与O中,第一电离能较大的是 , 基态原子核外未成对电子数较多的是 .(2)、CO2和CH3OH分子中C原子的杂化形式分别为和 .(3)、在CO2低压合成甲醇反应所涉及的4种物质中,沸点从高到低的顺序为 , 原因是 .(4)、硝酸锰是制备上述反应催化剂的原料,Mn(NO3)2中的化学键除了σ键外,还存在 .(5)、MgO具有NaCl型结构(如图),其中阴离子采用面心立方最密堆积方式,X射线衍射实验测得MgO的晶胞参数为a=0.420nm,则r(O2﹣)为nm.MnO也属于NaCl型结构,晶胞参数为a'=0.448nm,则r(Mn2+)为nm.
 6. (14分)砷(As)是第四周期ⅤA族元素,可以形成As2S3、As2O5、H3AsO3、H3AsO4等化合物,有着广泛的用途.回答下列问题:(1)、画出砷的原子结构示意图 .(2)、工业上常将含砷废渣(主要成分为As2S3)制成浆状,通入O2氧化,生成H3AsO4和单质硫.写出发生反应的化学方程式 . 该反应需要在加压下进行,原因是 .(3)、已知:As(s)+ H2(g)+2O2(g)=H3AsO4(s)△H1
6. (14分)砷(As)是第四周期ⅤA族元素,可以形成As2S3、As2O5、H3AsO3、H3AsO4等化合物,有着广泛的用途.回答下列问题:(1)、画出砷的原子结构示意图 .(2)、工业上常将含砷废渣(主要成分为As2S3)制成浆状,通入O2氧化,生成H3AsO4和单质硫.写出发生反应的化学方程式 . 该反应需要在加压下进行,原因是 .(3)、已知:As(s)+ H2(g)+2O2(g)=H3AsO4(s)△H1H2(g)+ O2(g)=H2O(l)△H2
2As(s)+ O2(g)=As2O5(s)△H3
则反应As2O5(s)+3H2O(l)=2H3AsO4(s)的△H= .
(4)、298K时,将20mL 3x mol•L﹣1 Na3AsO3、20mL 3x mol•L﹣1 I2和20mL NaOH溶液混合,发生反应:AsO33﹣(aq)+I2(aq)+2OH﹣⇌AsO43﹣(aq)+2I﹣(aq)+H2O(l).溶液中c(AsO43﹣)与反应时间(t)的关系如图所示.

①下列可判断反应达到平衡的是(填标号).
a.溶液的pH不再变化
b.v(I﹣)=2v(AsO33﹣)
c.c (AsO43﹣)/c (AsO33﹣)不再变化
d.c(I﹣)=y mol•L﹣1
②tm时,v正 v逆(填“大于”“小于”或“等于”).
③tm时v逆tn时v逆(填“大于”“小于”或“等于”),理由是 .
④若平衡时溶液的pH=14,则该反应的平衡常数K为 .
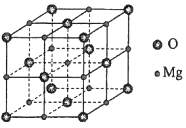
7. (15分)我国科学家最近成功合成了世界上首个五氮阴离子盐(N5)6(H3O)3(NH4)4Cl(用R代表).回答下列问题:(1)、氮原子价层电子对的轨道表达式(电子排布图)为 .(2)、元素的基态气态原子得到一个电子形成气态负一价离子时所放出的能量称作第一电子亲和能(E1).第二周期部分元素的E1变化趋势如图(a)所示,
其中除氮元素外,其他元素的E1自左而右依次增大的原因是;氮元素的E1呈现异常的原因是 .
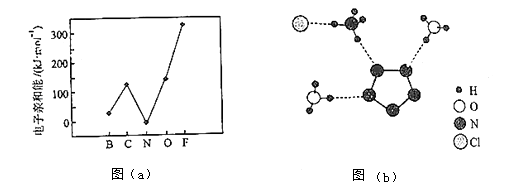
(3)、经X射线衍射测得化合物R的晶体结构,其局部结构如图(b)所示.①从结构角度分析,R中两种阳离子的相同之处为 , 不同之处为 . (填标号)
A.中心原子的杂化轨道类型
B.中心原子的价层电子对数
C.立体结构
D.共价键类型
②R中阴离子N5﹣中的σ键总数为个.分子中的大π键可用符号Πmn表示,其中m代表参与形成的大π键原子数,n代表参与形成的大π键电子数(如苯分子中的大π键可表示为Π66),则N5﹣中的大π键应表示为 .
③图(b)中虚线代表氢键,其表示式为(NH4+)N﹣H…Cl、、 .
(4)、R的晶体密度为dg•cm﹣3 , 其立方晶胞参数为anm,晶胞中含有y个[(N5)6(H3O)3(NH4)4Cl]单元,该单元的相对质量为M,则y的计算表达式为 .